CD49f维持宫颈癌干细胞特性的作用研究
2020-11-06赵海鸥马红梅杨文婷
冯 倩,赵海鸥,马红梅,杨文婷*
(1西安交通大学第一附属医院生殖医学科,西安 710061;2天津市河北区王串场街社区卫生服务中心;*通讯作者,E-mail:04203031@stu.xjtu.edu.cn)
宫颈癌是全球第六大高发和致死性癌症[1]。然而,在发展中国家,宫颈癌仍是女性第二大高发和第三大致死性癌症,而且发病趋于年轻化。其致死性原因主要为发现时已失去手术机会的中/晚期和复发性宫颈癌。肿瘤干细胞是一群具有自我更新、多向分化、无限增殖及极强致瘤性等生物学特性的亚群细胞,同时又由于其所特有的细胞生物学特性,癌基因表达谱和肿瘤微环境等使其具有极强的抗放化疗和转移侵袭能力,成为临床放/化疗失败、复发转移及最终导致患者死亡的主要原因[2]。
CD49f,即整合素α6(integrin α6),是具有黏附和信号转导功能的黏附分子整合素家族成员之一,能够与多种细胞外基质蛋白结合,参与细胞的增殖、分化、迁移和黏附等过程[3]。CD49f是包括胚胎干细胞、神经干细胞、造血干细胞和上皮干细胞等干细胞的表面标志[4-6]。近年来,CD49f被证实可作为多种癌症干细胞的表面标志[7],调控癌干细胞的增殖、分化和迁移[8-10],其在干细胞培养基富集的宫颈癌细胞肿瘤球中表达增加,提示其可能参与宫颈癌的进展,与宫颈癌干细胞特性的维持相关[11],但并未见研究报道证实。本研究通过流式细胞技术分选获得CD49fhigh和CD49flow的宫颈癌亚群细胞,研究CD49f在维持体外癌干细胞特性(自我更新能力、分化能力和抗化疗药物等)中的作用,为进一步证实CD49f能够作为宫颈癌干细胞的表面标记提供前期研究基础。
1 材料和方法
1.1 主要试剂和仪器
细胞培养液DMEM/High Glucose,Mc Coy’s 5A,RPMI-1640,DMEM/F12和胎牛血清(FBS)购自美国HyClone公司;氨卞青霉素钠、硫酸链霉素和MTT均购自美国Sigma公司;CD49f单克隆抗体和CD49f-FITC流式抗体分别购自美国Abcam公司和BD公司;羊抗鼠免疫组织化学试剂盒购自北京中杉金桥生物科技有限公司;顺铂和5-氟尿嘧啶购自山东齐鲁药业;干细胞培养基相关因子N2,B27购自美国GIBCO公司,EFG和FGF购自美国Peprotech公司;流式细胞计数仪(BD FACS Aria)购自美国BD公司。
1.2 宫颈癌细胞系及细胞培养
宫颈癌细胞系HeLa,SiHa,C33A,HT-3和CaSki购自ATCC(American Type Culture Collection, Manassas, VA, USA),并由本课题组西安交通大学医学部环境与基因相关教育部重点实验室保存。细胞培养采用含10%胎牛血清,1 000 μg/ml青霉素、100 mg/ml链霉素的DMEM/High Glucose细胞培养液,37 ℃、5% CO2培养细胞,待单层细胞生长达到80%融合时,用0.25%的胰蛋白酶消化细胞,收集细胞备用。
1.3 生物信息数据库
CD49f转录本水平在宫颈癌组织和正常宫颈组织中表达的差异采用肿瘤相关数据库进行分析。GEPIA数据库(Gene Expression Profiling Interactive Analysis, http://gepia.cancer-pku.cn/detail.php)分析获得正常宫颈组织13例,宫颈癌组织305例。GEO数据库(Gene Expression Omnibus)筛选获得正常宫颈组织36例,宫颈癌组织58例。分别分析CD49f转录本水平的表达差异,并进行统计分析。
1.4 免疫细胞化学检测CD49f蛋白在宫颈癌细胞系中的表达
宫颈癌细胞系HeLa,SiHa,C33A,HT-3和CaSki培养于铺有80 mm×80 mm爬片的培养皿中,待细胞生长至80%密度后弃培养基,PBS冲洗2次,40 g/L多聚甲醛固定30 min,1 ml/L的Triton X-100室温孵育20 min。抗原修复采用pH6.0的柠檬酸钠高压修复2 min;30 ml/L的H2O2室温封闭10 min。50 ml/L山羊血清封闭20 min,鼠抗人CD49f单克隆抗体(1 ∶200)4 ℃孵育过夜。次日,PBS冲洗2次,生物素标记羊抗鼠IgG室温孵育20 min;链霉亲和素标记的DAB显色剂显色,苏木精复染,中性树胶封片,显微镜观察。对照组采用正常小鼠血清替代抗体。
1.5 流式细胞仪检测CD49f蛋白在宫颈癌细胞系中的表达
将备检测的细胞进行胰酶消化,PBS清洗2次,调整细胞浓度至105/ml,CD49f抗体100 μl冰上孵育1 h,预冷的PBS清洗2次,并用滤膜进行过滤,上机检测或者分选CD49f的表达及所需要的细胞,以小鼠来源的IgG作对照。对于细胞分选,以CD49f阳性上限的5%和阴性下限的5%进行画门分群,进行分选,并分别定义为CD49fhigh和CD49flow两群细胞。分选好的细胞直接进行后续的实验。
1.6 细胞活力检测
细胞以1×103浓度接种于96孔板中,连续7 d检测细胞活力。细胞经0.4%台盼蓝染液染色4-6 h,加入DMSO溶解,在分光光度计波长570 nm测定吸光度并绘制曲线图。对于药敏实验,1×103细胞接种于96孔板过夜贴壁后,将含有不同浓度的化疗药物作用细胞72 h后,检测细胞活力。顺铂药物浓度为0,3,6,12 μg/ml,5-氟尿嘧啶浓度分别为0,30,60,120 μg/ml。
1.7 肿瘤球形成实验
采用含有干细胞因子FGF、EGF、N2和B27的DMEM/F12干细胞培养基进行肿瘤球形成实验。以每孔1个细胞的数量分选细胞至9孔板中,用干细胞培养基进行培养,每3 d增加20 μl新的培养基,观察至12-15 d,统计每组细胞肿瘤球形成的数量。
1.8 统计学分析
采用SPSS16.0统计软件,计量资料以均数±标准差表示,组间比较采用t检验和One-way ANOVA检验分析,P<0.05为差异有统计学意义。
2 结果
2.1 CD49f在宫颈癌中的表达
TCGA数据库和GEO数据库分析显示,CD49f转录本水平在宫颈癌组织中均一致性地高于正常宫颈组织(见图1,P<0.05)。免疫细胞化学检测发现,CD49f蛋白在宫颈癌细胞系HeLa,SiHa,C33A,HT-3和CaSki中均有表达且定位于细胞膜(见图2)。流式细胞计数仪结果显示CD49f在HeLa,SiHa,C-33A,HT-3和CaSki细胞中表达的阳性率分别为90.8%,26.3%,21.7%,19.8%和32.9%(见图3)。

与正常宫颈组织相比,*P<0.05图1 GEPIA和TCGA数据库分析CD49f转录本水平在宫颈癌和正常宫颈中的表达Figure 1 CD49f mRNA level in cervical cancer and normal cervix by GEPIA and TCGA databases

图2 免疫组织化学检测CD49f蛋白在宫颈癌细胞系中的表达 (×1 000)Figure 2 The expression of CD49f protein in cervical cancer cell lines by IHC (×1 000)

图3 流式细胞技术检测CD49f蛋白在宫颈癌细胞系中的表达Figure 3 The expression of CD49f protein in cervical cancer cell lines by flow cytometry
2.2 CD49fhigh宫颈癌细胞具有较强的抵抗化疗药的特性
为明确CD49f在宫颈癌恶性生物学行为中的作用,流式细胞技术仪分选获得CD49fhigh和CD49flow的两群细胞。MTT实验结果显示,CD49f在宫颈癌细胞中表达的高低对细胞增殖能力影响的差异无统计学意义(P>0.05,见图4)。CD49f对化疗药物的敏感性的研究显示,HeLa-CD49fhigh细胞对5-氟尿嘧啶和顺铂的敏感性均显著低于HeLa-CD49flow细胞群,且呈浓度依赖性趋势。在C33A-CD49fhigh和C33A-CD49flow细胞群中得到同样的结果(见图5,P<0.05)。

图4 MTT实验检测亲本细胞CD49fhigh和CD49flow细胞亚群的增殖活力Figure 4 Cell viability of parent, CD49fhigh and CD49flow populations detected by MTT assay
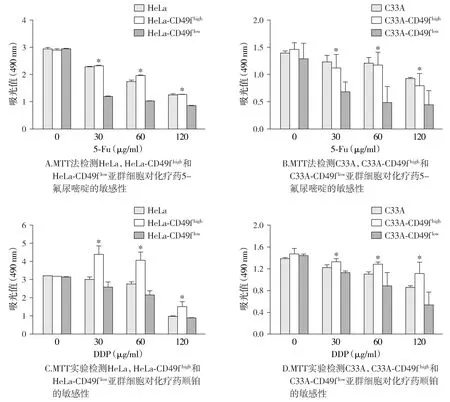
与CD49flow比较,*P<0.05图5 MTT实验检测亲本细胞CD49fhigh和CD49flow细胞亚群对化疗药的敏感性Figure 5 Sensitivity of parent, CD49fhigh and CD49flow populations to chemotherapeutic drugs by MTT assay
2.3 CD49fhigh宫颈癌细胞具有较强的体外肿瘤球形成能力
有限稀释法结合体外肿瘤球培养实验结果显示,SiHa-CD49fhigh细胞的成球率为10.31%±4.23%,较SiHa-CD49flow细胞的成球率(3.72%±1.03%)显著增加(P<0.05)。同时,在HeLa和C33A细胞中CD49fhigh细胞群的肿瘤球形成能力亦显著高于CD49flow细胞群,差异有统计学意义(P<0.05,见图6)。通过连续传代肿瘤球形成实验检测两群细胞的体外自我更新能力,结果显示,CD49fhigh细胞群在SiHa,HeLa和C33A细胞中第三代肿瘤球形成率分别为(13.28±3.28)%,(26.32±9.21)%和(26.42±8.24)%,均显著高于CD49flow群细胞的体外成球率[(5.03±2.31)%,(18.34±7.82)%和(18.76±4.23)%],差异具有统计学意义(P<0.05,见图6和表1)。

表1 CD49fhigh和CD49flow两组细胞肿瘤球形成率和自我更新能力的比较

图6 肿瘤球形成能力和自我更新能力检测Figure 6 Tumorsphere formation ability and self-renewal ability
2.4 CD49fhigh宫颈癌细胞具有体外分化能力
分选后的细胞进行体外分化培养,检测CD49f蛋白表达的变化,结果显示,CD49f高表达的宫颈癌细胞SiHa、HeLa和C33A经过分化培养3代后,CD49f蛋白的表达明显降低;连续传6代后,CD49f蛋白的表达恢复到亲本细胞中CD49f的表达水平(见图7)。以上结果提示CD49f阳性的宫颈癌细胞具有体外分化能力。
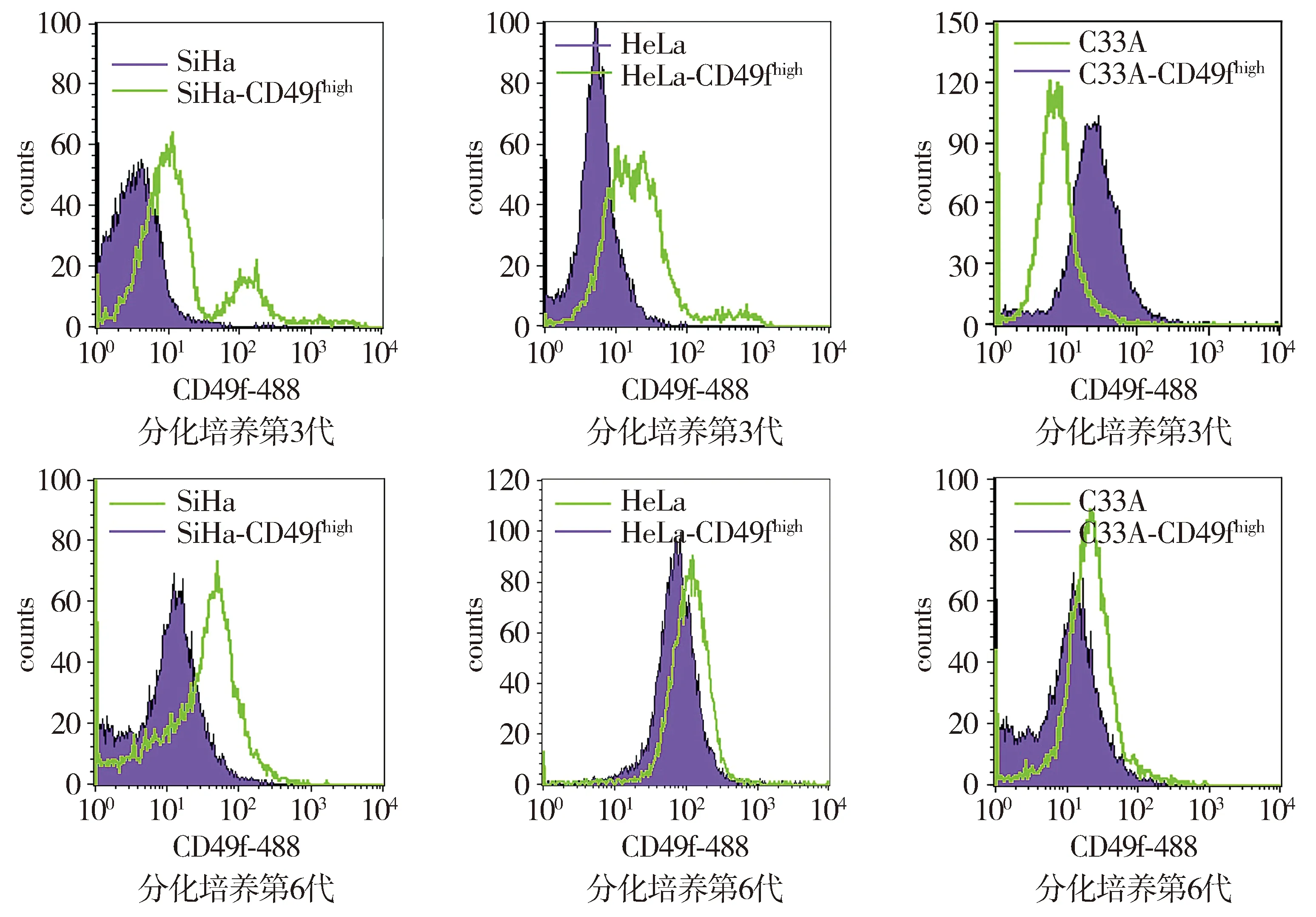
图7 流式细胞仪检测分化培养后CD49fhigh细胞群中CD49f蛋白的表达变化Figure 7 The expression of CD49f protein in CD49fhigh cells cultured with differentiation medium by flow cytometry
3 讨论
CD49f参与多种肿瘤的发生发展,与癌症干细胞特性相关。CD49f在前列腺良性和恶性细胞形成的球体中高表达,并且与多种肿瘤细胞的始动相关,包括结肠癌和乳腺癌等[12,13]。此外,在小鼠肿瘤中,CD49f阳性的细胞具有更高的转移和侵袭能力[14]。因此推测CD49f可能是治疗癌症的有价值的靶点之一。
目前,对宫颈癌干细胞的研究表明,LGR5[15],SOX2[16]和DAX1[17]等均参与了宫颈癌干细胞特性的维持。值得一提的是,HPV18和HPV16作为宫颈癌发生的必要条件性因子,能够靶向OCT4,HES1,EGF和TGF-β激活下游干细胞相关信号通路,增加致瘤能力和抑制分化能力[18]。但关于宫颈癌干细胞确切的调控机制和特异性抗原仍不完全清楚。本研究中,数据库结果显示CD49f转录本水平在宫颈癌组织中显著增加,提示CD49f在宫颈癌发生发展过程中可能发挥促进作用。采用表面标记CD49f分选获得CD49f高表达和低表达的两群细胞,分析CD49f的表达对宫颈癌恶性生物学行为的影响和在维持癌干细胞特征中的作用。MTT实验结果表明CD49f表达的高低与宫颈癌细胞的增殖活力无关,提示CD49f不是通过影响宫颈癌细胞增殖及细胞活力发挥促癌作用的。因此,我们进一步探索CD49f是否对癌干细胞特征的维持发挥作用?以往研究已证实癌干细胞具有高致瘤性和自我更新能力,抗分化能力和抗常规放化疗治疗等特征。本研究中,CD49fhigh细胞具有比CD49flow细胞更强的自我更新能力和抗分化和化疗药物能力,提示CD49f可能通过调控宫颈癌干细胞特性的维持发挥促癌作用。关于CD49f在宫颈癌干细胞中的作用,已有研究表明,HeLa细胞经富集培养的肿瘤球中CD49f的表达显著增加[19],与本研究中的结果是一致的。另外,肿瘤干细胞作为导致肿瘤始动、复发和转移的元凶通常被认为与细胞增殖能力包括细胞生长和周期进展无关,也有报道肿瘤干细胞反而具有较非肿瘤细胞较弱的增殖能力[20]。这一点可以很好地解释CD49f表达的高低与宫颈癌细胞的增殖能力和细胞活力无显著相关,更加提示CD49f作为宫颈癌干细胞标记的可能性,有望成为宫颈癌干细胞的新标记和靶向治疗的潜在新靶点。然而,其在维持宫颈癌干细胞体内特征和下游调控机制的分子机制仍需进一步研究。
综上,癌干细胞作为肿瘤始动、复发和转移的根源,其在肿瘤组织中的转归就直接关系患者的预后结局,因此阐明癌干细胞的分子标记和调控机制对于靶向癌干细胞的治疗具有一定的现实意义。对于宫颈癌,尤其是复发转移及HPV阴性的宫颈癌患者,研究其干性调控基因和分子机制,能够提供有效的预后提示和潜在的治疗靶点。
