过表达IGF-1的小鼠骨髓间充质干细胞分泌物对缺氧心肌细胞的抗凋亡作用
2020-11-06刘瑞杰李文峰
刘瑞杰,李文峰,兰 军*
(1东莞市松山湖中心医院心内科,东莞 523326;2南昌大学附属赣州医院心内科;*通讯作者,E-mail:DRliuruijie@163.com)
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)在体外培养、增殖后移植在心肌梗死部位,可存活并分化为心肌细胞,改善心脏功能,是治疗和修复心肌损伤时最为成熟的细胞[1]。不同的临床研究(或临床试验),采用不同的治疗方案,虽然短期内均能逆转缺陷后引发的心肌重构、改善缺血区的心肌功能、提高左心室射血分数、减少左心室收缩末期容积,但是很多指标改善不明显,长期疗效并不优于对照组[2]。目前干细胞移植疗效不理想的重要原因之一是心肌局部微环境缺氧导致移植细胞归巢、定植能力低下。如能通过促进心肌微血管生成从而改善局部微环境缺氧,将有望提高干细胞移植的疗效。IGF-1是调控心肌细胞存活的重要营养因子,参与心脏发育等生理过程[3,4]。缺血缺氧引起心肌细胞凋亡是引起心脏功能下降的关键因素。虽然IGF-1对BMSCs细胞凋亡的作用已有报道,但过表达IGF-1的BMSCs分泌物对缺氧模型下的心肌细胞凋亡作用尚不清楚。本研究拟通过慢病毒技术将IGF-1基因感染BMSCs细胞,探讨过表达IGF-1对BMSCs及其过表达IGF-1-BMSCs上清培养液的心肌细胞的抗凋亡能力有无改善作用。
1 材料和方法
1.1 材料
1.1.1 动物 SPF级4周龄雄性C57BL/6小鼠40只,购自广州中医药大学,动物合格证号[SCXK(粤)2019-0265]。动物喂养及观察均按照非临床研究管理规范进行。
1.1.2 主要试剂及器材 BMSCs低糖的培养基(Cyagen Bioscience,赛业生物科技有限公司);10% FBS(Gibco Bioscience);细胞凋亡检测试剂盒(PI及Annexin Ⅴ Alexa Fluor 488,Invitrogen公司);caspase-3,8,9和Bax,Bcl-2以及cytochrome C抗体(Cell Signal Technology,CST公司);CD29,CD44,CD11b及SCA-1抗体购自BioLegend公司。
1.2 研究方法
1.2.1 小鼠BMSCs的分离、培养及鉴定 将小鼠脱臼处死后用碘伏侵泡5 min,无菌条件下分离出小鼠股骨和胫骨,离体的骨骼放入灭菌PBS缓冲液中冲洗。剪去干骺端,暴露骨髓腔,无菌注射器抽取未添加肝素的含10% FBS,100 mg/L链霉素的BMSCs低糖培养基反复冲洗骨髓腔,直至腔内所有骨髓血冲净。接种于含10%胎牛血清的BMSCs低糖的培养基,置于37 ℃,体积分数5% CO2,饱和湿度的细胞培养箱内培养。3 d首次换液,以后每3 d换液1次,以0.25%胰蛋白酶消化后在第3代用磁珠进行分选,去除造血干细胞祖细胞。然后传代培养至第7代。取P7代的BMSCs细胞,融合超过80%之后,取生长良好的BMSCs细胞,以0.25%胰酶消化细胞,按1×109/L重悬细胞,PBS洗涤1次,重悬细胞并分4管,分别加入100 μl CD29,CD44,CD11b及SCA-1(采用统一的1 ∶20倍数稀释至100 μl),避光孵育30 min。1 000 r/min离心5 min沉淀细胞,倒去上清液,加入500 μl PBS进行流式细胞术分析。
1.2.2 心肌细胞培养及实验处理 小鼠心脏取下后放入5 ml HBSS缓冲液的培养皿中,剪掉心房和右心室组织后用眼科镊撕扯成小碎块。然后用滴管反复吹打直至大碎块消失,通过60目筛网过滤至50 ml的离心管,然后用胶原酶消化,20 r/min离心2 min后转移至含有1 000 mmol/L钙的HBSS缓冲液,对心肌细胞进行复钙自然沉淀后,弃上清,向细胞沉淀中加入含HEPES(25 mmol/L)、肌酸(5 mmol/L)、2% FBS、L-肉毒碱(2 mmol/L)、牛磺酸(5 mmol/L)和质量分数为0.1%双抗无血清的M199培养基中,放入5% CO2的细胞培养箱中培养。
1.2.3 细胞分组及实验处理 缺氧模型构造时,将细胞置于缺氧工作站的低氧舱室(1% O2,5% CO2,94% N2)中培养至相应时间点。按是否进行缺氧处理,分为正常组(control)及缺氧组(hypoxia)。按是否携带IGF-1基因的细胞分为:IGF-1-BMSCs及对照NC-BMSCs。观察心肌细胞时,按实验设计加入相应组别的BMSCs培养上清液,时间梯度为12,24,48,60 h;浓度梯度(BMSCs上清液与原培养基体积比)为0%,25%,50%,75%。为了研究过表达IGF-1对小鼠BMSCs细胞低氧状态下凋亡情况的影响,BMSCs进行了低氧诱导,然后通过流式细胞术检测凋亡率。为了确定上调IGF-1基因的小鼠BMSCs细胞的细胞分泌物对心肌细胞是否发挥作用,BMSCs培养后的上清液被收集,并加入到心肌细胞培养液中,观察BMSCs上清液对低氧诱导的心肌细胞凋亡情况的影响。
1.2.4 慢病毒载体及IGF-1过表达的骨髓间充质干细胞 从cDNA库调取IGF-1基因后克隆插入慢病毒包装质粒GV308中,形成IGF-1包装的慢病毒质粒。而后将该质粒感染小鼠间充质干细胞BMSCs,并加入强力霉素(doxycycline,DOX)开启基因表达。感染成功后通过RT-qPCR技术检测IGF-1基因的表达情况。为了研究过表达IGF-1对小鼠BMSCs细胞低氧状态下的凋亡情况影响,首先构建了过表达IGF-1的小鼠BMSCs细胞。用慢病毒感染原代培养的骨髓间充质干细胞(BMSCs)48 h后,进行荧光观察。
1.2.5 流式细胞术(flow cytometry)检测细胞凋亡率及蛋白免疫印迹(Western blot)检测蛋白表达 按照Cell Apoptosis Kit with Annexin Ⅴ Alexa Fluor 488 & PI for Flow cytometry说明书完成流式细胞检测。为了进一步了解过表达IGF-1基因对小鼠BMSCs细胞低氧诱导的蛋白分子机制,低氧诱导之后的BMSCs细胞裂解后进行了Western blot检测,大致流程为:在处理后不同时间点收集各组细胞,用预冷PBS洗涤细胞后,加入300 μl的1×Binding Buffer悬浮细胞,分别用Annexin Ⅴ-FITC和PI标记细胞,而后上机检测心肌细胞凋亡。
免疫印迹检测caspase-3,caspase-8,caspase-9和Bax,Bcl-2以及cytochrome C的表达:细胞进行缺氧处理48 h,而后通过相应抗体进行蛋白检测,最后通过显影成像,用Quantity one进行相对表达量的分析。
1.2.6 统计学分析 使用GraphPad Prism 8.0进行统计学分析,数据以均数±标准差表示。两组间比较使用独立样本t检验。多组间比较使用单因素方差分析(one-way ANOVA),事后组内两两比较采用Bonferroni post检验。P<0.05认为差异具有统计学意义。
2 结果
2.1 小鼠BMSCs中CD29、CD44及SCA-1的表达
为了确保培养的小鼠BMSCs细胞具有专一性,利用流式细胞检测仪对小鼠BMSCs进行表面抗原的检测,我们发现,80%的小鼠BMSCs高表达CD29(表达率为89%±8%),CD44表达率为95%±6%,SCA-1表达率为93%±3%,仅0.1%±0.02%的细胞表达CD11b。表明所培养的小鼠BMSCs大部分都为间充质干细胞,为随后的实验提供了可靠的实验对象。
2.2 慢病毒感染BMSCs后IGF-1基因的表达情况
结果表明,慢病毒感染BMSCs后IGF-1病毒感染率在96%±3%以上(见图1)。IGF-1-BMSCs组中IGF-1表达量与对照组(NC-BMSCs)相比,明显增加(P<0.05,见图1)。表明构建过表达IGF-1的BMSCs细胞成功。

与NC-BMSCs组比较,*P<0.05B.Western blot检测IGF-1过表达病毒感染后IGF-1蛋白的表达情况图1 IGF-1过表达慢病毒感染的原代骨髓间充质干细胞Figure 1 Primary bone marrow mesenchymal stem cells(BMSCs) infected with lentivirus overexpressing IGF-1
2.3 低氧诱导对BMSCs的凋亡率的影响
结果表明,低氧诱导时普通BMSCs及NC-BMSCs细胞凋亡率显著增加,而过表达IGF-1-BMSCs在低氧时凋亡率明显比其他组低,差异有统计学意义(P<0.05,见表1)。结果提示,过表达IGF-1基因的小鼠BMSCs细胞在低氧时可以降低BMSCs细胞的凋亡率。
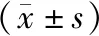
表1 低氧诱导48 h后细胞凋亡率比较
2.4 低氧诱导时凋亡相关蛋白的表达水平
低氧诱导时,小鼠BMSCs细胞抗凋亡蛋白Bcl-2的表达水平显著下降,而促凋亡蛋白Bax、细胞色素C(Cyto C)、caspase-3及caspase-8的表达水平则明显上调;过表达IGF-1则可以显著提升Bcl-2水平,而抑制Bax、细胞色素C(Cyto C)、caspase-3及caspase-8的表达水平(P<0.05,见图2)。表明过表达IGF-1可使小鼠BMSCs细胞抗凋亡蛋白Bcl-2的表达水平上升,同时抑制促凋亡蛋白Bax、细胞色素C(Cyto C)、caspase-3及caspase-8的表达水平,以达到低氧诱导下抗凋亡的作用。
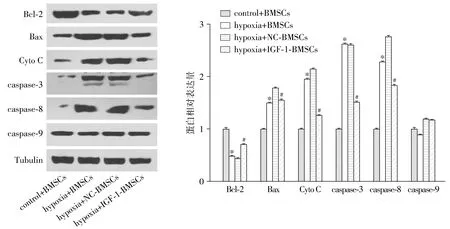
与control+BMSCs组比较,*P<0.05;与hypoxia+NC-BMSCs比较,#P<0.05图2 Western blot检测低氧诱导条件下培养48 h凋亡相关蛋白的表达水平Figure 2 Expression levels of apoptosis-related proteins in BMSCs after hypoxia treatment for 48 h by Western blot
2.5 BMSCs培养基上清对低氧诱导的心肌细胞凋亡率的影响
与正常培养相比,低氧处理的心肌细胞凋亡率显著增加。而加入50%体积比浓度的IGF-1-BMSCs培养基之后,与NC-BMSCs细胞上清液相比,其细胞凋亡率显著下调(P<0.05,见表2)。进一步,我们观察了时间梯度和浓度梯度效应,结果显示IGF-1-BMSCs培养液对缺氧诱导的心肌细胞凋亡的呈时间梯度(见表3)和浓度梯度效应(见表4)。提示过表达IGF-1基因的小鼠BMSCs细胞上清液可显著降低缺氧诱导时心肌细胞凋亡。
表2 IGF-1-BMSCs培养液对缺氧诱导时心肌细胞凋亡的影响
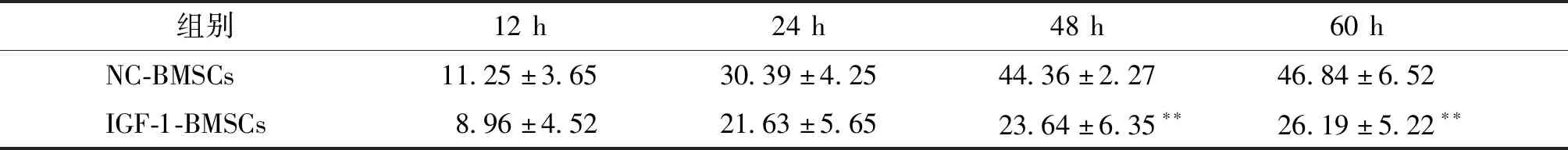
表3 IGF-1-BMSCs培养液对缺氧诱导时心肌细胞凋亡的时间梯度影响 (%)

表4 不同浓度IGF-1-BMSCs培养液对缺氧诱导48 h时心肌细胞凋亡率的影响 (%)
2.6 BMSCs培养基上清对低氧诱导的心肌细胞蛋白表达的影响
为了进一步确定IGF-1-BMSCs分泌物是否对心肌细胞凋亡通路产生影响。加入或者不加入BMSCs上清液后的低氧诱导的心肌细胞裂解后进行了Western blot检测,结果表明:低氧处理的心肌细胞,与正常培养相比,Bcl-2的表达水平显著下降,而Bax、Cyto C、caspase-3及caspase-8的表达水平则明显上调,加入IGF-1-BMSCs培养基之后,与NC-BMSCs相比,Bcl-2水平显著上升,而Bax、细胞色素C(Cyto C)、caspase-3及caspase-8的表达水平则下调(P<0.05,见图3)。结果提示IGF-1-BMSCs分泌物通过调控凋亡通路诱导心肌细胞抵抗低氧条件下的凋亡。

与control组比较,*P<0.05;与hypoxia+NC-BMSCs比较,#P<0.05图3 Western blot检测IGF-1-BMSCs培养液对低氧诱导时心肌细胞蛋白表达的影响Figure 3 Protein expression in cardiomyocytes under the treatment of hypoxia for 48 h with or without culture media from IGF-BMSCs
3 讨论
心肌梗死是世界范围内死亡和残疾的主要原因。急性心肌梗死常引起不可逆转的心肌细胞坏死,随着心肌梗死区域的纤维化和瘢痕形成,发生左室重构并最终导致心力衰竭及恶性心律失常[5]。如何修复坏死心肌成为一个新的治疗难点。干细胞具有诱导新生血管生成和组织替代的能力成为治疗急性心肌梗死新的治疗选择[6]。越来越多的研究表明,干细胞移植可以改善缺血心肌的灌注,提高收缩能力和心肌存活[7]。但是,其具体的机制目前并不完全清楚,本文为进一步探讨IGF-1基因对BMSCs在低氧情况下抗凋亡的机制进行研究。
IGF-1在心血管疾病发生发展及治疗的过程中具有至关重要的作用,它对心脏及血管起着不可替代的的保护作用。IGF-1可促进心肌细胞和心肌纤维细胞的增生,可提高心肌细胞的收缩力,可提高心脏心输出量和每搏量,可抑制心肌细胞凋亡[3]。IGF-1也在心肌重构中起重要作用,研究表明IGF-1介导了充血性心力衰竭的心肌重构,而且原发性高血压患者心室肥厚程度及左心室质量指数与血清IGF-1存在明显的相关性[4]。IGF-1也参与了福辛普利对高血压鼠的心肌保护作用[8]。为阐明IGF-1保护心肌细胞凋亡的具体机制,有文献通过基因芯片技术对IGF-1作用于心肌细胞之后的基因表达情况进行观察,并证明了Sp1转录因子是IGF-1作用于心肌细胞促进存活基因转录上升的关键因子[9]。因此,IGF-1对心肌细胞凋亡具有很好的保护作用[10,11]。
BMSCs在合适的微环境中具有转化为心肌细胞样细胞的潜能,而这个过程中IGF-1也起着至关重要的作用[12]。细胞外分泌的IGF-1通过IGF-1受体激活体内的相关通路,可介导BMSCs细胞的细胞迁移,存活和分化[13]。而通过阻滞药抑制IGF-1/IGF-1受体通路,可抑制BMSCs向心肌细胞分化的进程[14]。因此IGF-1对于BMSCs和心肌细胞都至关重要,我们的研究表明,通过慢病毒的手段在BMSCs中过表达IGF-1可显著提高细胞的抗凋亡能力,BMSCs培养基中富含细胞分泌的IGF-1因子,该上清液与心肌细胞共同培养后亦可显著提高心肌细胞的存活。BMSCs移植被认为是目前治疗心肌缺氧缺血损伤的研究热点,然后在缺氧缺血灶BMSCs的存活及其定向诱导分化是移植成功的关键。研究表明AKT在BMSCs中过表达之后也可对缺氧时诱导的细胞凋亡[15]。而SFRP2则是介导BMSCs-AKT细胞存活的关键通路。IGF-1是AKT的上游,且IGF-1是BMSCs的一个重要旁分泌因子[16]。IGF-1可通过激活AKT促进BMSCs的迁移和分化[17]。进一步,IGF-1可通过线粒体途径调控心肌细胞的凋亡[18],这一点也在本研究中证实。
本实验通过慢病毒技术将IGF-1过表达与BMSCs,不仅提高了BMSCs在缺氧条件下的抗凋亡能力,且含有IGF-1外分泌组分的培养基对缺氧条件下的心肌细胞凋亡也有保护作用,IGF-1通过上调抗凋亡蛋白Bcl-2,下调促凋亡蛋白Bax及Cyto C、caspase-3和caspase-8的水平发挥作用。
综上所述,过表达IGF-1的BMSCs能够通过增强其自身的抗凋亡能力,也能够通过其分泌物增强心肌细胞的抗凋亡能力,改善小鼠心肌细胞功能。
