DOT1L调控胃癌细胞增殖的分子机制
2020-11-06冯晓佳张振伟
刘 雪,冯晓佳,张振伟,钱 军
(蚌埠医学院第一附属医院肿瘤外科,蚌埠 233000;*通讯作者,E-mail:Qianjun215036@sina.com)
目前我国国内胃癌(gastric cancer)的发病率和病死率分居恶性肿瘤的前列,晚期GC的5年生存率更是不到5%[1]。为了降低GC发病率,有必要深入了解GC细胞分子生物学机制。
类端粒沉默干扰体-1(disruptor of telomeric silencing-1,DOT1)是一种在哺乳动物进化过程中发挥作用的保守蛋白,其在人类基因中被称为DOT1L(disruptor of telomeric silencing-1-like),是组蛋白H3第79位赖氨酸的特异性甲基转移酶[2]。根据最近报道,DOT1L介导的H3K79甲基化是可逆的,并且对基因的转录、翻译、细胞生物学活性、胚胎的健康发育均发挥重要的作用[3]。研究发现,在卵巢癌中DOT1L通过调控SPARC的转录,促进卵巢癌细胞迁移、侵袭、黏附和血管内皮细胞渗透性[4]。在乳腺癌中DOT1L基因的过表达,导致乳腺肿瘤细胞的侵袭和迁移能力发生改变,并激发体内肿瘤干细胞微球体形成[5,6]。
丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPKs)[7]是细胞内广泛表达的丝氨酸/苏氨酸蛋白激酶,此类蛋白可通过细胞信号通路诱导肿瘤产生增殖、分化等一系列细胞生理活动[8]。
本课题组前期利用TCGA数据库中公开的数据来探讨GC患者中DOT1L的表达与预后相关性[9]。通过对DEGs进行KEGG PATHWAY和GSEA富集分析预测增殖信号通路[10,11]。通过分析的结果表明:DOT1L表达水平升高与胃癌的增殖和较差的患者预后之间存在直接的联系,因此本课题组观察DOT1L在胃癌组织中调控癌细胞的增殖能力,并探讨其作用机制,为胃癌的临床治疗提供可能的新靶点。
1 材料与方法
1.1 细胞与主要试剂
胃癌细胞株MGC-803、BGC-823、SGC-7901、MKN-45、AGS均由中国科学院上海细胞库提供。胎牛血清采购自杭州四季青生物工程材料有限公司;RPMI-1640培养基、1%青霉素-链霉素混合物均购自美国Gibc公司;real-time PCR试剂盒购自美国Promega公司;TRIzoI试剂购自美国Invitrogen公司;Primescript RT试剂购自日本TaKaRa公司;CCK-8试剂盒、RIPA裂解液、BCA蛋白浓度测定试剂盒、0.1%结晶紫均购自上海碧云天公司;poly-brene,嗓吟霉素、胰酶均购自美国Sigma公司;DOT1 L、ERK1/2、p-ERK1/2、p38 MAPK、p-p38MAPK标识基因蛋白一抗(鼠抗)均购自美国ABclonal公司;β-actin一抗(鼠抗)、DOT1L、ERK1/2、p-ERK1/2、p38 MAPK、p-p38MAPK标识基因蛋白、β-actin二抗(羊抗鼠)均购自美国Abbkine公司;DOT1L基因沉默组慢病毒颗粒(pLKO.1 puro-DOT1L-shRNA)及阴性对照组慢病毒颗粒(pLKO.1puro-shNC),DOT1L过表达慢病毒(pLKO.1puro-DOT1L)均由吉玛公司构建。
DOT1L基因沉默组慢病毒颗粒序列为:CCGGG-CCCGCAAGAAGAAGCTAAACCTCGAGGTTTAGCTT-CTTCTTGCGGGCTTTTTG,阴性对照组慢病毒颗粒序列:CCGGCCTAAGGTTAAGTCGCCCTCGCTCGAGCG-AGGGCGACTTAACCTTAGGTTTTTG。
本实验DOT1L及β-actin上下游引物序列的设计任务均由上海生物公司完成。DOT1L上游引物:5′-CATCACTATGGCGTCGAGAAA-3′,下游引物:5′-CGCCTCTCTCCAATGTGTATT-3′;β-actin上游引物:5′-CAGGAAGGA AGGCTGGAAG-3′,下游引物:5′-CGGGAAATCGTGCGTGAC-3′。
1.2 Western blotting法检测5种不同胃癌细胞株DOT1L蛋白表达水平
将空白组中MGC-803、BGC-823、SGC-7901、MKN-45和AGS五种细胞株离心后取细胞沉淀。采用RIPA法裂解细胞,提取细胞总蛋白,采用BCA试剂盒检测蛋白浓度。取等体积5组蛋白样品组上样进行SDS-PAGE凝胶电泳,转膜后经5%脱脂牛奶封闭非特异性位点2 h后,转移至孵育盒中,DOT1L(1 ∶1 000)抗体稀释和β-actin(1 ∶1 000)稀释并4 ℃孵育过夜。次日洗膜3次后,每次15 min加入二抗(1 ∶3 000)室温摇床孵育2 h,洗膜3次,每次10 min经暗室显色显影后,使用Image J软件图像分析,以β-actin为内参,计算出各组细胞中DOT1L基因蛋白的相对表达量。
1.3 选取MGC-803、SGC-7901胃癌细胞系进行病毒感染
将胃癌MGC-803、SGC-7901细胞均匀接种于6孔板中,每孔约种5×105个细胞,稀释polybrene终浓度为5 μg/ml。转染步骤操严格按照说明书进行,实验分为NC组(转染pLKO.1puro-shNC)、shDOT1L组(只转染pLKO.1puro-DOT1L-shRNA)和oe-DOT1L组(shDOT1L组稳转后转染过表达慢病毒pLKO.1puro-DOT1L),挽救实验用2 μg/ml的嘌吟霉素对MGC-803、SGC-7901胃癌细胞进行筛选,收集细胞进行后续研究。
1.4 RNA提取与实时聚合酶链反应(polymerase chain reaction,PCR)检测转染效果
分别提取shDOT1L组、NC组胃癌细胞株总RNA,Primescript RT试剂逆转录RNA成cDNA。运用RT-PCR系统,用SYBR Green RT-PCR试剂盒显色,qRT-PCR分析mRNA水平。反应总体系为20 μl,一切操作均参考试剂说明书,每个样品为3个复孔(β-actin作为内参,实验重复3次)。各组Ct值与β-actin的Ct值相减得到ΔCt,用2-ΔΔCt方法比较。
1.5 Western blotting法检测转染效果
按1.2项步骤,检测MGC-803、SGC-7901细胞转染慢病毒后,DOT1L蛋白的表达水平。
1.6 细胞增殖能力的检测
1.6.1 细胞集落克隆实验检测细胞增殖能力 将MGC-803、SGC-7901胃癌细胞株接种在6孔板中(1 000/孔)。培养至细胞集落后,用70%乙醇固定结晶紫染色。显微镜40倍镜下观察拍照,实验重复3次。
1.6.2 CCK-8实验检测细胞增殖能力 消化MGC-803、SGC-7901胃癌细胞株后,接种于96孔板(5 000/孔),将CCK-8溶液分别在1,2,3,4,5 d加入各孔中,37 ℃孵育2 h后。在波长450 nm下检测shDOT1L组、NC组和oe-DOT1L组GC细胞吸光度值,绘制增殖曲线图,实验重复3次。
1.7 Western blotting法检测MAPK通路相关调控蛋白及Ki-67蛋白表达水平
按1.2项步骤分别检测shDOT1L组、NC组和oe-DOT1L组中GC细胞外调节蛋白激酶(Erk)、磷酸化Erk(Erk-p)、38丝裂原活化蛋白激酶(p38 MAPK)、磷酸化p38MAPK(p-p38MAPK)及Ki-67蛋白表达水平。
1.8 TCGA数据库生物信息学分析
1.8.1 RNA-seq-based数据分析 使用TCGA数据库下载了375例GC患者基因表达数据(数据类型:HTSeq-Counts)和相关临床信息。利用R语言筛选癌组织与正常组织差异表达超过1倍的基因。然后对375例非配对样本和32对癌旁组织配对(以降低个体差异对基因表达的影响)样本,进行Wilcox检验分析DOT1L表达的差异。用DOT1L的中间值作为cut-off值,通过Kaplan-Meier分析评估高低两组DOT1L与总生存率之间的相关性,并用ROC分析其特异性和敏感性,我们将HTSeq-FPKM数据转换为TPM(百万读记录)格式,以方便下游分析。下游分析中使用了总共375个GC患者的TPM值,而不可用的临床数据被认为是缺失值。
1.8.2 GO注释和KEGG分析 用DAVID数据库对差异基因进行GO注释后,KEGG pathway预测参与胃癌发展过程中的关键通路。
1.8.3 GSEA富集分析 首先我们利用GSEA方法根据表达数据集文件及表型数据文件合成了一份基因列表,并根据样本中DOT1L的中位值作为cutoff值,将患者数据集分为DOT1L高表达组和低表达组。每次分析共进行1 000个基因组排列。富集差异显著(FDR<0.05,NOMP<0.05)进行识别和分类。
1.9 统计学方法

2 结果
2.1 GC患者中DOT1L mRNA的表达水平
与癌旁组织比较,DOT1L mRNA在GC组中的表达显著增加(1.26倍,P<0.05,见图1A)。此外,与配对的癌旁组织比较,同样验证了GC样本中DOT1L mRNA水平明显升高(1.75倍,P<0.05,见图1B)。

图1 GC组织中DOT1L mRNA的表达量Figure 1 DOT1L mRNA expression in gastric cancer tissues
2.2 DOT1L基因的表达与GC患者预后的关系
Kaplan-Meier生存曲线显示:与低表达组相比,DOT1L高表达组OS显著降低(P<0.05,见图2A)。ROC曲线结果显示:DOT1L基因的AUC值为73.3%(见图2B)。
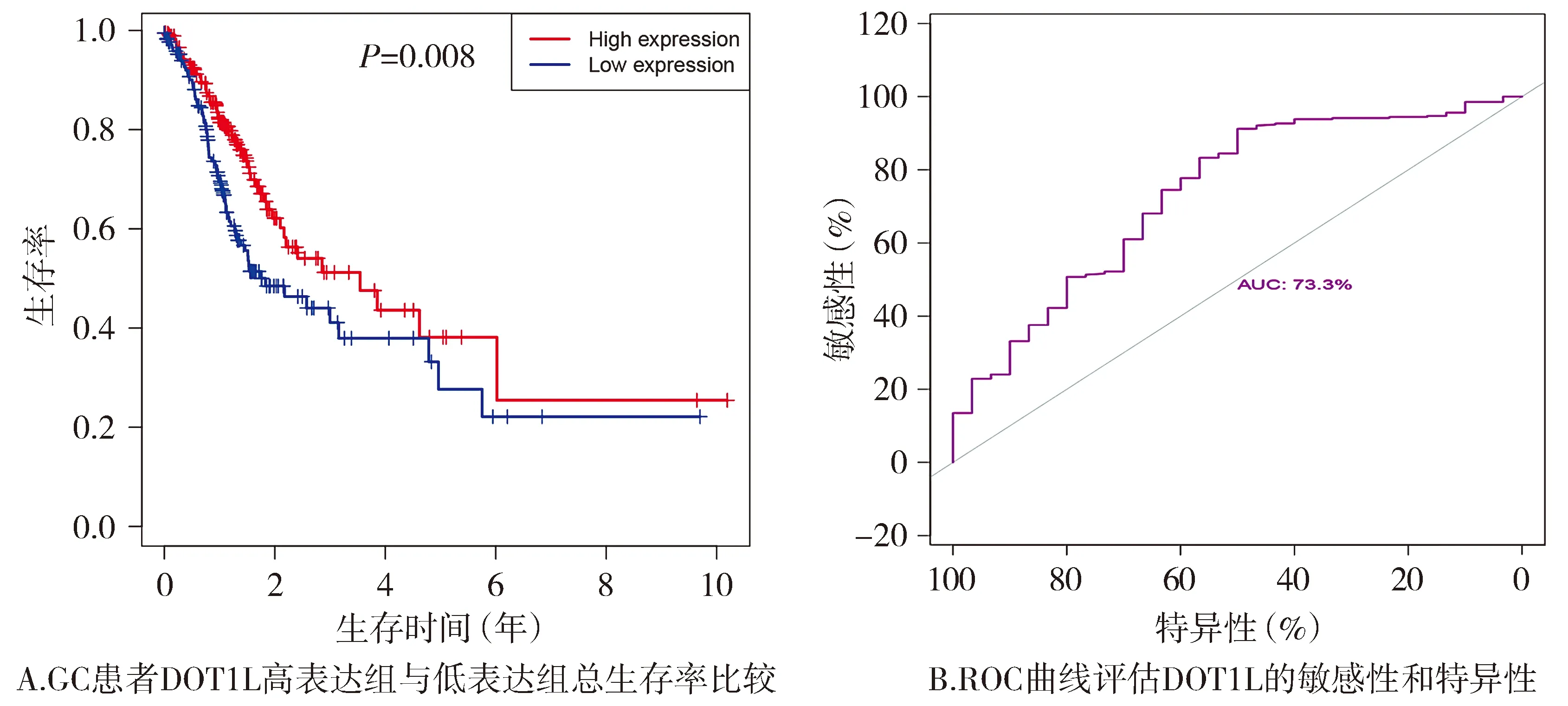
图2 DOT1L基因的表达与GC患者预后的关系Figure 2 Relationship of DOT1L expression with the overall survival rate
2.3 DOT1L蛋白在GC细胞系中的表达水平
Western blotting结果显示,DOT1L蛋白在AGS细胞相对表达量0.122±0.015,MKN-45细胞相对表达量0.284±0.015,BGC-823细胞相对表达量0.371±0.011,SGC-7901细胞相对表达量为0.542±0.031,MGC-803细胞相对表达量0.582±0.004,其中SGC-7901、MGC-803癌株的DOT1L蛋白表达最高,差异有统计学意义(P<0.01,见图3),本研究拟选用这两株进行本研究的后续实验。
2.4 real-time PCR和Western blotting分别检测shDOT1L组转染效率
与对照组比较,shDOT1L组癌株mRNA表达水平明显下调,差异有统计学意义(F=63.100,P<0.05;F=59.230,P<0.05,见图4A)。shDOT1L组癌株DOT1L蛋白表达水平较对照组明显下调,差异有统计学意义(F=71.310,P<0.05;F=95.800,P<0.05,见图4B)。沉默的效果与上述mRNA表现一致,可以进行后续实验。

与AGS组比较,*P<0.05,**P<0.01图3 各组癌株中DOT1L蛋白表达水平Figure 3 Expression level of DOT1L protein in gastric cancer cells
2.5 细胞集落克隆实验和CCK-8法检测癌株增殖能力
与对照组相比,shDOT1L组SGC-7901和MGC-803克隆增殖形成能力明显降低,差异有统计学意义(F=22.920,P<0.05;F=28.230,P<0.05,见图5);CCK-8实验结果显示,与对照组相比,shDOT1L组GC细胞在2,3,4,5 d观察OD450值明显降低,差异有统计学意义(F=20.440,P<0.05;F=36.624,P<0.05,F=38.451,P<0.05;F=35.524,P<0.05,见图5)。以上结果表明DOT1L降低可以抑制GC细胞的增殖能力。
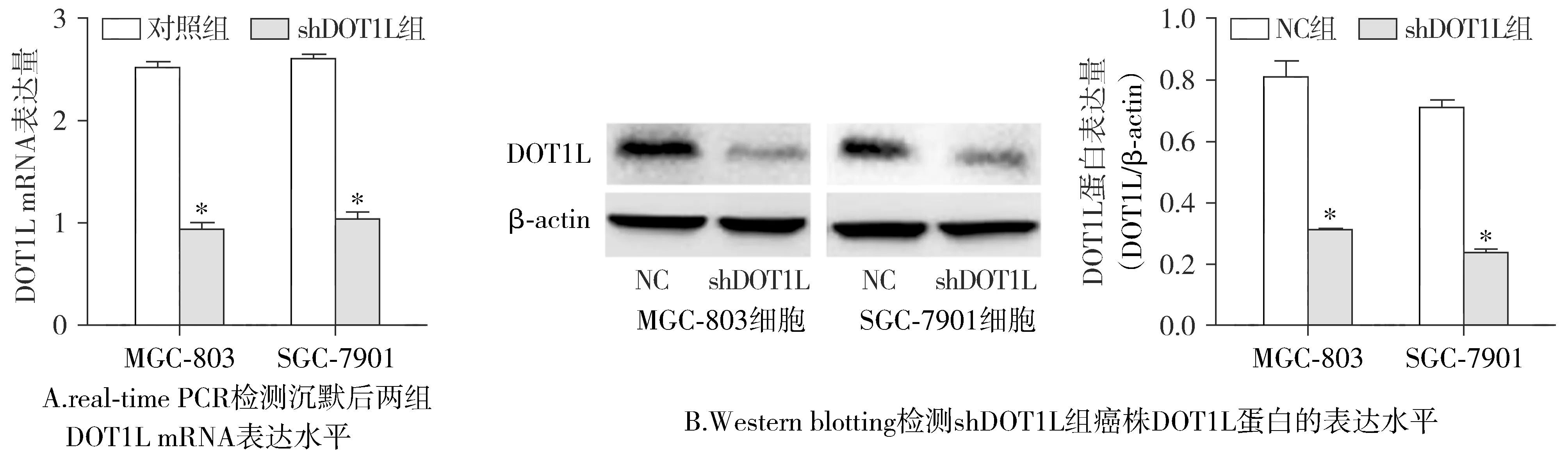
与对照组或NC组比较,*P<0.05,**P<0.01图4 沉默DOT1L后两组DOT1L转染效率Figure 4 Transfection efficiency of DOT1L in two groups

与相应的NC组比较,*P<0.05,**P<0.01图5 沉默DOT1L基因对GC增殖能力的影响Figure 5 Effect of DOT1L gene silencing on the proliferation of GC
2.6 富集分析DOT1L调控胃癌增殖潜在的通路
根据KEGG PATHWAY富集分析结果提示DOT1L主要参与的增殖通路有:MAPK通路(见图6A)。GSEA基因集富集分结果显示:DOT1L高表达时肿瘤细胞在KEGG-MAPK-SIGNALING-PATHWAY通路明显富集(P-value<0.05),此结果与KEGG pathway富集分析的结果一致(见图6B)。

图6 基因DOT1L的通路富集分析结果Figure 6 Pathway enrichment analysis of DOT1L gene
2.7 Western blotting检测MAPK-SIGNALING-PATHWAY通路调控蛋白
SGC-7901和MGC-803中,与对照组比较,shDOT1L组的Erk-p、p-p38MAPK明显升高,而Ki-67显著降低,差异有统计学意义(P<0.05);通过挽救实验,与shDOT1L组比较,oe-DOT1L组Erk-p、p-p38MAPK明显降低,而Ki-67恢复增高,差异有统计学意义(P<0.05,见图7),说明DOT1L基因调控MAPK信号通路。

与NC组比较,*P<0.05,**P<0.01图7 Western blotting检测两组GC细胞MAPK信号通路相关蛋白及Ki-67蛋白表达水平Figure 7 Expression levels of proteins related to MAPK signaling pathway and Ki67 protein in two GC cells by Western blotting
2.8 CCK8实验检测挽救实验GC细胞增殖能力
与shDOT1L组比较,oe-DOT1L组在2,3,4,5 d观察OD450值明显回升,差异有统计学意义(F=23.140,P<0.05;F=30.47,P<0.05;F=35.401,P<0.05;F=38.524,P<0.05,见图8)。提示过表达DOT1L消除了DOT1L抑制GC细胞增殖的作用,这与蛋白印迹检测结果Ki-67表现一致。

与shDOT1L组比较,*P<0.05,**P<0.01图8 CCK-8测定过表达DOT1L基因对GC增殖能力的影响Figure 8 Effect of DOT1L overexpression on the proliferation of GC by CCK-8
3 讨论
DOT1L作为人体内赖氨酸的甲基转移修饰酶,其是H3K79特异性的甲基化转移酶,与多种癌症有关,并与肿瘤细胞侵袭和增殖相关[12]。Okada有研究发现乳腺疾病中,DOT1L基因与乳腺恶性肿瘤病变的发生发展密切相关,DOT1L基因过表达能够促进乳腺癌的发生发展,临床实验DOT1L基因靶向抑制剂EPZ5676能够使癌细胞的生物学活性发生改变[13]。在白血病(MLL)中,DOT1L能够调控机体免疫细胞活性,提高抗肿瘤能力[14]。最近的一些报道认为DOT1L基因高表达在前列腺癌、直肠癌及食管癌中可能发挥促进肿瘤进展的作用,DOT1L基因可作为潜在的治疗靶点[15,16]。然而,目前DOT1L基因对胃癌的增殖机制,尚无相关报道。
本研究利用生物信息学分析发现DOT1L在GC组织中表达显著高于癌旁组织,并且DOT1L高表达组患者的总生存率明显降低。对DEGs进行集富集分析,预测到MAPK增殖信号通路。为了验证此预测结果,进一步进行体外细胞实验。shDOT1L组的癌株细胞mRNA、蛋白表达量和增殖能力较对照组显著降低,说明抑制DOT1L基因的表达可以抑制GC的增殖能力。检测MAPK信号通路相关调控蛋白,shDOT1L组中Erk-p、p-p38MAPK表达水平升高,提示DOT1L基因调控MAPK信号通路;为了进一步求证进行挽救实验,oe-DOT1L组中Erk-p、p-p38MAPK明显又降低,结果证实了DOT1L基因在MAPK信号通路中起到关键作用。通过CCK-8法检测表明,与shDOT1L组比较,oe-DOT1L组细胞增殖能力明显恢复,说明过表达DOT1L消除了DOT1L基因抑制GC细胞增殖的作用。细胞增殖指数Ki-67在shDOT1L组显著降低,在oe-DOT1L组恢复升高,进一步说明了DOT1L在GC细胞的增殖过程中起到关键作用。综上所述,MAPK号通路可能在DOT1L介导的GC增殖中发挥关键作用,证实了DOT1L通过MAPK通路调控GC细胞增殖的机制。
可逆蛋白磷酸化是信号转导最重要的生物学机制之一,它受到蛋白激酶和磷酸酶的严格调控,维持蛋白磷酸化状态的平衡,控制其生物学功能。MAPK通路在人类癌症中被频繁激活,引发自发性细胞增殖等恶性表型出现,这与之前的研究一致。细胞外信号调节激酶Erk是MAPK通路中的重要成员之一,可将细胞外信号传递至细胞内,激活多种癌基因的表达,促进细胞的增殖、分化及恶性转化等过程[17]。p38 MAPK可通过多个底物(如磷酸化转录因子、与细胞骨架相关的细胞和酶等)来调控细胞的多种生理过程(如细胞凋亡、癌基因转化和细胞增殖、分化等)[18]。
本研究认为,在GC患者中靶向阻断DOT1L基因,可通过MAPK信号通路抑制胃癌细胞的增殖能力。DOT1L可以作为胃癌治疗的新靶点,在临床上可能给胃癌的治疗提供新的思路。MAPK信号通路是复杂的多步骤过程,本研究仅对其中Erk、p38MAPK蛋白进行了研究,且由于只有体外细胞实验结果,存在一定的局限性,是否存在其他调控的增殖通路,还需要对其进行更深入的探索与研究。
