氧化还原反应方程式配平和书写技巧
2020-11-04陆鼎昌林倩楠
陆鼎昌 林倩楠
【考情分析】
氧化还原反应是高中化学的重要模块,也是高考必考知识点之一。分析近几年来的高考化学试题,主要体现在氧化还原反应方程式的配平和书写等,同时结合离子方程式的相关知识,书写氧化还原型的离子方程式。高考主要涉及的知识点包括:氧化还原反应基本概念的判断;质量守恒、电荷守恒、得失电子守恒的应用;结合生产、生活、高科技背景、实验现象,书写陌生的氧化还原反应方程式等。常见的题型如下:①定项方程式配平,②缺项方程式配平,③已知体系中所有物质的书写配平,④信息型方程式的书写配平。本文将对氧化还原反应方程式配平和书写的几种常见题型分类介绍其解题方法。
【典例分析】
不管是哪类题型,我们都必须掌握得失电子守恒法配平方程式的基本步骤:“一标,二找,三算,四定,五平。”具体如下:
1.标变价,标出元素的化合价,找到价态变化的元素。
2.找物质,化合价升高和降低的两条线各找出一种物质(找该元素前后价态全部变化的物质)。
3.算得失,计算上述找到的物质得失电子数(元素的化合价的变化)。
4.定系数,根据最小公倍数,使得失电子总数(化合价的升高和降低)相等。
5.配其他,利用观察法,配平其他物质的系数,把单线改成等号。
一、定项方程式的配平
此类题型是最直接的,也是书写其他类型题目的基础,只要掌握配平的五大步骤,就可以轻松解决问题。
例1 配平方程式:Cu+HNO3(稀)——Cu(NO3)2+NO↑+H2O
答案:3S+6NaOH ══2Na2S+Na2SO3+3H2O
二、缺项方程式的配平
①配氧化剂、还原剂及还原产物与氧化产物。
②根据溶液的酸碱性,结合质量守恒、电荷守恒确定所缺的物质(H+、OH-或H2O),其中酸性环境不能出现OH-,碱性环境不能出现H+。
③根据质量守恒和电荷守恒观察配平其他物质系数。
例2 酸性条件下,请完成该离子方程式:
第一步,先标出已知项各元素价态,并配平,通过标元素的价态可知:Cr2O2-7变为Cr3+,Cr元素价态由+6变为+3,1 个Cr2O2-7得到6e-;Fe2+变为Fe3+,Fe元素的价态由+2 升到+3,1 个Fe2+失去1个e-,根据得失电子守恒,已知项的系数配平如下:Cr2O27-+6Fe2++____——6Fe3++2Cr3++_____。
第二步,根据电荷守恒,发现两侧电荷不守恒,再根据溶液为酸性环境,因此用H+平衡电荷,另一侧补H2O。
第三步,根据质量守恒和电荷守恒观察配平其系数,左侧应该补14个H+,根据质量守恒,右侧还缺少14个H,7个O,因此应该是7个H2O。
答 案:Cr2O2-7+ 6Fe2++ 14H+══6Fe3++2Cr3++7H2O
三、已知体系所有物质的书写配平
这一类题目,会把体系中所有的反应物生成物一起给出,需要自己判断哪些是反应物,哪些是生成物,有时候可能会给一些信息提示转化方向,有的题目没有任何提示,这就要求我们对常见的氧化剂和还原剂有一定的积累,自己判断反应的方向。
例3 某反应体系的物质有NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
请将Au2O3之外的反应物与生成物分别填入以下空格内并配平。
第一步,标出体系给出的所有物质的元素化合价,找出价态变化的氧化剂、还原剂、氧化产物、还原产物。
分析发现是Au 和S 两种元素价态变化,题目中已经把Au2O3写在反应物了,说明Au2O 在生成物中,根据Au的价态由+3降到+1,说明S 的价态应该升高,从而确定Na2S2O3转化为Na2S4O6。
第二步,根据得失电子守恒,对Au2O3、Au2O、Na2S2O3、Na2S4O6配平系数:
1Au2O3+ 4Na2S2O3——1Au2O +2Na2S4O6
坚持服务生产经营不偏离,把提高企业效益、增强企业竞争实力、实现国有资产保值增值作为企业党组织工作的出发点和落脚点,以企业改革发展成果检验党组织的工作成效。
第三步,根据质量守恒,后面还缺少Na,因此NaOH 在生成物中,系数为4,前面缺少H,H2O 在反应物中,系数为2。
答案:Au2O3+4Na2S2O3+2H2O ══Au2O+2Na2S4O6+4NaOH
变式3:请将5 种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,并配平化学方程式。
答 案:24FeSO4+ 30HNO3══8Fe(NO3)3+8Fe2(SO4)3+3N2O↑+15H2O
四、信息型方程式的书写配平
信息型方程式的书写是近几年全国卷考查的主要题型,又经常以离子方程式的形式来体现,这种题型综合性较强,而此类题目的解题难点就在于找出氧化剂和还原剂,以及它们对应的还原产物和氧化产物,因此,具体解题步骤如下。
1.掌握常见的氧化剂和还原剂,以及它们对应的还原产物和氧化产物(见表1)。
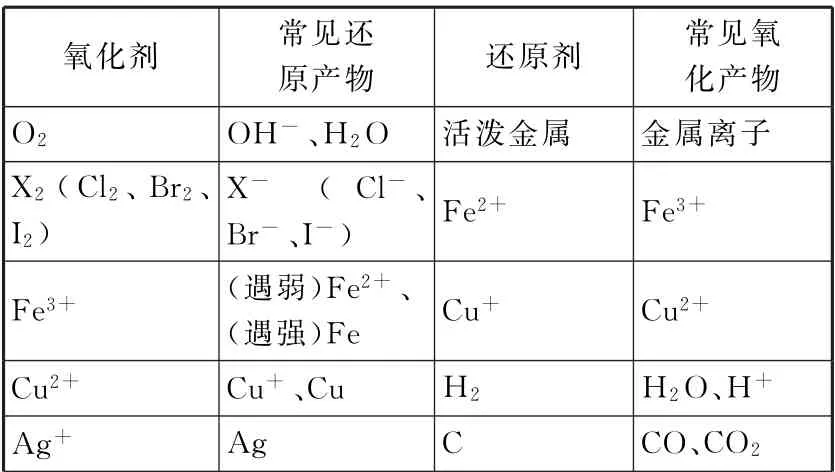
表1
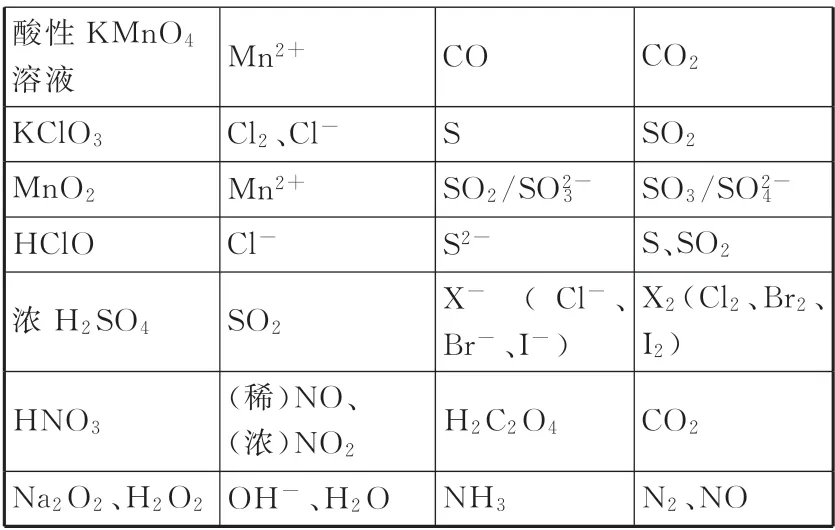
__续表
2.根据信息找出氧化剂、还原剂、氧化产物、还原产物,根据得失电子守恒将这四个配平。
3.结合溶液的酸碱性,以及电荷守恒、质量守恒,按照缺项配平的方法补齐缺项(一般为H+、OH-或H2O)。
例4将 K2SO3溶液逐滴加入到KMnO4溶液(硫酸酸化)中,溶液褪为无色。写出反应的离子方程式:___。
从题干中挖掘有用信息,根据信息中描述溶液褪为无色,证明MnO-4发生了反应,因此属于氧化还原型反应,又要求写离子方程式,因此同时还要兼顾拆写的问题。
第一步,找出氧化剂、还原剂及其对应的还原产物和氧化产物。根据积累得知SO2-3具有还原性,氧化产物为SO2-4,MnO-4具有强氧化性,氧化产物为Mn2+,根据得失电子守 恒 将 其 配 平:5SO2-3+ 2MnO-4——5SO2-4+2Mn2+
第二步,结合溶液的酸碱性,以及电荷守恒,质量守恒,按照缺项配平的方法补齐缺项。根据信息显示,溶液用硫酸酸化,因此溶液呈酸性,结合电荷守恒和质量守恒,左侧应该补6个H+,右侧补3个H2O。
答 案:5SO2-3+ 2MnO-4+ 6H+══5SO2-4+2Mn2++3H2O
变式4:亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业中。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
答案:2ClO2+H2O2+2OH-══2ClO-2+O2↑+2H2O
