PET水解酶的研究进展
2020-11-02石利霞高松枫朱蕾蕾
石利霞 高松枫 朱蕾蕾
(中国科学院天津工业生物技术研究所,天津 300308)
聚对苯二甲酸乙二醇酯(Polyethylene terephthalate,PET)是以石油为原料的一种常见塑料,由对苯二甲酸(Terephthalic acid,TPA)和乙二醇(Ethylene glycol,EG)通过酯键聚合而成[1]。PET广泛应用于包装、建筑、电气等行业,如饮料瓶、薄膜和工程塑料[2]。PET在被广泛应用的同时,由于其废弃物难以自然降解而造成了严重的环境污染。目前,PET废弃物的处理方法主要有垃圾填埋法、热处理法、化学回收法,这3种处理方式产生的废气废水均会对环境造成二次污染且带来巨大的能源消耗[3]。近年来,生物回收塑料废弃物因其作用条件比较温和环保、安全性较高而备受关注,将有望发展成为塑料降解的方法之一。
目前已从微生物中分离出多种PET水解酶,包 括 角 质 酶[4-12]、脂 肪 酶[13-22]、PETase[23]等。PET水解酶可在较为温和的条件下将PET水解为对苯二甲酸单羟乙酯(Mono(2-hydroxyethyl)terephthalic acid,MHET)、对苯二甲酸双羟乙酯(Bis(2-hydroxyethyl)terephthalic acid,BHET)、乙二醇(Ethylene glycol,EG)和对苯二甲酸(Terephthalic acid,TPA)等组分(图1),而得到的单体可进一步循环利用,更加绿色环保。因此,使用酶法降解PET具有不可替代的优势。其中,脂肪酶对PET的水解活性最低,这可能是由于其催化中心被“盖子”结构覆盖,从而阻碍了酶与底物的有效催化,一般需要在反应体系中添加表面活性剂(如洗涤剂或增塑剂)进行界面活化以增强活性[15]。角质酶是目前研究最广泛的PET水解酶,已解析获得若干来源于细菌和真菌的角质酶的晶体结构(表1),其含有较宽的底物结合口袋且没有“盖子”结构,容许刚性长链聚合底物PET进入酶的活性中心,所以对PET的水解活性较高。角质酶一般在高温(50-70℃)条件下才能发挥降解作用(表1)。目前已发现几种角质酶可以显著降解结晶度较低的PET,如LCC[5]、HiC[6]等。将角质酶、脂肪酶用于PET水解是老酶新用,而PETase是2016年Yoshida等[23]从一种能“吃”PET塑料的细菌Ideonella sakaiensis中分离出的一种新型PET水解酶。它能够在30℃条件下高效特异性水解PET,但其热稳定性较差,与角质酶在高温条件下才能发挥降解作用形成了鲜明的对比。其次,Yoshida等还发现Ideonella sakaiensis中存在一种类似阿魏酸酯酶的MHET水解酶MHETase,可将PET主要中间产物MHET特异性水解生成TPA和EG(图1),对PET的完全降解也很重要。
PET水解酶在PET生物降解中显示出巨大的潜力,但PET水解酶在催化效率、热稳定性等方面仍存在诸多不足,目前无法很好地满足工业应用需求。随着蛋白质晶体结构、催化机制等研究的深入,利用(半)理性设计对PET水解酶进行分子改造的研究备受关注。本文综述了不同PET水解酶的结构、降解机理,重点介绍了角质酶和PETase的分子改造进展,旨在为改造PET水解酶以实现其工业化应用提供一定的参考依据。
1 PET水解酶
1.1 角质酶
角质酶是存在于大多数植物病原菌和腐生植物中的胞外丝氨酸酯酶,可以水解水溶性酯、乳化的三酰甘油及合成聚酯,如聚ε-己内酯(Polycaprolactone,PCL)和聚对苯二甲酸乙二醇酯(PET)等[24]。表1列出了目前报道的可水解PET的角质酶类型及降解能力。
1.1.1 角质酶的结构和催化机制 角质酶属于丝氨酸水解酶家族,具有α/β-水解酶结构。角质酶的活性位点处有氧阴离子穴,用于识别、结合底物;其催化三联体(Ser-His-Asp)一般位于由疏水氨基酸包围的表面沟槽中,有利于容纳底物PET[9]。
来源于Thermobifida fuscaKW3的TfCut2的 晶体结构表明(图2),残基Y60和M131可以形成氧阴离子空穴,它们的主链氮原子与底物PET的羰基氧原子相互作用,从而使可裂解酯键靠近催化三联体中的活性丝氨酸。此外,I178、W155和F209与PET链的苯环之间具有疏水相互作用,这些残基与PET的相互作用均有利于酶对底物的识别[12]。
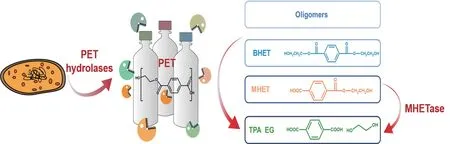
图1 PET水解酶降解PET过程

表1 可水解PET的角质酶类型及降解能力

图2 TfCut2的结构(PDB:4CG1)[12]
1.1.2 角质酶的分子改造进展
1.1.2.1 扩大酶活性位点空间及增加疏水性以提高角质酶活力 酶与底物的识别及结合是酶解过程中的重要环节,这要求酶的活性位点处有足够的空间容纳聚酯底物,因而对酶的活性口袋适当扩大可提高酶解效率[25-29]。同时增加活性位点处氨基酸的疏水性,也可促进酶分子与疏水底物的结合[30-31]。
基于上述理论,Silva等[25]采用定点突变的方法将来源于Thermobifida fusca的Tfu_0883进行分子改造,得到的突变体I218A和Q132A/T101A对PET纤维的降解活性均有提高。Araujo等[26]对来源于F. solani pisi的FsC的活性位点残基进行突变,将该处的亮氨酸替换为空间位阻较小的丙氨酸,扩大了底物的结合口袋,得到的突变体L182A和L81A对PET纤维的水解活性分别提高了4倍和5倍。此外,Kawabata等[30]基于Cut190晶体结构进行半理性设计,将该酶的活性口袋扩大,以形成额外的空间更好地容纳底物,得到的突变体Q138A的降解性能明显提高。
1.1.2.2 增加二硫键以提高角质酶热稳定性 二硫键的存在有利于蛋白质的稳定性,该特征已成功应用于改造提高酶的热稳定性[31-33]。Then等[31]研究发现,当TfCut2的金属离子结合位点结合Ca2+时,会抑制催化三联体发挥作用,他们用二硫键替换该酶的金属离子结合位点,不仅提高了该酶的热稳定性,也消除了水解过程中该酶对Ca2+的依赖。最近,Tournier等[34]基于LCC的晶体结构进行理性设计,添加二硫键来提高LCC的热稳定性,得到的突变体D238C/S283C的Tm与野生型相比提高了9.8℃,活性仅下降28%。其同时对底物结合附近的热点氨基酸进行定点突变,在突变体D238C/S283C的基础上进行组合,最后得到组合突变体F243I/D238C/S283C/Y127G(ICCG),Tm与WT-LCC相 比 提 高 了9.3℃,活性基本完全恢复。在72℃条件下反应9.3 h后,对切碎的PET塑料瓶(PcW-PET)的水解率高达90%,是目前为止效率最高的PET水解酶,且得到的单体可用于再生PET,有助于实现PET废弃物的循环利用。
1.1.2.3 减少产物抑制 PET经过酶解后,产生的中间产物(BHET和MHET)可竞争性的结合到酶的底物结合位点,从而抑制PET的进一步降解[35]。Wei等[36]对TfCut2的氨基酸残基进行突变,得到的突变体G62A的降解效率提高了2.7倍,分析表明,在TfCut2中,59位的Gly的主链氮原子可与MHET的羰基氧相互作用,而60位的Gly突变为Ala后,由于Ala侧链引起的位阻,G62A突变体无法通过G59与MHET相互作用,从而导致该酶对MHET的结合常数降低了5.5倍。
采用双酶体系也有利于PET的酶解,双酶体系一般包括聚酯降解酶和清除中间产物的酶[35]。Barth等[37]采用固定化双酶体系(TfCa-TfCut2和 TfCa-LCC)实现PET的高效降解,其中TfCa水解中间产物BHET和MHET,与单酶处理相比,双酶的协同作用使水解产物总量分别增加91%和104%。
1.1.2.4 增加角质酶与底物有效接触面积 聚酯降解酶与疏水结合域的融合有助于加快聚合物的水解作用[38],可能是以下两种原因:(1)酶表面的疏水性增加,与疏水聚合物之间的吸附性增强,使得聚合物界面上的酶量增加[39];(2)有些结合模块会破坏聚合物的结构,从而使得目标化学键更容易进入酶的活性位点区域[40]。Ribitsch等[41]将来源于Thermomyces cellullosylitica的Thc_Cut1与疏水性模块CBM和PBM进行融合,得到的融合酶(Thc_Cut1+CBM)和(Thc_Cut1+PBM)对PET的吸附性增强,水解产物(MHET和TPA)的产量与Thc_Cut1相比明显增加。Ribitsch等[42]还将Thc_Cut1与疏水蛋白HFB4和HFB7分别进行融合,得到的融合蛋白对PET的水解作用提高了约15倍。
1.2 PETase
与角质酶、脂肪酶相比,来源于Ideonella sakaiensis的PETase可以在30-40℃更加特异性高效降解PET[23]。
1.2.1 PETase的结构和催化机制 目前PETase的晶体结构已被中国、美国、韩国及德国等国家的研究团队以不同的分辨率解析。PETase采用典型的α/β水解酶折叠方式,含有由9个β-链组成的中心:β-折叠,其被7个α-螺旋夹在中间[43]。PETase具有催化三联体(S160-H237-D206)和氧阴离子穴(Y87、M161)[44-45]。PETase含有两个二硫键,二硫键2(DS2)在所有同源酶中都是严格保守的,特异性二硫键1(DS1)位于活性位点附近(图3-A)[44-45]。Fecker等[46]通过分子动力学模拟证明,PETase的活性位点在室温下具有更高的柔韧性,这种柔韧性由其活性位点中独特的二硫键(DS1)控制,将其除去会导致催化三联体不稳定并降低活性。因此,DS1在PETase中起关键作用。
Joo等[43]使 用MHET四 聚 体(MHET4)和PETase进行分子对接计算,估算出其底物结合裂隙为40Å的细长沟槽,分为两个亚位点:亚位点I和II,分别结合1个和3个MHET部分。亚位点I中,MHET4的第一个MHET置于Y87和W185的两个芳香族残基之间,形成π-π相互作用。亚位点II由残 基T88、A89、W159、I232、N233、S236、S238、N241、N244、S245、N246和R280组成,亚位点II根据第2、3和4个MHET的位置进一步分为IIa、IIb、和IIc。亚位点II和MHET4的后3个MHET主要是通过疏水相互作用介导的(图3-B)。
根据PETase的晶体结构,与不同配体的分子对接模型,定点突变实验及已熟悉的α/β水解酶家族的水解机理,推测PETase的催化机制[43-44,47-49]如下:当PET通过疏水相互作用与PETase结合时,PETase表面上形成浅裂缝,残基(His和Asp)形成激活亲核试剂(Ser)的电荷中继网络。位于第一苯环的羰基被引导至底物结合裂缝的中心,催化三联体进行亲核攻击,形成第一四面体中间体,氧阴离子空穴使酯键极化并使反应中间体稳定。随后,由水分子将该第一四面体中间体转化为酰基-酶中间体,并进行第二次亲核攻击以裂解酯键。在酯键断裂后,剩余的苯甲酸基团形成较宽平面,由于W185构象的可变性,其易于与W185侧链面对面堆叠。因此,产物旋转并被拉开,最终从活动中心释放(图3-C)。
近期,Wei等[50]通过Solid-state NMR实验分析发现,无定形PET高分子链中乙二醇(EG)单元的OC-CO扭转角Ψ的trans/gauche比率明显低于2-HE(MHET)4中的t/g比率;且通过(MAS)NMR方法研究了无定形PET中的局域和大规模协同主链运动,表明无定形PET在30℃从gauche构象到trans构象的转变受到了很大的限制。因此,其认为Joo等[43]使用柔性低聚合底物的构象拟合来解释PETase对PET的降解机理可能不合理,促进底物结合的关键因素不是PET链构象的相互转换,而是苯亚基与周围疏水残基之间的弱相互作用。Joo等(Seo)[51]做出回复基本同意以上观点。因此若能解析PETase和底物PET或较长寡聚物的共结晶,则更有意义。

图3 PETase的结构、底物结合位点和催化机制示意图[43-44,47-49]
PETase对PET的水解活性高于其他PET水解酶,可能是由于以下独特的结构特征:(1)PETase含有一对W159-S238残基,可形成足够的空间来容纳底物;(2)PETase连接环中的3个额外的残基S245、N246和Q247提供了足够的空间来容纳PET;(3)PETase在活性位点附近具有一个额外的二硫键,这对其热稳定性和活性至关重要[52];(4)PETase的W185存在多种构象,容许PET大分子进入酶的活性中心[27,44]。
1.2.2 PETase的分子改造进展
1.2.2.1 基于理性设计改变底物结合口袋 影响PET降解效率的主要因素在于酶与底物的有效吸附[53]。Joo等[43]通过分子对接发现,R280位于IIc的末端,似乎阻碍了底物的延伸,将其突变为丙氨酸,突变体R280A对PET的降解活性提高了约33%。Austin等[54]发现PETase比同源角质酶具有更开放的活性位点裂隙,通过将两个活性位点残基W159和S238突变为角质酶中保守的氨基酸,使结合裂缝变窄,所得突变体S238F/W159H降解PET的性能得到提高。Ma等[55]对底物结合附近的热点氨基酸进行定点突变,同时,使用无细胞蛋白表达系统进行高通量表达和筛选,成功筛选出3株突变体:R90A,L117F和I208F,酶活性与野生型相比分别提高了约1.6、2.1和2.5倍。Liu等[56]根据PETase的结构进行定点突变,筛选出5株酶活性提高的突变体:Y87A、W159A、W159H、A209I和S214H,产物TPA的产量最高可达野生型的3倍。
Liu等[57]发现PETase对于萘酯几乎没有降解作用,其基于PETase结构信息对催化中心周围的关键残基进行了突变,以改变这些残基的疏水性,减轻空间位阻效应,得到的突变体S93M、W159F和N241F都能水解萘酯。
1.2.2.2 基于理性设计和固定化技术增强PETase热稳定性 一般来讲,聚合物在接近或高于玻璃化温度(Tg)的条件下,其非结晶区域会变得更加灵活,更容易接受酶的攻击,从而加快降解速率[58-59]。酶促反应在水溶液中进行,PET的Tg值降低至60-65℃[60]。而PETase在30-40℃下降解PET,极大的限制了催化效率。
Son等[61]为了提高PETase的热稳定性,开发了一种合理的蛋白质工程策略。综合考虑蛋白质热稳定性与活性的关系,其集中在远离活性位点的结构区域进行研究,发现在PETase中,由于β6链的异常构型,中心β片层被打断,与总体b因子(16.1)相比,β6-β7连接环显示出更高的b因子(22.2),随后将PETase与热稳定性较高的TfCut2的相应区域进行比较发现,由于氢键的存在,β6-β7连接环在TfCut2中形成了相当稳定的结构。因此,其拟通过在PETase中引入氢键增加β6-β7连接环的稳定性。最后得到具有稳定的β6-β7连接环(S121E/D186H)和底物结合亚位点IIc得到扩展(R280A)的三突变体:S121E/D186H/R280A,与野生型相比,该突变体的Tm值提高了8.81℃,PET的降解活性在40℃提高了约14倍[61]。
Liu等[57]采用硫酸铵沉淀法和戊二醛交联法固定化PETase,提高了PETase的热稳定性,最适温度从25-35℃延长至25-45℃,酶活力在65℃时仍保持较高活性。
1.2.2.3 增加PETase与底物有效接触面积 若使用合适的分子介导酶与PET之间相互作用,可以增加酶与PET膜的接触面积,酶的降解活性得到改善[42]。
王泽方等[62-63]通过研究表明疏水蛋白的自组装功能可以控制PETase在PET表面的有效吸附,同时利用大肠杆菌和毕赤酵母表面共展示HFBIPETase融合酶,可极大提高酶的催化效率。由于PETase表面带正电荷(pI=9.4),Furukawa等[64]尝试将PET膜与不同的阴离子烷基表面活性剂预孵育,将PET表面转化为带负电荷,然后再进行酶促水解,结果表明,PET膜经表面活性剂预处理后,PETase降解活性在30℃提高了约120倍。
1.2.2.4 PETase分泌表达 PET作为一种高分子聚合物,无法进入细胞,其降解需将PETase分泌至胞外。尽管Ideonella sakaiensis可以分泌PETase降解PET,但面对各种环境条件,其分泌量可能较低。因此,从常应用于工业的宿主中获得PETase的分泌表达非常重要。
Huang等[65]采用B.subtilis168表达系统,测试3个Sec信号肽和2个Tat信号肽及其天然信号肽SPPETase用于介导PETase的分泌量,结果表明,通过PETase天然信号肽SPPETase介导得到最高分泌量的有活性的PETase。Seo等[66]通过将来自大肠杆菌的Sec依赖性信号肽融合到PETase中,建立了5个PETase分泌表达系统,使用表达量最高的pET22b-SPLamB:IsPETase分泌系统成功表达出对PET膜有活性的细胞外酶PETase。Moog等[67]使用海洋光合单细胞真核生物Phaeodactylum tricornutum作为PETase的宿主,成功得到分泌型融合蛋白AP_SPPETaseR280A-FLAG,其在不同条件下对不同PET底物(商业瓶PET、PETG和PET粉碎物)显示出不同的降解能力,有助于PET微塑料污染海水的生物修复。Chen等[68]将酵母菌P. pastorisGS115作为宿主来表达PETase,同时从宿主中选择3种内源性GPImodified细 胞 壁 蛋 白:GCW21、GCW51、GCW61作为锚定蛋白来展示PETase,最后得到有催化活性的融合蛋白:pPIC9-PETase-GCW21/51/61,实现PETase的酵母细胞表面展示降解高结晶度的PET,且与纯酶相比,转化率提高了约36倍。
此外,定向进化技术也是蛋白质分子改造的一个重要策略[69]。其利用易错PCR等技术建立突变体文库,然后采取合适的筛选体系在特定条件下筛选得到目标突变体[70]。本实验室最近通过对PETase分泌表达系统的信号肽进行定向进化,筛选得到的信号肽突变体使得PETase的胞外分泌量提高了约3倍[71]。
1.3 脂肪酶
脂肪酶又称甘油酯水解酶,属于羧基酯水解酶类[72]。一些脂肪酶不能水解PET膜,但对PET纤维和寡聚物有活性[73-74](表2)。
脂肪酶同样采用α/β水解酶折叠方式,其还具有由α-螺旋的额外肽段构成的“盖子”结构域,可盖住活性口袋以保护催化三联体[75](图4为来源于T.lanuginosus的脂肪酶TLL的结构[76])。“盖子”的存在使得刚性聚合物较难进入底物结合位点,所以脂肪酶对PET的水解活性较低,其对PET纤维的主要作用是使其表面亲水化,削弱纤维强度,但无法显著降解PET的结构模块,因此也有研究者将脂肪酶归类为PET表面修饰酶[77]。
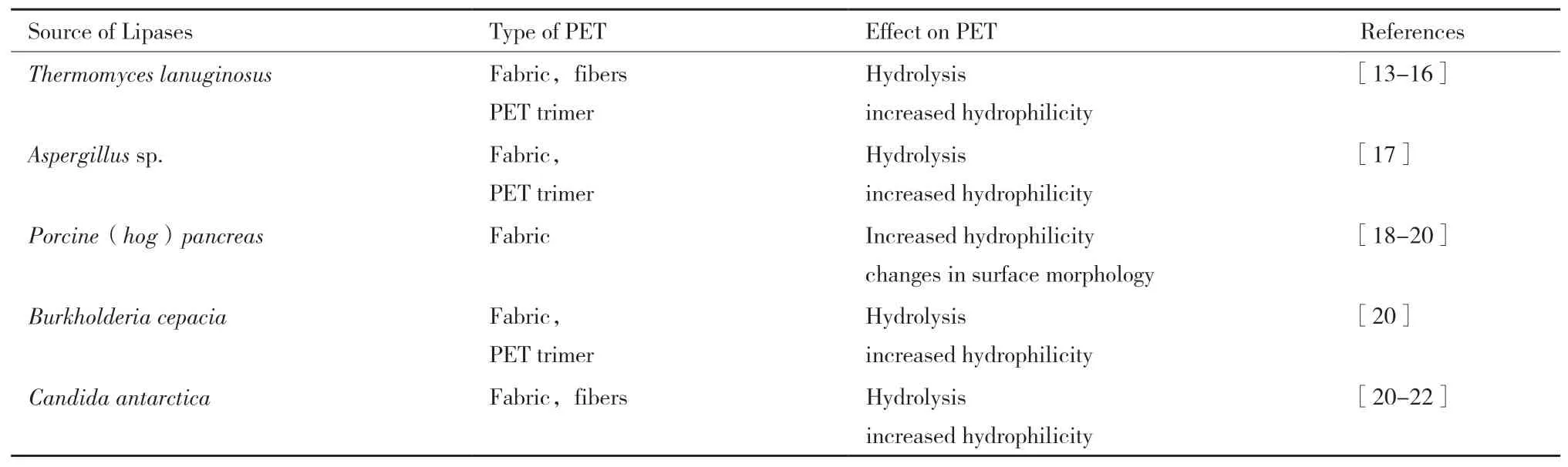
表2 脂肪酶类型及对PET的水解能力

图4 TLL的结构(PDB:1DT3)[76]
1.4 MHETase
MHETase同样是从Ideonella sakaiensis201-F6中分离得到的一种水解酶,它能与PETase协同作用,将PETase中间产物MHET降解为TPA和EG,对PET的完全降解也很重要[23]。通过多重序列比对,初步认定MHETase属于鞣酸酶家族[78]。
最 近,Palm等[78]首 次 解 析 出MHETase的晶 体 结 构,MHETase存 在α/β水 解 酶 结 构 域(MHETaseHyd)和 盖 子 结 构 域(MHETaseLid),MHETaseLid为α螺旋折叠结构(图5-A)。
他们解析了MHETase-MHETA((2-羟乙基)对苯二甲酰胺)的复合物结构[78]。MHETA的整个苯环部分与MHETaseLid结构域的残基F415,L254和W397紧密结合,游离羧酸盐的两个氧与MHETaseLid的R411结合(图5-B)。由此说明,尽管MHETase存在典型的催化三联体和氧阴离子孔,但其底物特异性几乎完全由MHETaseLid赋予。
他们推断MHETase的诱导机制如下:在无配体的结构中,F415指向远离活性位点的位置,底物结合位点属于打开状态;当底物MHETA进入底物结合位点后,会触发F415侧链绕 χ1旋转近180°,从而封闭活性位点并巩固相互作用。所以,不同于PETase,MHETase与底物的结合非常紧密,导致其特异性地水解MHET,而对BHET和PET并无水解活性,表现出高度的底物特异性[78]。
此 外,Palm等[78]通 过 定 点 突 变 来 改 变MHETase的底物特异性,使其能够降解BHET。因此通过MHET的结构表征,将来有可能合理地设计出更有效更实用的MHETase突变体,使其不仅可以降解MHET,还可降解PET的其他中间产物。
2 展望
目前,研究者对PET水解酶已有一定的研究基础,根据已有PET水解酶的晶体结构及催化机理进行(半)理性设计有希望获得降解性能大幅度提高的突变体。同时,应结合定向进化采用高效的筛选方法实现PET水解酶的高通量筛选,推动PET水解酶的高效开发。另外,在已有条件下可以将目前已发现的多种PET水解酶协同发挥作用,如在利用PETase降解PET过程中,可以加入MHETase以去除中间产物MHET,而反应条件如何控制,则需要我们后续的深入研究;也应该继续筛选挖掘可将PET塑料作为唯一碳源的微生物,如筛选在海洋环境中可降解微塑料的菌株,并挖掘关键酶基因等。此外,要实现PET水解酶的工业化应用,还需考虑PET自身的物理性质,如结晶度、玻璃化转变温度(Tg)、熔点、可用表面积等。PET较高的玻璃化转变温度要求水解酶具有较高的热稳定性从而可在高于PET的Tg条件下更加高效降解PET,而PET水解酶的热稳定性还有待大幅度提高。另外,为扩大酶的可接触表面积,PET材料的机械预处理也是必要的。因此,若能将PET的材料性能研究与水解酶研究有机统一起来,做到物理学、化学、生物学的综合应用,将有望实现PET的完全降解及循环利用。总之,酶法降解PET具有巨大的应用前景,需要大力开发,以期在不久的将来作为绿色环保工具应用于塑料的降解。

图5 MHETase的结构和底物结合位点[78]
