交替呼吸途径在油菜素内酯调控本氏烟响应高温胁迫中的作用研究
2020-11-02张瑞平杨峰陈乐章邓星光张大伟
张瑞平 杨峰 陈乐章 邓星光 张大伟
(1. 四川大学生命科学学院,成都 610064;2. 四川省烟草公司攀枝花市公司,攀枝花 617099;3. 四川惠泰农业科技有限公司,成都 610200)
植物在生长和发育的过程中面临着多种环境胁迫。植物为了在环境中生存,进化出一系列复杂的网络调控机制来感受环境变化的信号并调整自身适应环境刺激。其中,植物激素对调节植物对逆境的响应起到至关重要的作用。此外,有研究证明线粒体交替呼吸途径也参与植物对逆境的响应[1-2]。
油菜素内酯(Brassinosteroids,BRs)是一类重要的甾醇类植物激素,它广泛参与调控植物的生长、细胞伸长、光形态建成、根与气孔发育等多个过程[3-4]。目前BR在植物中的信号转导途径已经研究得比较清楚。BR首先被定位于细胞膜上的受体激酶BRI1所感知[5]。另一个膜受体激酶BAK1,能够与BRI1结合,并起到增强BR信号的作用[6]。BR被感知后通过一系列级联磷酸化反应最终激活BES1/BZR1家族转录因子的活性,从而调节成千上万靶基因的表达[7]。BR除了调控植物生长发育过程之外,也参与调控植物对环境胁迫的响应如抗冷、抗盐、抗干旱、抗重金属毒害等[4,8-9]。
线粒体呼吸是植物产生ATP的主要来源。植物线粒体中除细胞色素呼吸途径外,还具有一条对氰化物不敏感的电子传递途径,即抗氰呼吸途径,也叫交替呼吸途径[2]。交替氧化酶(Alternative oxidase,AOX)是交替呼吸电子传递链中的末端氧化酶,对植物抗氰呼吸起到了主要的调控作用[10],是植物调控抗逆网络的重要成员。目前研究发现AOX参与调控植物对干旱胁迫[11]、盐胁迫[12]、冷胁迫[13]以及病原物的抗性[14]。尽管如此,有关交替呼吸途径调控植物抗逆的作用机制仍不清楚。
高温是限制植物生长发育的重要环境因子。随着全球气候的变暖,高温导致的热胁迫严重制约作物的生长、发育和产量,极端的高温甚至造成植被的死亡[15]。因此,研究植物响应高温胁迫的分子机制具有重要的意义。有研究发现BR可以在高温下促进植物下胚轴的伸长[16],然而其如何调控植物对高温胁迫的响应还不清楚。本研究以本氏烟草为材料,探究交替呼吸途径在BR调控植物响应高温逆境中的作用机制,旨为培育高产抗逆遗传改良作物提供理论依据。
1 材料与方法
1.1 材料
本试验所用植物材料为野生型本氏烟草(Nicotiana benthamiana)。
1.2 方法
1.2.1 化学试剂处理 BL(最具活性的BR)购自Wako Pure Chemical Industries公司(日本)。交替途径抑制剂水杨基异羟肟酸(Salicylhydroxamic acid,SHAM)购自Sigma公司(美国)。所有的药剂溶于含0.02%吐温20的超纯水中。各试剂浓度如下:BL,0.1 μmol/L;SHAM,1 mmol/L。对照为含0.02%吐温20的超纯水。
1.2.2 高温胁迫处理 实验所用植株在温室内生长,温度为25℃。光照强度为100 μmol/m-2·s。光照条件为每天16 h光照,8 h黑暗。将正常条件下生长3周的幼苗转移至37℃热胁迫环境下处理3 d。
1.2.3 病毒诱导的基因沉默 本实验所用基因沉默方法为烟草脆裂病毒(Tobacco rattle virus,TRV)介导的植物沉默方法(VIGS)。NbAOX1编码区片段 用 引 物F:GGAGGATGGATCAAAGCAC & R:ATGGCAATAGCAGGAGCAG扩 增 所 得,片 段 纯化后定向插入至pCRTM8/GW/TOPOTMTA Cloning Kit(Invitrogen,美国)质粒,通过GatewayTMLR ClonaseTMII Enzyme Mix试剂盒(Invitrogen)经LR反应后交换至pTRV2质粒。将构建好的质粒转化至农杆菌GV3101株系。摇菌过夜后离心,用瞬时表达缓冲液(10 mmol/L MgCl2,10 mmol/L MES,和200 μmol/L乙酰丁香酮)重悬后静置3 h。将含pTRV1的农杆菌重悬液和带有目的片段的pTRV2农杆菌重悬液按照1∶1的比例混合,通过无菌针管注射至本氏烟叶片。
1.2.4 呼吸检测方法 植物呼吸测定用Clark型氧电极(英国),取50 mg叶片并将其剪成碎片,悬浮于20 mmol/L的磷酸钾缓冲液中(pH 6.8),等待15 min后进行呼吸测定,以避免机械损伤诱导呼吸。不加呼吸抑制剂时测得的数值为总呼吸Vt;同时加入细胞色素途径抑制剂KCN(终浓度为1 mmol/L)和交替途径抑制剂n-丙基没食子酸(终浓度为0.5 mmol/L)测得剩余呼吸Vr;仅加入1 mmol/L KCN时测得的呼吸活性为V0。细胞色素呼吸值Vcyt=Vt-V0;交替呼吸值Valt=V0-Vr。上述呼吸量均以μmol O2·mg-1FW min-1表示。每个样品重复测定6次,取平均值。
1.2.5 RNA提取及RT-PCR 叶片总RNA提取用了全式金公司(中国)植物总RNA提取试剂盒,提取方法参照说明书。反转录采用Invitrogen公司(美国)SuperScript III Reverse Transcriptase试剂盒。荧光定量PCR扩增实验使用TaKaRa公司(日本)的SYBR Premix Ex Taq试剂盒进行,NbAOX1(序列号:KF367455)基因表达检测引物序列为F:TGAATGATAAGCAGCACGAT & R:TGACGGTCCAATAAGCAAA,内参基因NbACTIN(序列号:AY179605)扩增引物序列为F:ACTGATGAAGATACTCACA & R:CAGGATACGGGGAGCTAAT。每组实验重复3次。
1.2.6 叶绿素荧光参数分析 叶绿素荧光参数测定采用饱和脉冲分析方法,数据采集通过叶绿素荧光成像系统IMAG-MINI(德国)。植物首先暗处理30 min,打开测量光,记录暗处理后初始荧光值Fo;打开饱和脉冲并持续0.8 s,测得暗处理后最大荧光值Fm;关闭饱和脉冲,打开光化光,记录叶绿素荧光从黑暗到光照的响应过程,等荧光曲线趋于稳定时关闭光化光,打开饱和脉冲0.7秒,此时测得叶绿素荧光峰值Fm'。光系统II的最大光效率Fv/Fm=(Fm-Fo)/Fm;非光化学淬灭值NPQ=(Fm/Fm')- 1。
1.2.7 抗氧化系统活力测定 取500 mg叶片于5 mL提取液[含25 mmol/L PBS,0.2 mmol/L EDTA,2 mmol/L抗坏血酸和2%聚乙烯吡咯烷酮(PVP)pH7.8]中研磨。12 000 r/min低温离心20 min,取上清液用来检测抗氧化酶活性。超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)、愈创木酚过氧化物酶(Guaiacol peroxidase,GPX)和抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)活性检测方法参照Xu等[17]的文章。
1.2.8 植物氧化损伤分析 超氧化物用0.5 mg/mL硝基氯化四氮唑蓝(Nitro blue tetrazolium,NBT)染色2 h。过氧化氢用2 mg/mL 3,3'-二氨基联苯胺(3,3'-diaminobenzidine,DAB)染色8 h。
叶片相对含水量RWC=(Fw-Dw)/(Tw-Dw)×100%。其中Fw代表叶片湿重;Dw代表叶片干重;Tw代表叶片饱和吸水重量。
电导率(Electrolyte leakage,EL)表示植物细胞质膜的透性,检测方法如下:取0.5 g新鲜叶片,洗净后用剪刀将其剪碎,加入5 mL超纯水后真空抽滤20 min,在室温下静置1 h,用电导率仪器测试电导率Ri。然后沸水浴中煮5 min,冷却到室温然后再测定电导率Rt,相对电导率Ro=Ri/Rt。
丙二醛(Malondialdehyde,MDA)含量可以用来表示细胞脂质过氧化情况,其定量方法参考Deng等[9]文章。
2 结果
2.1 高温胁迫下BR激活交替呼吸途径
为了探索高温逆境下BR与交替呼吸途径之间的关系,首先检测了BR处理后本氏烟交替呼吸的变化情况。结果显示在正常生长条件下,与对照组(水处理)相比植株在喷施BL后交替呼吸强度显著上调,NbAOX1表达量也表现出明显上升。在化学试剂处理 12 h后,将植株移至37℃生长条件下,并连续检测了其交替呼吸及AOX1表达量随时间的变化。如图1所示,高温逆境条件下生长的植物,其抗氰呼吸、AOX1基因表达水平高于正常生长条件下的植株;这种趋势在BL处理后更为显著。这些结果说明BR能够诱导植物AOX途径以响应高温逆境。

图1 BR诱导交替呼吸Valt及NbAOX1表达量随时间的变化
2.2 BR诱导的交替途径减高温缓胁迫对光系统的损伤
为了进一步分析交替呼吸途径在BR介导的植物抗高温中的功能,我们通过叶绿素荧光成像系统分析了热胁迫下植物光系统II的功能。如图2所示,正常生长条件下,对照组与处理组植株光系统II参数无明显差别。在高温胁迫下,喷施BL的植株其光系统II的最大光效率Fv/Fm比水处理植株高(图2-A-B)。相反,BL处理植株非光化学淬灭值NPQ比水处理植株低(图2-C-D)。然而,BL处理对植物光系统的保护作用在交替途径抑制剂SHAM存在时会受到抑制。为了进一步分析AOX1对BR诱导植物抗逆的影响,用VIGS技术沉默了NbAOX1基因。与SHAM共处理相似,在高温处理下,NbAOX1沉默植株中喷施BR不能够明显上调Fv/Fm及下调NPQ(图2)。这些结果证明BR诱导的交替途径能够在逆境中保护植物光系统。

图2 交替呼吸途径参与BR缓解植物在逆境中的光系统损伤
2.3 高温逆境下BR诱导的交替途径减轻ROS的积累
植物在响应逆境胁迫时往往会伴随着ROS的积累。本研究用NBT及DAB染色法检测了植株中超氧化物及过氧化氢的含量。这两种方法都检测到胁迫条件下ROS积累明显变多,而BR处理会在一定程度上降低ROS的积累。然而在SHAM预处理或NbAOX1沉默植株中,BR缓解ROS积累的情况受到显著抑制(图3-A-B)。
组织的电导率(EL)、MDA及相对含水量(RWC)这些生理指标被常用来表现植物在逆境中受到氧化损伤的情况。与ROS积累相似,高温胁迫能够导致植株EL及MDA含量上升。与水处理植株相比,BL处理植株表现出更低水平的细胞死亡、EL及MDA含量(图3-C-D)。植物在逆境中RWC会明显降低,而在相同条件下,BL处理后的植株中RWC明显高于水处理植株(图3-E)。然而,热胁迫处理后BR对以上3个生理参数的调控作用在SHAM共处理或NbAOX1沉默植株中会受到抑制。
2.4 高温逆境下交替呼吸途径对BR激活本氏烟抗氧化系统的影响
植物中抗氧化系统能够减缓植物在逆境下所受的氧化损伤。本研究也检测了4种抗氧化酶活性的变化情况,包括:超氧化物歧化酶SOD、过氧化氢酶CAT、抗坏血酸过氧化物酶APX和愈创木酚过氧化物酶GPX。如图4所示,在正常生长条件下,对照组与处理组植株抗氧化酶活性无明显差别。在热胁迫处理后,抗氧化酶活性明显上调,而这些上调在喷施BL植株中要强于喷施水的植株。有趣的是,SHAM处理或沉默NbAOX1基因能够抑制BR激活这4种抗氧化酶的活性。
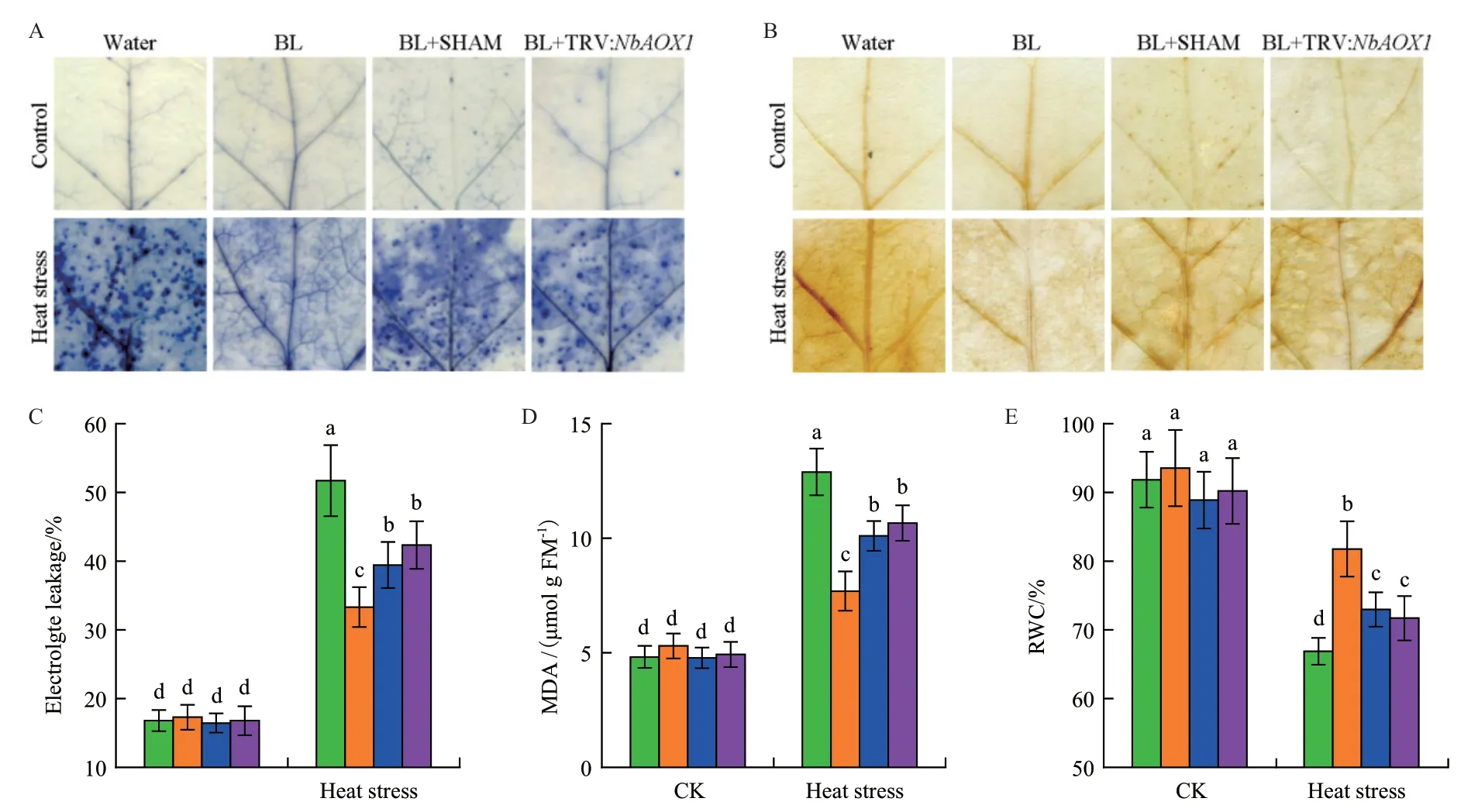
图3 交替呼吸途径参与BR缓解高温逆境对植物造成的氧化损伤

图4 高温逆境下交替呼吸途径参与BR激活本氏烟抗氧化酶活性
3 讨论
有关交替呼吸途径在植物响应逆境方面调控的研究越来越多,在过去十几年内,人们发现AOX可能是线粒体调控植物抗逆的重要成员之一。许多逆境胁迫如冷胁迫、干旱胁迫、盐胁迫等都能诱导植物抗氰呼吸、AOX转录及蛋白水平上调[11,17-18]。有研究报道植物激素能够诱导交替呼吸途径。在烟草中,低浓度的水杨酸能够诱导AOX基因表达及抗氰呼吸[19]。植物响应逆境时乙烯信号常常与交替呼吸途径存在多重交叉影响[12,17]。这些研究都说明植物中交替途径与植物激素间存在一定联系。本研究证明了在本氏烟草中BR也能够诱导交替途径,外施BR能够诱导植物抗氰呼吸及NbAOX1基因转录水平,这些结果为BR与交替呼吸途径之间存在关联提供了证据。有意思的是,BR对交替呼吸途径的诱导作用在高温逆境下尤为显著,这暗示了交替途径可能参与BR调控植物响应高温逆境的过程。事实上,实验结果也证明了交替呼吸途径在BR诱导植物对热胁迫抗性的过程中发挥了重要作用。无论是通过化学试剂处理还是基因沉默方法抑制交替呼吸途径后,高温逆境下BR处理对烟草光合系统的保护能力受到了一定程度的抑制。
BR诱导的交替呼吸途径很可能在某种程度上缓解了高温逆境下ROS的过量积累。一般来说,AOX能够通过降低植物线粒体内泛醌的含量从而抑制ROS的合成[20-21]。已有研究报道了过表达AOX基因能够降低植物中ROS的含量[22-23],植物缺失AOX基因后在逆境下会遭受更大程度的伤害[24]。在本研究中,抑制交替途径后BR处理植株在热胁迫条件下仍能积累大量ROS。逆境下抗氧化系统能够清除过多的ROS从而保护植物免受氧化伤害。在本实验中,抑制交替途径对BR在抗氧化酶活性调控方面起到了负面的影响。同样,胁迫损伤指标检测发现在抑制交替途径的植株中,BR处理不能有效地减缓植物遭受的逆境损伤。这些结论都说明在高温逆境下,交替呼吸途径能够帮助BR激活植物抗氧化系统来缓解植物的氧化损伤。
4 结论
在高温逆境下,交替呼吸途径能够被BR信号激活,被激活的交替途径能够抑制植物在逆境中ROS的过量积累及保护光系统。本研究证实了交替呼吸途径参与BR调控植物响应逆境信号,同时也为BR信号在调控植物抗逆方面的研究提供了新的证据。
