肠道微生物对仔猪胆汁酸谱及胆汁酸代谢的影响
2020-11-02李梦颖周华丁玉春刘作华孙静李周权
李梦颖 周华 丁玉春 刘作华 孙静 李周权
(1. 西南大学动物科技学院 生物饲料与分子营养实验室,重庆 400715;2. 重庆市畜牧科学院,重庆 402460;3. 四川农业大学动物营养研究所,成都 611130;4. 农业部养猪科学重点实验室,重庆 402460;5. 重庆市养猪科学重点实验室,重庆 402460;6. 重庆市医用动物资源开发与利用工程技术研究中心,重庆 402460)
胆汁酸是胆汁的主要功能成分,由肝细胞中的胆固醇合成,储存在胆囊,机体进食后释放到肠道中,由肠道微生物进一步代谢。胆汁酸可促进食物中脂溶性营养物质的吸收,调节许多代谢过程,如葡萄糖、脂质和能量代谢的平衡[1]。目前已建立了肝脏中促进胆汁酸合成的宿主(人类和小鼠)酶和影响宿主胆汁酸总库组成的调节通路[2-3],包括由至少17种不同酶催化的多个反应步骤[4-5]。根据胆汁酸的状态可分为游离型和结合型,游离胆汁酸有CA、DCA等,游离胆汁酸以肽键形式与氨基酸结合,成为结合胆汁酸[6]。根据胆汁酸形成部位的不同,胆汁酸可以分为初级胆汁酸和次级胆汁酸。初级胆汁酸由肝脏合成,释放到肠道中后由肠道微生物将其代谢为次级胆汁酸。胆汁酸既是肠道微生物代谢的底物,又是肠道微生物代谢的产物。肠道微生物对胆汁酸的代谢作用为胆汁酸的多样性提供了重要的贡献,具体的代谢作用有去结合、7α/β-脱羟基化、不同位置羟基的氧化和异构化等,将初级结合胆汁酸代谢为游离次级胆汁酸。肠道微生物对胆汁酸的代谢并不局限于以上所述的去结合、脱羟基、氧化以及异构化反应,还包括一些特征不显著,值得进一步研究的修饰过程。产生的胆汁酸作为肠道微生物和机体相互作用的信号分子,通过胆汁酸受体发出的信号来影响宿主胆汁酸代谢通路[7]。肠道微生物可以通过改变胆汁酸受体FXR等的表达来影响胆汁酸的肝肠循环。例如,胆汁酸肝肠循环中的几种合成限速酶,CYP7A1、CYP7B1和CYP27A1均受到肠道菌群的调节作用[8],影响了胆汁酸的产量[4]。
目前,有关胆汁酸的研究大多集中在小鼠上,但啮齿类动物与人类的胆汁酸构成差异较大,很可能影响胆汁酸受体的信号传导[9]。因此,将小鼠的观察结果发现转化为人类时需要谨慎。相比小鼠,猪在解剖学、遗传学、生理学、免疫学以及大脑发育等各方面与人类更为相似[10-11],并且猪体内甘氨结合型胆汁酸比牛磺结合型胆汁酸多,也与人类相似。因此,猪不仅更适合于模拟人类胆汁酸-肠道微生物-宿主间相互作用,还可以作为研究人类特定代谢疾病的发生或胆汁酸制剂研发的动物模型,获得更可靠的临床前数据。为了最大可能地避免环境微生物对结论可靠性的影响,本实验选择无菌(Germ-free,GF)仔猪作为实验对象,并利用GF猪模型构建构建猪源粪菌移植(Fecal microbiota transplantation,FMT)仔猪模型,在相同隔离饲养管理下,利用液相质谱(LC-MS)与实时荧光定量核酸扩增检测系统(qPCR)分析比较肠道微生物对42日龄GF仔猪和FMT仔猪胆汁酸谱和胆汁酸代谢途径中相关基因的影响。文中涉及到的胆汁酸如表1所示。
1 材料与方法
1.1 材料
GF、FMT猪模型的制备:选择血清检测猪瘟病毒、非洲猪瘟病毒、口蹄疫病毒、猪繁殖与呼吸综合征病毒、乙型脑炎病毒、伪狂犬病病毒、猪圆环病毒2型、猪细小病毒、布鲁氏菌、猪肺炎支原体、猪流感病毒均为阴性、外观无异常、良好饲养管理条件下的妊娠巴马供体母猪(耳号分别为8005、868、748、884,均来自重庆国家现代畜牧业示范区实验用猪工程中心)进行无菌剖腹产术,获得无菌新生仔猪模型(模型确认方法见孙静等[12]的方法执行)。随机选择11头无菌仔猪作为本次实验动物的对象。其中,5头无菌仔猪始终保持无菌状态下饲养(GF组)。剩余6头无菌仔猪在7日龄时,通过口服猪源粪菌悬液,1 mL/d,连续服用3 d,制备成粪菌移植模型(FMT组)。所有动物均始终保持在无菌隔离器内饲养。FMT猪的粪便菌群组成:主要细菌门分类为拟杆菌门(Bacteroidetes,48.69%-77.56%)、厚壁菌门(Firmicutes,18.99%-38.21%)、变形菌门(Proteobacteria,0.93%-15.97%);主要细菌属分类为拟杆菌属(Bacteroides,1.88%-48.64%)、普雷沃氏菌(Prevotellaceae NK3B31 group,0.02%-56.84%)、瘤 胃 球 菌 属(Ruminococcus 2,1.24%-13.04%)(未发表数据)。FMT组仔猪肠道菌群组成与课题组之前的研究相似[13],也与普通猪的肠道菌群组成相似[14],证明FMT组仔猪粪菌移植成功。

表1 文中涉及到的胆汁酸名称
猪源粪菌悬液的制备方法为:动物实验前1个月,对上述4头供体猪完成病原筛查后,清晨时收集其新鲜粪便,4℃无菌采样袋保存,并在超净台内进行粪菌悬液的制备,整个制备过程在样品采集后1 h内完成。粪菌悬液的制备参照孙静等[15]的方法执行。主要操作为:无菌密封匀浆袋内,新鲜粪便和灭菌水按照1∶5的比例,混合均匀,再通过4层灭菌医用纱布过滤,收集获得粪便悬液;粪便悬液和灭菌的甘油按照体积比9∶1混合,粪菌悬液中甘油最终浓度为10%,-20℃保存。在使用当天,放置室温回温,使用前与灭菌奶液按1∶1体积比例混合,通过口服方式转入无菌仔猪体内。
动物饲养:GF猪和FMT猪的获取由子宫剥离器、动物无菌运输器完成,饲养于无菌饲养隔离器内,三类隔离装置均在屏障设施内运行,并严格按照屏障设施的操作规范执行。所有仔猪都给予相同的饲养条件,自由饮水,定量采食,保证两组仔猪采食相似。每12 h光照-黑暗交替一次。0-21日龄期间,所有实验猪饲喂灭菌配方乳(灭菌配方乳与灭菌纯水按1∶4比例混合);22-42日龄期间,所有实验猪饲喂灭菌基础日粮。饲用前,实验猪所有配方乳与饲粮均经真空包装、60Co-γ线源辐照灭菌(剂量20 kGy),经微生物检测无菌后,转入饲养隔离器内使用。实验猪用基础日粮配方由四川农业大学动物营养研究所提供(表2)。饮用水为高温高压处理后的纯水。饮水、配方乳、饲粮标本微生物学检测方法均参考孙静等[12]的方法执行。
屠宰、采样与保存:仔猪通过异氟烷呼吸麻醉放血处死后在超净台内进行采样,确保采样全程无细菌污染。收集肝脏、空肠内容物、新鲜粪便,液氮速冻后存放于-80℃冰箱,用于胆汁酸的测定;收集肝脏、空肠组织,液氮速冻后存放于-80℃冰箱,用于RNA的提取。
实验过程中用到的主要试剂药品:58种胆汁酸标准品均购自Steraloids公司(美国)和TRC公司(加拿大);10种稳定同位素标记标准品购自C/D/N Isotopes公司(加拿大)和Steraloids公司(美国);乙酸铵(AR级,Sigma-Aldrich,美国);甲醇、乙腈、异丙醇、冰醋酸、甲酸均购自Thermo-Fisher(LCMS,美国),超纯水 Mill-Q(Millipore,美国);Trizol(Ambion,美 国);GoScriptTMReverse Transcription System试剂盒(Promega Corporation,美国),SYBR®Premix Ex TaqTM II(Tli RNaseH plus)(TaKaRa,日本)。

表2 基础日粮组成及营养成分
1.2 方法
1.2.1 用LC-MS对胆汁酸进行定量 靶向代谢组由北京诺和致源质谱事业部完成,分为标准品制备、无胆汁酸基质的制备、样品前处理、LC-MS检测等步骤。
1.2.1.1 标准品制备 准确称量68种胆汁酸标准品和同位素标准品适量,甲醇溶解分别配制浓度为0.5 mmol/L的标准品溶液作为贮备液,将58种胆汁酸贮备液混匀稀释系列浓度,在空白基质(不含胆汁酸的血清)中的系列浓度分别为 2 500、500、250、50、10、2.5、1 nmol/L。在空白基质中制备浓度为1 500、150、5 nmol/L的混合标准品作为低、中、高3个浓度的质控样本(QC 样本)。同位素标准品GCA-d4、TCA-d4、TCDCA-d9、UDCA-d4、CA-d4、GCDCA-d4、GDCA-d4、DCA-d4、LCA-d4和β-CA-d5溶液作为内标(IS),浓度为150 nmol/L。
1.2.1.2 样品制备 准确称量10 mg样本,研磨机预冷25 mg beads 和 20 μL超纯水,样本用含有10个内标的180 μL乙腈/甲醇(4∶1)匀浆,13 500 r/min,4℃,离心20 min;去除蛋白沉淀,上清液转移至96孔板中,在冻干仪中冻干。冻干粉末中加入200 μL的复溶剂(乙腈∶甲醇=4∶1),13 500 r/min,4℃,离心20 min;上清转移至 96 孔板中进行 LC-MS分析,进样体积为5 μL。
1.2.1.3 LC-MS色谱条件 保护柱:ACQUITY UPLC Cortecs C18 1.6 μmol/L VanGuard pre-column(2.1×5 mm),色谱柱:ACQUITY UPLC Cortecs C18 1.6 μmol/L analytical column(2.1×100 mm),进样量5 μL,柱温 30℃,流动相:A液-甲酸水(pH3.25),B液-乙腈/甲醇(4∶1),流速0.4 mL/min。
梯度洗脱条件为0-1 min,5% B液;1-3 min,5%-30% B液;3-15 min,30%-100% B液;15-16 min,100%-5% B液;16-17 min,5% B液。
MS条件:电喷雾电离源(ESI),负离子电离模式。离子源温度 150℃,Desolvation Temp(℃):550℃;Desolvation Gas Flow(L/Hr):1 000。采用多重反应监测(MRM)进行扫描。
1.2.2 qPCR检测胆汁酸相关基因的丰度 肝脏和空肠组织样品总RNA的提取按照Trizol试剂盒操作说明进行,提取的总RNA经紫外分光光度计测得A260/A280值在1.8-2.0,且经过1%琼脂糖凝胶电泳检测RNA条带完整,RNA降解少。取适量总RNA,根 据GoScript Reverse Transcription System试剂盒说明逆转录合成cDNA,并以此为模板采用实时荧光定量PCR方法测定各基因mRNA表达水平。扩增程序设计为:95℃预变性 30 s,95℃变性5 s,60℃退火30 s,40个PCR循环。每个样品重复检测3次以减少误差。内参基因GAPDH和各基因的引物序列见表3,引物均由苏州金唯智生物科技有限公司合成。
1.2.3 数据分析 运用 2-ΔΔCt方法计算GF猪和FMT猪各样品中的基因相对表达量。采用SPSS中的Welch’st检验确定GF猪和FMT猪各样品中胆汁酸谱和基因表达差异。实验数据采用x-±SD表示,P<0.05 为差异显著,P<0.01为差异极显著。
2 结果
2.1 GF仔猪和FMT仔猪在相对总胆汁酸水平上的差异
利用LC-MS对同日龄GF仔猪和FMT仔猪肝脏、空肠内容物和粪便中的相对总胆汁酸水平进行分析。结果显示,仔猪相对总胆汁酸水平在组织间存在明显差异(P<0.01),表现为空肠内容物>胆汁酸内容物>粪便。如GF仔猪空肠内容物相对总胆汁酸水平为87.31 mg/±56.72 mg/g,约为肝脏(2.63 mg/±0.10 mg/g)的33倍,约为粪便(0.24 mg/±0.19 mg/g)的365倍。定植肠道微生物后的FMT仔猪粪便中的相对总胆汁酸水平约为GF仔猪的4倍(P<0.01,图1);FMT猪肝脏相对总胆汁酸水平(1.85 mg/±0.52 mg/g)略低于GF仔猪,FMT猪空肠内容物相对总胆汁酸水平(135.50 mg/±63.64 mg/g)略高于GF仔猪,但差异均不显著(P>0.05)。
2.2 肠道微生物对各组织胆汁酸谱的影响
2.2.1 GF仔猪和FMT仔猪肝脏、空肠内容物和粪便中共有胆汁酸的组成和含量比较 GF仔猪和FMT仔猪胆汁酸在肝脏、空肠内容物和粪便中检出的胆汁酸组成完全相同,但含量各异。GF仔猪、FMT仔猪都检出了50种胆汁酸(图2)。其中,在肝脏中检出33种、空肠内容物和新鲜粪便样检出相同的46种,提示肠道微生物的转入与否不改变仔猪体内胆汁酸的种类,但仔猪肠道和粪便中胆汁酸种类高于肝脏组织。此外,结果显示了在仔猪肝脏、空肠内容物和粪便中共有的29种胆汁酸:和GF仔猪相比,18种胆汁酸在FMT仔猪上的相对总水平表现为上调,如GUDCA(增加13.5倍)、GHDCA(增加54.62倍)和GCDCA(增加3.67倍)。11种胆汁酸的含量在FMT仔猪上的相对总水平表现为下调(表4),如TCDCA(减少58.43%)、TωMCA(减少20.55%)和THCA(减少68.92%)。结果提示肠道微生物的转入和定植改变了42日龄仔猪体内多种胆汁酸相对总水平。

表3 扩增基因的引物信息

图1 GF仔猪与FMT仔猪各组织胆汁酸水平
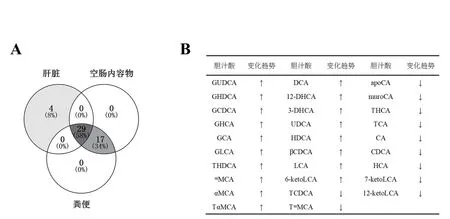
图2 仔猪(GF、FMT组)肝脏、空肠内容物和粪便的胆汁酸种类韦恩分析图
2.2.2 GF仔猪和FMT仔猪肝脏、空肠内容物和粪便中的主要胆汁酸 在GF仔猪和FMT仔猪肝脏、空肠内容物和粪便中分别选取含量最高的10种胆汁酸,分析组织间主要胆汁酸的组成与含量差异。结果显示,不同部位的主要胆汁酸丰都差异较大(图3)。其中,GF仔猪和空肠内容物都以THCA、GHCA为主,THCA在GF猪肝脏中的含量在182.04 μg/g-1 968.00 μg/g之间,占总胆汁酸的34.23%;GHCA在GF猪肝脏中的含量在128.76 μg/g-1 292.30 μg/g之间,占总胆汁酸的33.50%。THCA在GF猪空肠内容物中的含量在558.84 μg/g-88 332.44 μg/g之间,占总胆汁酸的46.77%;GHCA在GF猪空肠内容物中的含量在2 904.47 μg/g-90 813.14 μg/g之间,占总胆汁酸的27.68%。GF猪粪便以CDCA-3Gln、HCA为主,CDCA-3Gln在GF仔猪粪便中的含量在10.14μg/g-297.28 μg/g之间,占总胆汁酸35.32%;HCA在GF仔猪粪便中的含量在0.012 μg/g-256.74 μg/g之间,占28.63%;肝脏和空肠内容物的胆汁酸分布较为相似,而粪便胆汁酸与二者差异较大。

表4 FMT仔猪体内胆汁酸相对总水平的变化
比较GF仔猪和FMT仔猪组织种各胆汁酸水平差异,结果显示:相较于GF仔猪,肠道微生物的定植显著提高了FMT组仔猪肝脏中的GHDC和HDCA水平,分别增加了19.15倍和15.27倍(P<0.05),降低了TCA(P<0.01)、HCA(P<0.05)、TCDCA(P<0.05)和THCA水平(P<0.05,图4-A),分别降低了94.90%、68.70%、82.29%和87.71%。而FMT仔猪空肠内容物各胆汁酸含量与GF仔猪并无显著差异,FMT仔猪空肠内容中 GCDCA、GUDCA和GLCA略高。相较于GF仔猪,FMT仔猪粪便中初级胆汁酸HDCA水平约提高了650.0倍(P<0.05),次级胆汁酸LCA、αMCA和ωMCA水平显著提高(P<0.05),分 别 达 到95.13 μg/g±75.17 μg/g、35.60 μg/g±17.76 μg/g、10.19 μg/g±5.87 μg/g。
2.3 肠道微生物对仔猪肝脏、空肠内容物和粪便中各类型胆汁酸分布的影响
对GF仔猪和FMT仔猪肝脏中都检出的33种胆汁酸进行分析,发现按结构可分为14种结合胆汁酸(8种牛磺结合型和6种甘氨结合型)和19种游离胆汁酸;按其来源可分为14种初级胆汁酸和19种次级胆汁酸。对GF仔猪和FMT仔猪空肠内容物和粪便中共同检出的46种胆汁酸,发现按结构可分为14种结合胆汁酸(其中有8种牛磺结合型胆汁酸和6种甘氨结合型胆汁酸)和32种游离胆汁酸;按其来源可分为12种初级胆汁酸和34种次级胆汁酸。

图3 肝脏、空肠内容物和粪便中含量最高的10种胆汁酸
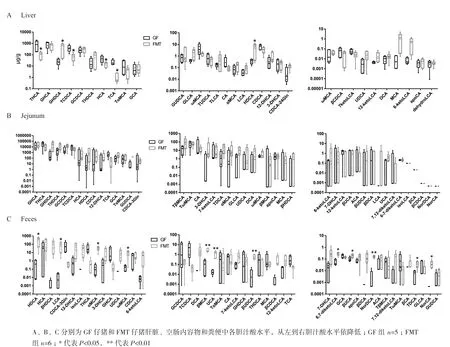
图4 肝脏、空肠内容物和粪便中的各胆汁酸水平
研究发现胆汁酸在仔猪不同组织中呈现差异性应答(图5)。牛磺结合型胆汁酸占总胆汁酸的比例在GF仔猪和FMT仔猪肝脏中分别为48.43%和13.39%(P<0.05);但FMT仔猪肝脏中甘氨酸结合型胆汁酸占总胆汁酸的比例高达84.72%,高于它在GF仔猪中的比例(48.90%,P<0.05)。FMT仔猪空肠内容物中次级胆汁酸占比(17.50%)较GF仔猪空肠内容物次级胆汁酸占比(3.22%)显著增加(P<0.05),增加了约5.4倍。FMT仔猪粪便中初级胆汁酸含量和次级胆汁酸含量分别为0.60 mg/g±0.10 mg/g和0.43 mg/g±0.20 mg/g,高于GF仔猪粪便(0.23 mg/g±0.18 mg/g,0.004 6 mg/g±0.003 5 mg/g),差异达到极显著(P<0.01)。此外,FMT仔猪粪便中次级胆汁酸的占比高达40.07%,约为GF仔猪粪便次级胆汁酸的20.52倍(P<0.01),并以LCA(增加了6 850.7倍,P<0.05)、αMCA(增加了211.92倍,P<0.01)、ωMCA(增加了56.23倍,P<0.01)的变化最为明显(图4)。FMT仔猪粪便中结合型胆汁酸含量为0.002 6 mg/g±0.002 8 mg/g,占总胆汁酸的0.33%,显著低于GF仔猪(0.078 mg/g±0.056 mg/g,占比51.7%,P<0.05)。
2.4 GF仔猪和FMT仔猪胆汁酸肝肠循环相关基因表达水平的差异
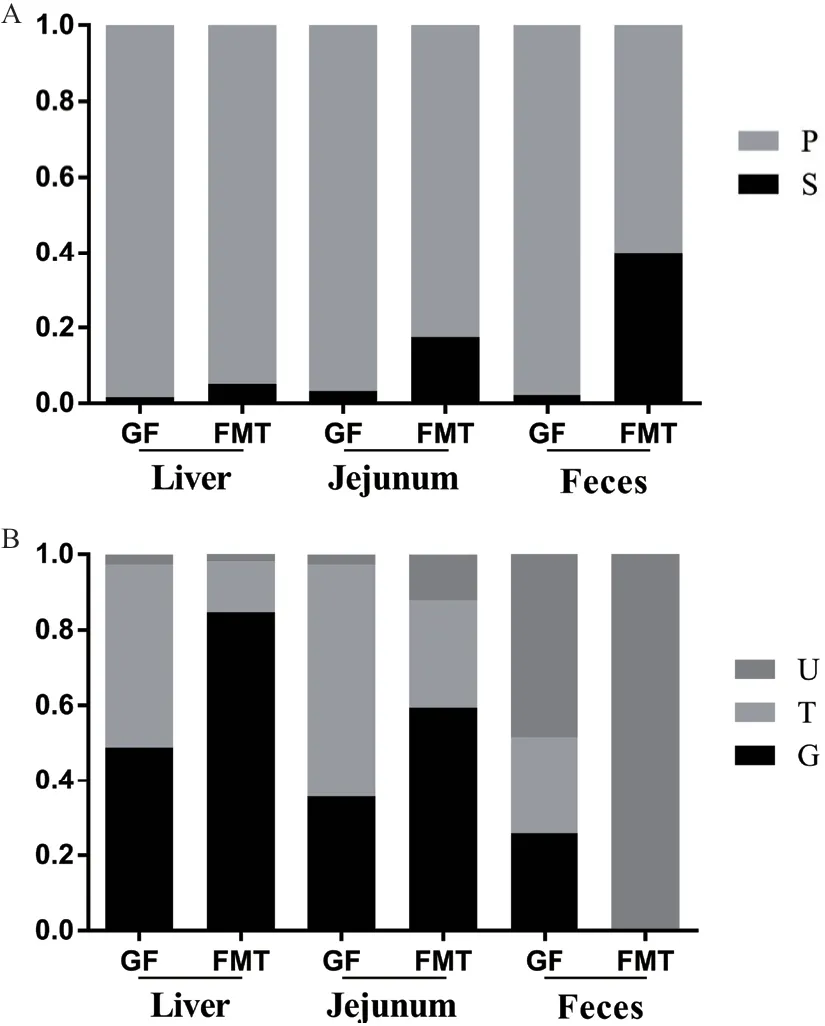
图5 各类型胆汁酸占总胆汁酸的比例
研究利用qPCR技术分析了胆汁酸产生、结合和再吸收有关途径的基因表达情况。FMT仔猪肝脏中胆汁酸合成关键酶:胆固醇7-羟化酶(Cholesterol 7-alpha hydroxy-lase,CYP7A1)基 因 的表达量相比GF仔猪下调(图6),约为GF仔猪的37%(F=0.37±0.17,P<0.05,表5),而肝内细胞色素P450家族成员27A1(Recombinant cytochrome p450 27A1,CYP27A1)并没有受到显著影响。与GF仔猪肝脏相比,FMT组仔猪肝脏中参与胆汁酸结合氨基酸的胆汁酸辅酶α合酶(Bile acid-CoA synthetase,BACS)基因及其上游调节因子肝细胞核因子4(Hepatocyte nuclear factor 4α,HNF4α)的表达量未受影响。同样与胆汁酸结合相关的酶:胆汁酸氨基酸转化酶(Bile acid transporter,BAT)在FMT仔猪肝脏基因表达量下调,仅约为GF仔猪的43%(F=0.43±0.15,P<0.01,表5)。法尼醇X受体(farnesoid X receptor,FXR)在调节胆汁酸合成和体内平衡方面起着关键作用,相比于GF仔猪,FMT仔猪肝脏的FXR表达水平显著降低,为GF仔猪的48%(F=0.48±0.17,P<0.05),但其下游靶点小异二聚体伴侣(Small heterodimer partner,SHP)和肝受体同系物-1(Liver receptor homolog-1,LRH-1)的基因表达未受到影响。同样被视为胆汁酸调节器的G蛋白偶联受体(G protein-coupled receptor for bile acids,TGR5)在FMT仔猪肝脏中基因表达量相比GF仔猪下调,仅为GF仔猪的57%(F=0.57±0.09,P<0.01),而在空肠中基因表达量未见显著差异(P>0.05)。虽然FMT仔猪空肠组织中FXR及其分子靶点成纤维细胞生长因子19(Fibroblast growth factor 19,FGF19)基因表达与GF猪并无显著差异,但FGF19在FMT仔猪肝脏中的受体基因成纤维细胞生长因子受体4(Fibroblast growth factor receptor4,FGFR4)和KLOTHO-β(KLβ)相比GF仔猪均下调,分别为GF仔猪的42%和25%(P<0.01)。与GF仔猪相比,FMT仔猪空肠组织中多耐药相关蛋白-2(Multidrug resistance-associated protein-2,MRP2)基因表达量约为GF仔猪的1.86倍(F=1.86±0.37,P<0.05)。数据结果显示,FMT仔猪空肠组织中钠盐依赖性胆汁酸转运体(Apical sodium-dependent aile acid transporter,ASBT)基因的相对表达量约为GF仔猪的2.38倍,但由于此次试验个体较少,数据变异较大造成差异不显著(P>0.05)。基底侧转运体多药耐药蛋白 3(Multidrug resistance-associated protein 3,MRP3)和回肠胆汁酸结合蛋白(Ileal bile acid binding protein,IBABP)并未受到明显影响。而肝脏中的其他转运蛋白有机溶质转运体(Organic solute transporter α,OSTα)、胆盐排泌泵(Bilesalt excretory pump,BSEP)、牛磺胆酸钠共转运体(Na+/taurocholate cotransporting polypeptide,NTCP)、表达量组间差异不显著(P>0.05)。有机阴离子转运多肽1(Organic anion transporting polypeptides1,OATP1)在FMT仔猪肝脏中的表达量是GF仔猪的4.99倍,但由于数据变异大而差异不显著(P>0.05)。
3 讨论
研究利用靶向代谢组比较了相同隔离环境和饲养管理条件下,42日龄GF仔猪和FMT仔猪肝脏、空肠内容物和粪便中50种胆汁酸的丰度差异特征,其中空肠内容物和粪便中的胆汁酸多样性较肝脏更高。有研究表明,无菌猪可以利用胆固醇来合成HDCA,常规饲养(Conventional,CV)猪可以通过肠道微生物的作用来增加HDCA的水平[20],在本研究中表现为FMT仔猪肝脏HDCA水平较GF仔猪显著升高。CV猪肝脏游离胆汁酸HCA的含量最高[21],而GF猪和FMT猪肝脏中以HCA的结合形式(THCA和GHCA)为主。虽然FMT猪肠道内定植的是猪源性粪便微生物群落,但定植效率、供体猪及菌群的选择、猪种差异、饲养环境等差异,都可能促成它与CV猪在HCA水平上的差异。此外,FMT仔猪空肠内容物和粪便中也发现了少量的isoLCA,它在人体血清和尿液中非常丰富[22]。
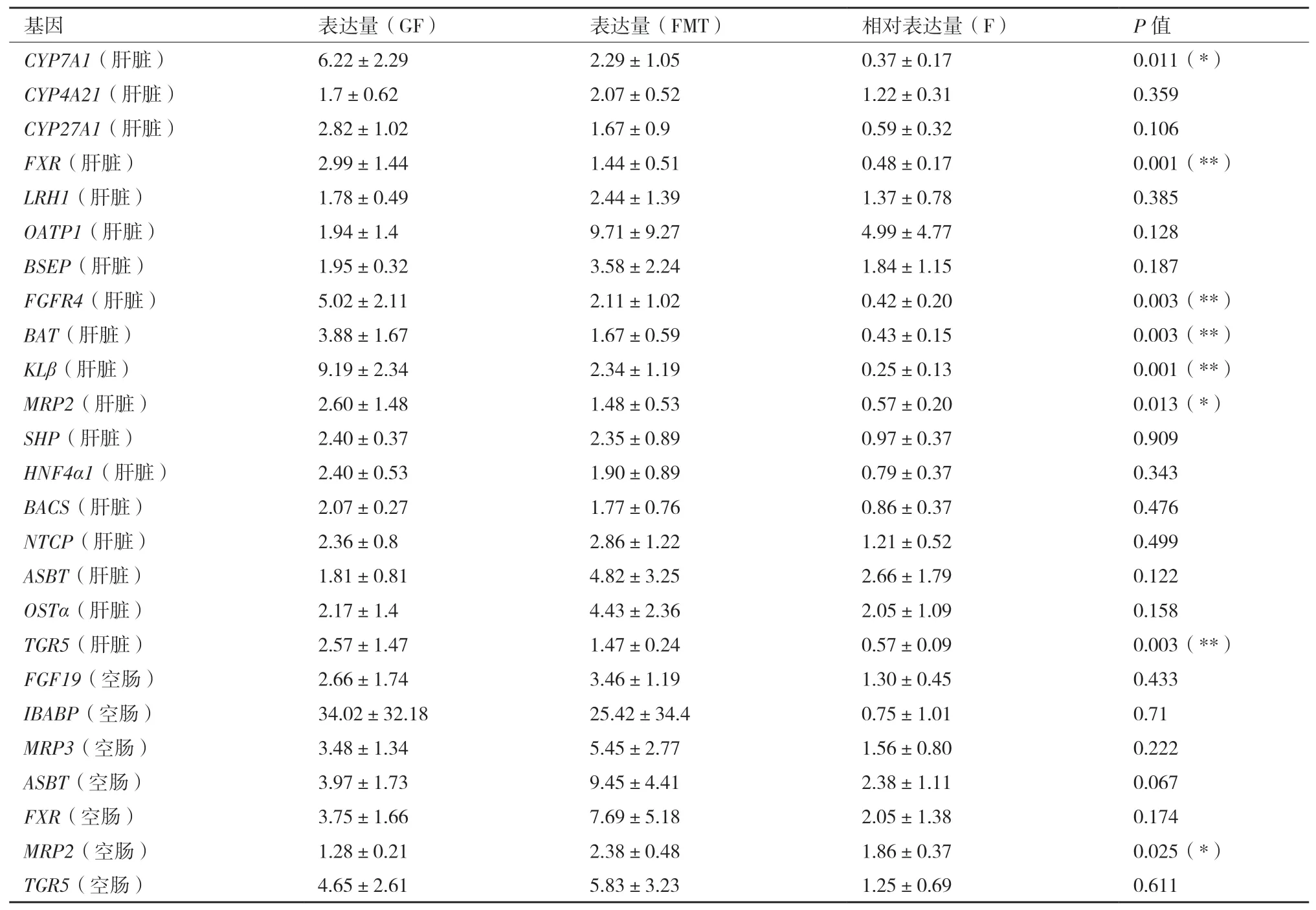
表5 仔猪肝脏与空肠组织中胆汁酸代谢相关基因表达水平
肠道微生物的存在改变了仔猪的肝脏和粪便的胆汁酸谱。HCA是猪肝脏中合成的最丰富的初级胆汁酸之一[21],在GF仔猪肝脏中含量为47.61 μg/g±28.12 μg/g;当肠道内定植微生物后,FMT仔猪肝脏中初级胆汁酸HCA和THCA的含量显著降低,分别降低了68.70%和87.71%,提示胆汁酸的合成可能受到抑制。这一结果与FMT组仔猪中观察到的胆汁酸合成限速酶CYP7A1表达水平降低表现一致。Kwekkeboom等[23]研究发现,生理浓度下的胆汁酸可以通过抑制CYP7A1活性抑制猪肝细胞的胆汁酸合成,特别是猪胆汁中的GCDCA和GHDCA以及它们的游离胆汁酸(CDCA、HDCA)都能够显著抑制CYP7A1的活性。虽然肠道微生物的定植对仔猪肝脏的相对总胆汁酸水平并无显著影响,但FMT仔猪肝脏中的GHDCA、HDCA的水平都较GF仔猪显著增加,这可能是FMT仔猪CYP7A1mRNA表达水平下调的原因。相较于GF仔猪,FMT仔猪粪便中的总胆汁酸水平更高,提示肠道微生物的存在促进FMT组仔猪的胆汁酸排泄,这与小鼠上得到的结果相似[24]。
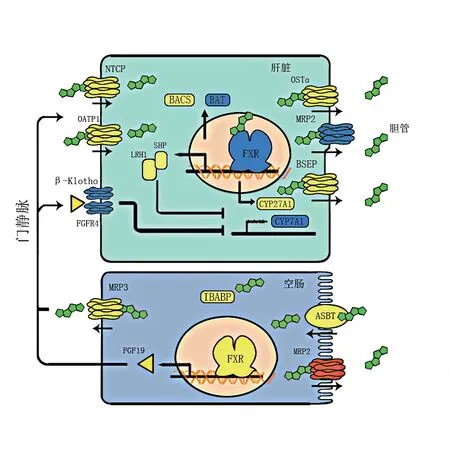
图6 肠道微生物对肝肠循环中胆汁酸代谢相关基因的影响
研究显示,肠道微生物的参与的确提高了仔猪肝脏、肠道内容物以及粪便中次级胆汁酸的占比,表明肠道微生物对次级胆汁酸的产生有极其重要的作用。小鼠体内,95%以上结合型胆汁酸为牛磺结合型胆汁酸,而人胆汁中甘氨酸结合型胆汁酸更为丰富[25]。由于胆汁酸的结合决定了胆汁酸分子的疏水性和对胆汁酸转运体的亲和性,因此其组分的差异可能会导致物种间胆汁酸转运动力学的差异[26]。相比小鼠,猪的胆道中甘氨结合型胆汁酸的占比与人类更加相似[25,27],更适合于模拟人源菌群特征,研究人类胆汁酸-肠道微生物间互作。与普通猪和人类相仿,FMT猪肝脏和空肠中甘氨酸结合型胆汁酸占比更高(分别为84.72%和59.43%),这很可能与仔猪肠道微生物定植相关。同日龄的GF仔猪空肠中甘氨酸结合型胆汁酸比例为35.65%,低于牛磺结合型胆汁酸,这与Haslewood[20]的研究结果相似。此外,肠道菌群的转入与定植导致仔猪粪便样中结合胆汁酸几乎被耗尽,仅为0.27%,这很可能是肠道微生物产生的胆盐水解酶(BSH)的水解作用,去除了甘氨酸和牛磺酸的结合物,生成游离胆汁酸、甘氨酸和牛磺酸[28],后两者对肠道微生物具有营养作用[29-30]。由此可知,肠道微生物产生的BSH对胆汁酸池的进一步修饰是明显的,胆汁酸也对肠道微生物的代谢也发挥了营养作用,二者互相影响,共同调节宿主胆汁酸的代谢。
结果显示,肠道微生物的转入与定植下调了肝脏中胆汁酸产生和转运等相关基因的表达。肝细胞新合成的初级游离胆汁酸通过两步法形成结合型胆汁酸,第一步需要BACS催化,第二步需要BAT,形成结合胆汁酸[31]。肠道微生物的定植下调了FMT仔猪肝脏中BAT基因的表达,导致与FMT仔猪肝脏中牛磺结合型胆汁酸的显著降低。在胆汁酸的代谢网络中,胆汁酸合成酶、胆汁酸转运蛋白等都需要高度协调。FXR是胆汁酸受体,通过SHP实现负反馈,协调胆汁酸的产生与转运,在调节胆汁酸合成与代谢方面起到关键作用[32]。UDCA是有效的FXR抑制剂。相较于GF仔猪,肠道微生物显著降低了FMT仔猪肝脏中FXR表达量,可能与FMT仔猪肝脏中UDCA的提高趋势相关。而空肠FXR表达未受到肠道微生物定植的影响,这与小鼠上的研究结果不同[24],可能是由于肠道微生物对空肠胆汁酸谱影响较小的的原因。上述结果提示,肠道微生物的存在降低了FXR在肝脏中的活性,但对空肠组织影响较小。FMT仔猪肝脏中FXR的下游基因MRP2表达量随FXR的降低而降低,MRP2介导胆汁酸从肝脏转运至胆小管,肠道微生物的定植减少了肝脏中胆汁酸向胆小管的排出。通过比较GF仔猪和FMT仔猪肝脏中的FXR直接靶基因SHP/LRH1和空肠中的直接靶基因FGF19,发现其表达量组间均无显著差异。但FGF19在肝脏的分子靶体(FGFR4/KLβ)在FMT仔猪肝脏表达水平显著低于GF仔猪,分别为GF仔猪的42%和25%。TGR5是胆汁酸的膜受体,与FXR表现一致,在FMT仔猪表现为mRNA水平降低,约为GF仔猪的57%。FMT仔猪和GF仔猪肝脏TGR5的激动剂LCA和DCA[33]的含量组间无明显差异。
Gunness等[34-35]研究发现猪肠道中的胆汁酸最高水平大约处于空肠和回肠的交界处,通过对空肠组织胆汁酸代谢相关基因进行定量。发现肠道微生物的定植显著提高了FMT仔猪空肠组织MRP2的mRNA水平,为GF仔猪的1.86倍。MRP2的上调能够促进胆汁酸进入肠腔,可能与粪便高总胆汁酸水平有关。ASBT是向肠细胞导入胆汁酸的主要转运蛋白,FMT仔猪肠道ASBT表达量上调,为GF仔猪的2.38倍,提示肠道微生物定植后,FMT仔猪空肠细胞胆汁酸的导入能力增加,降低了空肠胆汁酸的净转运。然而,胞质转运蛋白IBABP和基底外侧转运蛋白MRP3基因表达并未受其影响,说明肠道微生物的缺失不影响仔猪空肠-血液中的的胆汁酸交流。
4 结论
通过GF仔猪和FMT仔猪胆汁酸谱和胆汁酸代谢相关基因表达水平上的比较,结果证实了肠道微生物对仔猪胆汁酸代谢有深刻而系统的影响。肠道微生物的转入与定植,不仅在仔猪肠道内发挥作用,也影响了仔猪肝肠系统:肠道微生物的存在增加仔猪的胆汁酸排泄、提高空肠胆汁酸净转运、显著改变了肝脏、空肠和粪便胆汁酸谱与胆汁酸类型。猪的胆汁酸谱明显区别于小鼠,而与人类更相似。物种间胆汁酸谱和胆汁酸代谢相关基因表达水平的差异提示,GF猪适合用于构建人源菌群猪模型,研究人类菌群与胆汁酸的互作关系。
