一种脱氧雪腐镰刀菌烯醇制备工艺的研究
2020-11-02段佳琪李琲琲任杰邱德文李广悦
段佳琪 李琲琲 任杰 邱德文 李广悦
(1. 吉林农业大学生物防治研究所 吉林省资源昆虫产业化工程中心,长春 130118;2. 中国农业科学院植物保护研究所 植物病虫害生物学国家重点实验室,北京 100193)
脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON)是镰刀菌侵染大麦、小麦、玉米等谷物后产生的一种真菌毒素,最早在1970年由诸罔信一等人从感染赤霉病的大麦中分离获得[1]。DON属于单端孢霉烯族毒素,分子式为C15H20O6(图1)[2],能够抑制蛋白质合成[3],具有极强的细胞毒性,是毒性较大的真菌毒素之一,并且能与其他毒素产生毒性增效作用[4-5]。最新的研究表明,长期暴露在低剂量DON下,人和动物会产生慢性不良反应,甚至导致癌症的发生[6-9];而人畜一旦摄入过量的DON污染的食物后,会出现急性中毒症状,严重时甚至造成死亡[10-11]。
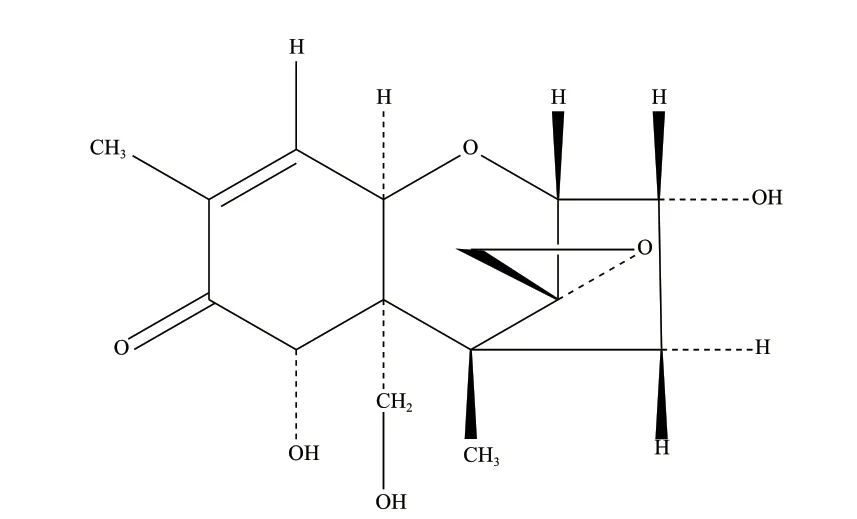
图1 脱氧雪腐镰刀菌烯醇的分子结构
鉴于DON在粮食、饲料和食品中污染的普遍性及其对人畜健康危害的严重性,系统研究DON的致毒机理、检测方法和脱毒方法尤为迫切和重要。获得大量的高纯度的标准品是进行DON相关研究的基础和保障,然而由于DON结构和物化性质的特殊性,其高效的化学合成仍然面临挑战[12],因此目前市售的DON标准品价格昂贵,阻碍了DON相关研究的开展。禾谷镰刀菌发酵结合后续的分离纯化是目前获取大量高纯度DON的最有效的方法,国内外的研究人员对此工艺进行了大量的研究和改进。在培养基的选择上,多使用大米作为产毒培养基,也有利用小麦和玉米作为产毒培养基的报道[13-15];在DON的分离纯化方面,多采用柱层析技术,配合HPLC和高速逆流色谱技术,辅以重结晶的手段,达到分离纯化DON的目的[14-19]。柱层析技术操作繁琐,耗时耗力,对操作人员的要求较高,同时需要大量的有机试剂,成本较高。高速逆流色谱价格昂贵,一般常规实验室无法配备。因此,为了有效推进DON的相关研究,尤其是针对缺乏化学分离经验的实验室,仍需开发一套简便、经济、高效的DON制备方法。
本研究充分利用了DON与其他杂质物化特性的差异,开发了一套简单经济的“抽提-净化-精制-纯化”四步DON纯化制备方法,使用该方法可以从每千克PH-1的大米培养物中获得61.4 mg DON纯品。此外,该方法的优势还在于对于缺乏昂贵实验设备和化学分离经验的实验室,经过精制的DON纯度已经达到80%以上,可以满足常规研究的需求。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 禾谷镰刀菌PH-1由中国农业科学院植物保护研究所张昊老师惠赠;DON标准品:购自青岛普瑞邦生物工程有限公司;大米:购自北京市兴创科源生物技术有限公司;甲醇(分析纯)、乙酸乙酯(分析纯)、石油醚(60-90℃):购自北京市通广精细化工有限公司;乙腈(分析纯)、氯化钠:购自国药集团化学试剂有限公司;甲醇(色谱纯):购自赛默飞世尔科技(中国)有限公司;纯净水:购自杭州娃哈哈基团有限公司;无水硫酸钠:购自生工生物工程(上海)股份有限公司;灭菌袋:购自北京威莱博生物技术有限公司。
1.1.1.1 PDA培养基 称取200.0 g去皮土豆,小块,沸水煮20 min,使用8层纱布滤得滤液,在滤液中加入葡萄糖20.0 g,并使用蒸馏水定容至1 000 mL,搅拌均匀后分装到500 mL锥形瓶中,每个锥形瓶加入200 mL滤液和3.0 g琼脂,121℃灭菌15 min。
1.1.1.2 产毒培养基 大米100.0 g装入灭菌袋中,加入20 mL蒸馏水,充分混匀后使用16层纱布封口以保证透气性,121℃灭菌15 min。
1.1.2 仪器与设备 LD-Y300A高速万能粉碎机:上海顶帅电器有限公司;HPS-200B生化培养箱、DLCJ-2NDI超净工作台:北京东联哈尔仪器制造有限公司;RE-52-3-5旋转蒸发仪:上海青浦沪西仪器厂;水式真空泵:北京中兴伟业仪器有限公司;LTCPS80C立式压力蒸汽灭菌锅:立德泰勀(上海)科学仪器有限公司;DHG-9240A电热恒温鼓风干燥箱:上海一恒科学仪器有限公司;KQ-400DE超声清洗仪:昆山市超声仪器有限公司;高效液相色谱仪Agilent Infinity 1260 HPLC、色谱柱Agilent ZORBAX Eclipse XDB-C18 Semi-Prep(9.4 mm×250 mm,5 μm):美国Agilent公司;色谱柱Waters XBridge C18(4.6 mm× 150 mm,5 μm):美国Waters公司。
1.2 方法
1.2.1 DON检测方法的建立 使用Agilent Infinity 1260 HPLC对DON的含量进行检测。检测条件如下:上样量:20 μL;流动相:水和甲醇(色谱纯)(80∶20,V/V),等度洗脱,使用前过0.2 μm滤膜并超声脱气;流速:0.8 mL/min;色谱柱:Waters XBridge C18 色谱柱(4.6 mm × 150 mm,5 μm);柱温:30℃;检测波长:218 nm。
1.2.2 标准曲线的建立 用纯净水将DON标准品稀释,分别配制浓度为1 mg/L、5 mg/L、10 mg/L、20 mg/L、50 mg/L的DON标准工作液,上机测定,建立DON含量与峰面积的回归方程,绘制标准曲线并计算相关系数。
1.2.3 禾谷镰刀菌PH-1的固态发酵 将禾谷镰刀菌PH-1接种于PDA培养基上,25℃恒温培养箱培养一周左右至菌丝长满平板。使用直径8 mm的打孔器沿菌落边缘打制菌饼,确保菌饼菌丝生长状态一致。将菌饼分别接种至小麦培养基和大米培养基中,每袋培养基接种5个菌饼,揉捏接种菌饼的培养基,使菌丝混匀在培养基中。在25℃的恒温培养箱中培养,每天揉捏培养基,保证培养基松散不结块。每7 d取样一次,监测DON的含量变化。
1.2.4 DON提取剂的选择及DON产量的检测 将样品在60℃的烘箱中烘干,粉碎后过50目筛,分别加入5倍质量体积比的乙腈-水(84∶16,V/V)、甲 醇-水(9∶1,V/V)、甲 醇-水(8∶2,V/V)甲醇-水(7∶3,V/V),置于30℃恒温摇床中,200 r/min振荡24 h。取粗提液过0.22 μm滤膜后进行HPLC检测。
1.2.5 粗毒素的提取 选择培养28 d的样品制备DON,乙腈-水(84∶16,V/V)作为提取剂,提取方法同1.2.4。减压抽滤获得粗提液,将粗提液浓缩至膏状,待下一步分离使用。
1.2.6 粗毒素的净化 (1)使用原粗提液1/10体积的提取剂重新溶解粗毒素并过滤除去不溶性杂质。(2)在滤液中加入等体积石油醚,振荡5 min,静置分层,取下层乙腈-水相,重复操作3次以充分除去脂类物质。(3)在乙腈-水相中加入NaCl至饱和,振荡5 min,静置分层,取上层乙腈相,旋转蒸发去除溶剂,加入等体积乙腈重新溶解,过0.45 μm滤膜除去不溶性杂质;再次旋转蒸发去除溶剂,加入
等体积蒸馏水重新溶解。
1.2.7 DON的精制 (1)水相中加入等体积乙酸乙酯-石油醚(1∶1,V/V),振荡5 min,静置分层,取下层水相,重复操作3次。(2)向水相加入NaCl至饱和,再加入等体积乙酸乙酯,振荡5 min,静置分层,取上层乙酸乙酯相,重复操作3次;合并乙酸乙酯相,旋转蒸发去除溶剂,加入等体积乙酸乙酯重新溶解,过0.45 μm滤膜除去不溶性杂质。再次旋转蒸发去除溶剂,加入1/10体积蒸馏水重新溶解,并过0.22 μm滤膜,待进一步纯化用。
1.2.8 DON的纯化 使用制备型高效液相色谱做进一步纯化,条件如下:流动相∶水和甲醇(色谱纯)(80∶20,V/V),等度洗脱;流速:4 mL/min;色谱柱:Agilent ZORBAX Eclipse XDB-C18色谱柱(9.4 mm ×250 mm,5 μm);柱温:30℃;检测波长:218 nm。合并收集的馏分,旋转蒸发去除溶剂后于-20℃保存。
1.2.9 DON的定量及纯度鉴定 使用HPLC检测纯化产物中DON浓度,同时在200-950 nm的范围内对其进行全波长扫描;将纯化产物旋转蒸发除去溶剂,氘代甲醇重新溶解,1H-NMR检测分子结构,鉴定DON纯度。
2 结果
2.1 DON标准曲线的建立
使用Agilent Infinity 1260 HPLC分别检测浓度为1 mg/L、5 mg/L、10 mg/L、20 mg/L、50 mg/L的DON标准工作液,以DON浓度为横坐标,DON的峰面积为纵坐标,绘制标准曲线,得到回归方程:y= 28.332x - 4.5289,相关系数R2= 0.999 8。此检测方法在1 mg/L-50 mg/L的浓度范围内呈线性关系。
2.2 禾谷镰刀菌PH-1的固态发酵
在固态发酵之前,首先通过预实验测定了大米和小麦两种培养基对DON产量的影响,研究结果表明连续培养14 d后的大米培养基中DON产量和比例均高于小麦培养基,DON产量为41.9 mg/kg,占粗毒素的2.7%。进一步测定了大米培养基中含水量(10%-60%)对DON产量的影响,研究结果表明连续培养14 d后含水量为20%的大米培养基中DON产量最高,为61.2 mg/kg。因此后续实验中,选用含水量20%的大米培养基作为产毒培养基。
为了监测禾谷镰刀菌发酵过程中DON产量的动态变化,在接菌7 d、14 d、21 d、28 d及35 d后取样并测定样品中DON的含量。接种禾谷镰刀菌不同时间后培养物的状态发生了明显的变化,培养基中大米由最初的颗粒状变成了越来越细小的粉末状,同时颜色也越来越深(图 2),说明禾谷镰刀菌能够充分利用大米培养基中的营养进行生长,并在此过程中产生了大量色素。

图2 接种禾谷镰刀菌PH-1的大米培养基在发酵0 d、7 d、14 d、21 d、28 d、35 d后的状态
与培养物状态变化相对应的是DON的含量也发生了明显的变化(图 3),在连续25℃恒温培养的35 d过程中,DON的产量呈现先升后降的趋势,在28 d时达到最高(259.47 mg/kg),因此后续实验选择接种28 d后的产毒培养物进行DON的分离和纯化。至于为何DON的产量呈现先升后降的趋势,推测这与禾谷镰刀菌自身的代谢变化密切相关,但其具体的机制尚待进一步研究。
2.3 DON粗毒素的提取

图3 禾谷镰刀菌PH-1的产毒曲线
为了比较不同提取剂的提取效果,以84%乙腈的提取率为100%,计算不同比例的甲醇-水溶液的提取率,同时对粗提液的峰面积进行归一化处理,计算DON占粗提液的比例(表1)。研究结果表明90%甲醇(图4-C,表1)的DON提取率极低,仅为22.7%,80%甲醇(图4-D)和70%甲醇(图4-E)与84%乙腈(图 4-B)提取效率相当(表1),但是杂质的含量明显增多(表1),给后期的分离纯化工作带来挑战。因此本研究选择了文献中报道最多的84%乙腈作为DON提取剂。
2.4 DON的分离
从图5-A可知,粗毒素中含有大量的杂质,DON含量仅为2.9%(表1)。因此,首先利用石油醚、乙腈以及饱和NaCl溶液三者不互溶的特性,去除一部分杂质,净化粗毒素。图5-B为净化后的粗毒素,与净化前相比杂质的含量降低了一个数量级,4 min、5 min位置附近的杂质更是降低到原来的1%左右;DON的比例上升至20.1%,且总量没有明显的损失。
净化后粗毒素中仍然存在大量杂质,需要再次进行了杂质去除操作。图5-C为再次去除杂质后的色谱图,与图5-B相比,4 min、5 min位置的杂质成功去除,2 min位置杂质减少50%。DON在乙酸乙酯和饱和NaCl溶液中的分配比为3.3∶1,采用乙酸乙酯3次萃取后,2-4 min的杂质几乎都留在水相中(图5-D),DON已经全部转移到有机相(即乙酸乙酯)中(图5-E),经过精制的DON纯度达到81.5%。

表1 不同提取剂提取效果对比
图4 不同溶剂提取液色谱图
图5 不同分离阶段色谱图
2.5 DON的纯化及纯度鉴定
虽然精制后的DON已经去除大部分杂质,但是依旧不能获得DON纯品,利用制备型HPLC进一步纯化,收集馏分获得纯化后的DON。使用分析型HPLC对纯化产物检测,利用软件对产物峰积分,根据标准曲线及回归方程,计算得DON为61.4 mg,即1 kg产毒培养基可获得61.4 mg DON纯品。
对纯化产物进行纯度鉴定,结果如图6-A所示:纯化样品的出峰时间与DON标准品(图4-A)一致;样品DON色谱峰纯度大于99%,全波长扫描显示最大吸收波长在220 nm(图6-B),与DON一致;1H-NMR检测结果为:1H NMR(CD3OD),δ:1.127(s,3H),1.848(s,3H),1.842(t,1H),2.442(dd,1H),3.069(dd,2H),3.542(d,2H),3.685(dd,2H),4.357(m,1H),4.814(s,1H),4.954(d,1H),6.608(dd,1H)。HPLC与1H-NMR结果证明获得的是DON纯品。
图6 纯化产物纯度分析
3 讨论
近年来,随着全球环境的恶化,气候异常导致的病害大爆发时常发生,我国部分地区小麦赤霉病呈逐年上升趋势[20-21]。赤霉病不仅会导致小麦产量降低,还会产生大量的DON,导致小麦品质下降甚至不能作为食物或者饲料使用,造成严重损失[22]。DON能够破坏细胞的膜结构、影响线粒体功能以及抑制蛋白质的合成[23];若长期暴露在低剂量DON环境中,能够引起胚胎发育缺陷以及畸形发育[24];若人、畜、禽等误食DON,轻则会产生恶心、呕吐等不良反应,重则中毒死亡[25]。为了获得大量高纯度的DON用于科学研究,国内外科研团队进行了大量探索,希望开发一种经济高效的DON的制备方法。
目前,DON主要通过禾谷镰刀菌发酵产生,小麦、大米、玉米是最常用的产毒培养基。陆鸣等[13]测试了不同培养基对DON产量的影响,研究结果表明小麦培养基产毒最高;玉米次之;大米最低,但是就DON在粗毒素中的比例而言,大米最高;小麦次之。本研究测试了禾谷镰刀菌在小麦培养基和大米培养基中发酵的DON产量情况,结果与陆鸣的研究结果有出入,可能是菌种差别的原因。徐得月等[26]预测水分和培养时间为产毒的关键影响因子,但是文献中对于产毒培养基中水分的描述并不明确,本研究测试培养基含水量对DON产量的影响以及DON产量随时间的变化情况,研究结果表明禾谷镰刀菌PH-1接种到含水量20%的大米培养基中,培养28 d时DON产量最高。
在DON的分离纯化方面,洪淑娟等[27]使用甲醇作为粗毒素提取剂,利用高速逆流色谱纯化DON,从300 g大米培养基中仅得到8 mg DON,纯度97.7%。该方法虽然简单,但是提取纯化效率低。Clifford[16]使用70%甲醇作为粗毒素提取剂采用硅胶柱层析的方法,使用正己烷-丙酮系统梯度洗脱,并经过结晶和重结晶,最终获得DON纯度>99%。Zhao等[15]使用84%乙腈作为粗毒素提取剂,采用两次硅胶柱层析和HPLC纯化的方法,该方法操作繁琐,对实验人员的技术要求较高。姜云晶等[14]使用两次硅胶柱层析和重结晶的方法,存在的问题和Zhao等[15]类似。郭文博等[19]利用自制前处理净化小柱除杂,制备液相纯化DON的方法。前处理净化小柱相对于硅胶柱,技术门槛更高,而且更适合应用于DON的分析检测。
无论是使用高速逆流色谱、高效液相色谱,还是重结晶的方法纯化DON,其样品的前处理工作大多采用柱层析的方法除去多余的杂质,净化DON。根据DON的理化特性,本研究探索了DON在不同混合溶剂中的分配比例,研究结果表明DON在等体积乙腈和饱和NaCl溶液中分配比接近1∶1,在等体积乙酸乙酯和水中分配比接近0∶1。基于以上研究结果,本研究使用经典方式净化DON粗毒素后,加入“精制”这一过程,用以替代其他研究者报道的硅胶柱层析步骤。精制后的DON纯度达到80%以上,这已经能够满足常规研究的需求,例如DON降解菌的初步筛选等。在使用HPLC做最后纯化时,较高纯度的DON可以有效提高纯化效率,降低的色谱柱的损耗,降低分离纯化的成本。
4 结论
本研究以大米作为产毒培养基,采用液液萃取分离结合HPLC纯化的方法,建立了一套从DON发酵、分离到纯化的系统方法,利用该方法从每千克大米培养物中获得61.4 mg DON纯品。
