不同果肉质地枇杷果实发育过程中果胶代谢及相关基因表达分析
2020-10-31高欢欢牛先前杨桂平郑国华
高欢欢,牛先前,杨桂平,郭 傲,陈 旭,郑国华
(1.福建农林大学园艺学院,福建 福州 350002;2.福建农林大学园艺产品贮运保鲜研究所,福建 福州 350002;3.福建省热带作物科学研究所,福建 漳州 363001)
0 引言
【研究意义】枇杷(Eriobotrya japonica Lindl.)是蔷薇科(Rosaceae Juss)枇杷属(Eriobotrya Lindl.)常绿果树,枇杷果实在春天至初夏成熟,比其他水果都早,因此称之为“南方早春第一佳果”。但不同类型枇杷果实品质参差不齐,白肉枇杷果肉质地鲜嫩细腻,鲜食口感好;红肉枇杷果肉质地较为粗糙、化渣性略差,但较白肉品种耐贮藏。果肉质地的变化与果胶物质的合成与降解密不可分[1],从果胶代谢角度探索不同品种枇杷果肉质地差异机理,对枇杷果肉品质改良、栽培选育等具有重要意义。【前人研究进展】果实的成熟软化往往伴随果胶降解酶的参与,使原果胶溶解为可溶性果胶,进而参与果实软化过程[2-3]。酶的活性受到相关基因的调控,是基因活化表达的结果[4],近年来,果胶代谢相关酶的基因已陆续被克隆和功能鉴定[5-7]。目前关于枇杷果实品质多集中于风味、色泽、营养成分的研究[8-10],枇杷果实质地软化机制与果胶代谢方面的研究远不及对其他果树研究。【本研究切入点】白肉枇杷与红肉枇杷果肉质地差异较大,是探索枇杷果实成熟软化与果胶代谢关系的理想材料,且关于这两类枇杷果肉质地发育与果胶降解差异的研究较少,分子层面研究鲜见报道。【拟解决的关键问题】本研究以东湖早、早钟6 号两个红肉枇杷品种和贵妃、白梨两个白肉枇杷品种不同发育时期的果实为试材,比较果实果胶含量、果胶降解酶活性变化以及相关基因表达的动态规律,为枇杷品质改良、栽培选育提供参考。
1 材料与方法
1.1 试验材料
试材为枇杷红肉品种早钟6 号、东湖早及白肉品种白梨、贵妃不同发育期的果实,采自福建莆田市枇杷栽培示范基地。每个品种选取立地条件、生长势、管理水平一致的枇杷树各3 株,按物候期自谢花后75 d 进行第一次采样,每隔10 d 采样一次,直至果实成熟,共采样5 次。每品种摘取大小一致、无病虫害的果实30 个,采样当天运回实验室,进行硬度测定后,去皮去核,果肉切块混匀,装于锡箔纸中液氮速冻后于-80℃冰箱保存留样做后续试验。
1.2 试验方法
1.2.1 果实硬度测定 每品种取10 个枇杷果实,去皮后选取赤道部3 个点,采用GY-4 数显水果硬度计测定果肉硬度,取平均值,结果以kg·cm-2表示。
1.2.2 不同形态果胶含量的测定 参照Fishman 等[11]和Brummell 等[12]的方法,依次得到水溶性果胶(Water soluble pectin, WSP)、离子结合型果胶(Ionic soluble pectin, ISP)、共价结合型果胶(Covalent soluble pectin,CSP),咔唑比色法测定果胶含量,用D-半乳糖醛酸标准品制作标准曲线。
1.2.3 酶活性的测定 果胶甲酯酶(Pectin methylesterase, PME)活性参照Lin 等[13]的方法,以果胶为底物,37 ℃反应1 h,期间用0.05 mol·L-1NaOH 滴定,维持pH7.2,以每小时每g 鲜样消耗1 umol·L-1NaOH 的酶用量为1 个酶活力单位(U)。多聚半乳糖醛酸酶(Polygalacturonase, PG)活性参照叶玉平[14]、董黎梨[15]的方法,略加改动,用透析法提取粗酶液,以40 ℃下每克果实每小时催化释放1 mg D-半乳糖醛酸定义为1 个酶活力单位(U);β-半乳糖苷酶(Beta-galactosidase, β-Gal)活性参照Basanta[16]的方法,以对硝基苯-β-D-吡喃半乳糖为底物,37 ℃反应2 h,于405 nm 波长下测定吸光值,以每克果实每小时催化释放1 μmol 4-硝基苯酚定义为1 个酶活力单位(U)。
1.2.4 相关基因实时荧光定量分析 从课题组所测枇杷果实转录组数据(未公开)中选取所需基因序列,采用Beacon Designer 7 软件对相关基因设计特异性引物(表1),测定果胶甲酯酶(Pectin methylesterase, PME)、多聚半乳糖醛酸酶(Polygalacturonase,PG)、果胶裂解酶(Pectate lyase, PL)、β-半乳糖苷酶(Beta-galactosidase, β-Gal)基因表达量。实时荧光定量反应体系按照TaKaRa 公司的TBGreen TM Premix Ex Taq TM 试剂盒说明书操作。使用Jena qTOWER2.2荧光定量仪检测,设置3 个生物重复,3 个技术重复。以Actin 作为内参基因,用2-ΔΔCT进行数据分析,对不同品种果胶代谢相关基因的表达量进行相对定量分析。

表1 枇杷果实细胞壁相关酶基因qPCR 引物扩增序列Table 1 Primers for qPCR amplification on genes related to enzymes associated with loquat cell wall
1.3 数据分析
利用Excel 2019 和SPSS 19.0 进行数据统计和差异性分析。
2 结果与分析
2.1 不同果肉质地枇杷果实发育期硬度的变化
图1 表明,4 个品种枇杷果实硬度随生长发育均呈下降趋势。谢花后75 d,东湖早与贵妃枇杷果实硬度均显著高于早钟6 号与白梨,而早钟6 号与白梨枇杷果实硬度二者无显著差异。谢花后95~115 d,枇杷果实硬度下降速率增大,且贵妃、白梨2 个白肉品种果实硬度均显著低于另外2 个红肉品种。随着果实成熟越高,白肉枇杷与红肉枇杷的果实硬度差异越为明显,即白肉枇杷硬度显著小于红肉枇杷品种,且白梨的果实硬度最小,均低于其他3 个枇杷品种,其硬度为0.464 kg·cm-2。

图1 枇杷果实发育期硬度的变化Fig.1 Changes in firmness of loquat during fruit development
2.2 不同果肉质地枇杷果实发育期果胶含量的变化
从图2-A 可以看出,东湖早和早钟6 号2 个红肉品种果实水溶性果胶(WSP)含量随果实生长发育表现出逐渐增加的规律;贵妃与白梨的WSP 含量在果实发育前期均先减少后快速增加。自谢花后95 d起,白肉枇杷果实WSP 含量上升幅度明显大于红肉品种,至果实成熟后期(谢花后115 d),4 个枇杷品种果实WSP 含量存在显著差异,且白肉品种的WSP 含量显著高于红肉品种,约为红肉品种的1.4倍。果实成熟时WSP 含量的快速增加使果肉软化,这可能是造成白肉枇杷果肉质地细腻的因素。
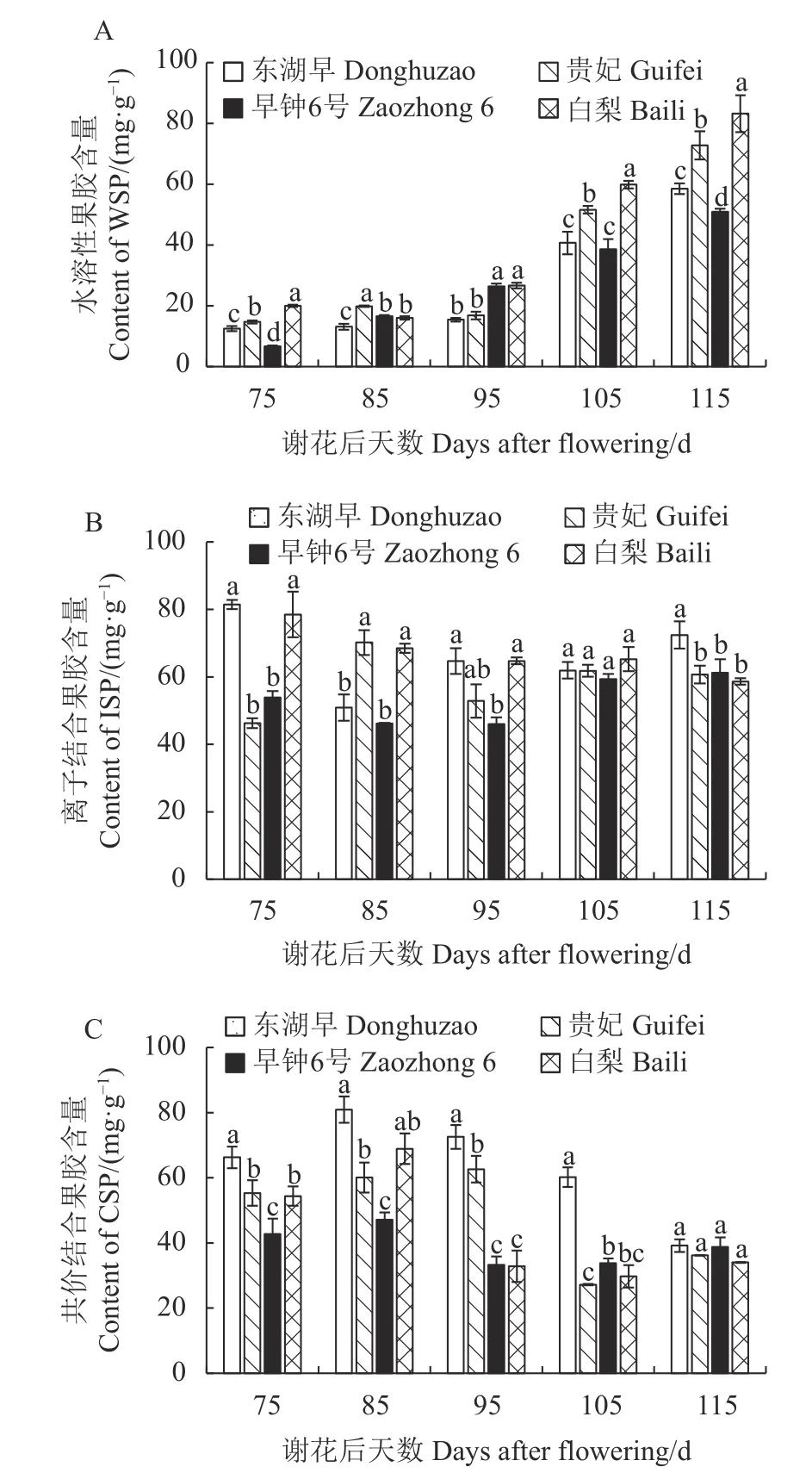
图2 枇杷果实发育期果胶含量的变化Fig.2 Changes in pectin content of loquat during fruit development
由图2-B 可见,4 个枇杷品种间离子结合果胶(ISP)含量呈现无规律的变化趋势。果实发育早期(谢花后75 d),东湖早和白梨果实ISP 含量显著高于另外两个品种,至果实成熟后期含量有所下降;谢花后115 d,东湖早果实ISP 含量显著高于另外3 个品种,且另外3 个品种间含量差异不显著。
图2-C 表明,4 个品种果实共价结合果胶(CSP)含量在发育过程中大体上均表现出先增加后减少的动态规律。谢花后85~95 d,白梨果实CSP 含量快速下降,使CSP 转化为WSP,加快果实软化进程;谢花后95~105 d,贵妃果实CSP 含量也出现大幅减少的现象;谢花后115 d,红肉枇杷果实CSP 含量高于白肉枇杷,但品种间无显著差异。
果实质地与水溶性果胶与共价结合果胶的比值(WSP/CSP)密切相关,比值增大反映出CSP 含量的降低且伴随着WSP 含量的升高,果实质地变软。如图3 所示,4 个品种果实WSP/CSP 的比值在果实发育前期较低,谢花后115 d,比值快速上升,贵妃、白梨果实WSP/CSP 的比值显著高于东湖早与早钟6 号,其中白梨果实WSP/CSP 的比值最高达2.45,分别是东湖早与早钟6 号果实的1.6 及1.9 倍。表明不同类型枇杷果实质地与果胶形态的转化关系密切。
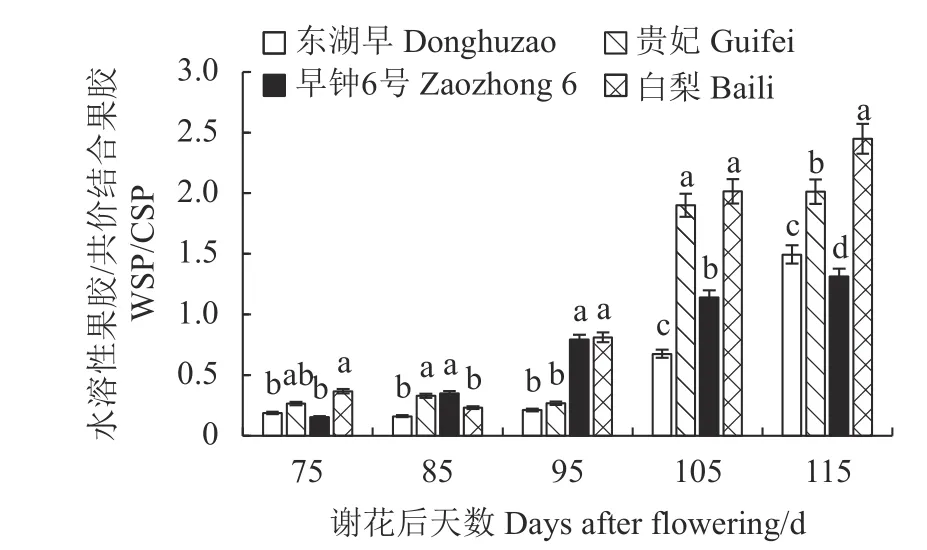
图3 枇杷果实发育期WSP/CSP 的比值变化Fig.3 Changes in WSP/CSP ratio of loquat during fruit development
2.3 不同果肉质地枇杷果实发育期果胶代谢相关酶活性的变化
2.3.1 不同果肉质地枇杷果实发育期PME 活性的变化 图4 表明,4 个品种果肉的PME 活性随果实生长发育先升高后降低。谢花后85~95 d,白梨PME活性迅速上升,而东湖早、贵妃、早钟6 号PME 活性则是在谢花后95~105 d 迅速上升;谢花后115 d,4 个品种枇杷果肉PME 活性均降低,且4 个品种无显著差异。白梨PME 活性较其他3 个品种提前迅速升高,可能导致白梨果肉提前进入软化期,使其质地发生变化。
2.3.2 不同果肉质地枇杷果实发育期PG 活性的变化 图5 表明,随着枇杷果实的发育,PG 活性大体上逐渐上升,增长速率呈现“慢-快-慢”的规律。谢花后75~85 d,PG 活性保持较低水平,东湖早、早钟6 号和贵妃枇杷果肉PG 活性无显著差异,而白梨果肉PG 活性显著高于另外3 个品种;谢花后95~115 d,4 个品种枇杷果肉PG 活性差异显著,其中白梨枇杷果肉PG 表现出最高活性为13.5 U,东湖早活性最低为9.0 U,且均表现出白肉品种PG 活性高于红肉品种的趋势。
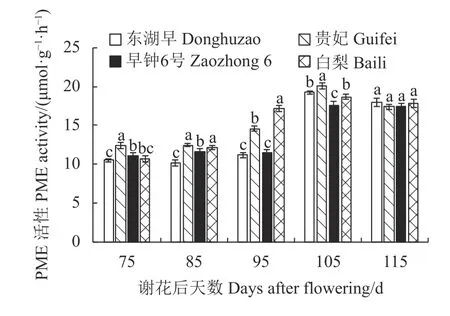
图4 枇杷果实发育期PME 活性的变化Fig.4 Changes in PME activity of loquat during fruit development

图5 枇杷果实发育期多PG 活性的变化Fig.5 Changes in PG activity of loquat during fruit development
2.3.3 不同果肉质地枇杷果实发育期β-Gal 活性的变化 图6 表明,β-Gal 活性的动态变化因枇杷品种而异:东湖早和贵妃果肉β-Gal 活性随生长发育呈现出“先缓慢上升——再迅速上升——后缓慢下降”的变化规律;早钟6 号β-Gal 活性的动态变化为“缓慢下降-迅速上升-下降”;白梨β-Gal 活性的动态变化为“缓慢下降-迅速上升-上升”。4 个品种枇杷果肉β-Gal 活性在果实发育前期(谢花后75~85 d)保持较低水平;谢花后105~115 d,2 个白肉品种果肉β-Gal 活性均显著高于另外2 个红肉品种,且在谢花后115 d,白梨β-Gal 活性显著高于其他3 个枇杷品种,分别为东湖早、早钟6 号和贵妃枇杷活性的1.7、1.8 及1.3 倍。
2.4 枇杷果实硬度、不同形态果胶与相关酶活性的相关性分析
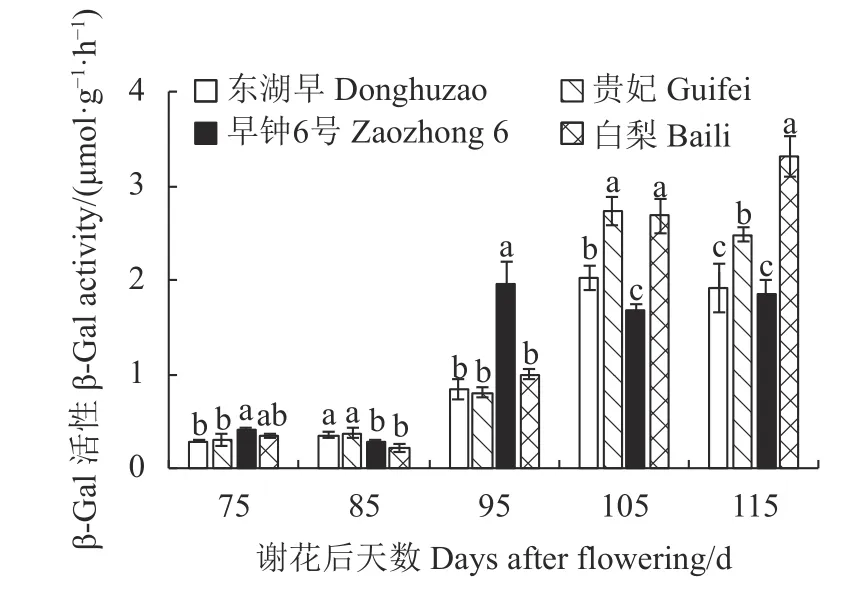
图6 枇杷果实发育期β-Gal 活性的变化Fig.6 Changes in β-Gal activity of loquat during fruit development
为探索不同品种枇杷果肉质地与果胶代谢生理指标相关性的一般规律,将红肉品种东湖早、早钟6 号及白肉品种贵妃、白梨两类果实发育过程中的硬度与不同形态果胶、果胶代谢相关酶活性进行相关性分析(见表2)。
枇杷果实硬度、不同形态果胶及相关酶活性三者之间存在一定的相关关系,但因品种不同其相关性存在差异。枇杷果实硬度与WSP、PME、PG、β-Gal 存在极显著负相关关系,但果实硬度与CSP 在白肉品种中极显著正相关(r=0.739**),在红肉品种中相关性不显著。果实WSP 与PME、PG、β-Gal均存在极显著正相关关系,ISP 与各生理指标相关性均不显著,果肉CSP 与PG、β-Gal 存在显著或极显著负相关关系,而CSP 与PME 在白肉品种中极显著负相关(r=-0.841**),在红肉品种中负相关性不显著。

表2 枇杷果实硬度、不同形态果胶与相关酶活性的相关性分析Table 2 Correlation between firmness, forms of pectin and related enzyme activities of loquat fruit
2.5 不同果肉质地枇杷果实发育期果胶代谢相关基因的表达
2.5.1 不同果肉质地枇杷果实发育期PME、PL 基因的表达 如图7-A 可知,贵妃和早钟6 号PME 基因相对表达量的变化规律基本一致,先上升后下降,但二者不在同一时期达到最大表达量,分别在谢花后95 d 和谢花后85 d 达到最大表达水平;东湖早PME 基因相对表达量随生长发育先升高再降低,后期又略微回升;白梨则呈现先降低后升高再降低的波动变化。总体而言,东湖早PME 基因总的相对表达量显著高于其余3 个品种。
如图7-B 可见,4 个品种枇杷果肉的PL 相对表达量在果实生长发育期的变化趋势总体上一致,均是先上升后下降,但白梨的PL 相对表达量在果实成熟后期(谢花后115 d)又出现上升现象。谢花后85~105 d,贵妃PL 基因相对表达量均处于最高水平,使其在生长发育过程中提前进行果胶质的降解,为后期果实软化做铺垫;谢花后115 d,白梨PL 基因相对表达量的升高,使果胶物质降解加速,加速果肉质地变软。
2.5.2 不同果肉质地枇杷果实发育期PG、β-Gal 基因的表达 由图8-A 可知,4 个品种枇杷果肉PG 基因表达量均呈先上升后下降的动态变化,东湖早、贵妃、白梨果肉PG 基因相对表达量在花后105 d 达到最大值,早钟6 号PG 基因相对表达量在花后95 d 达到最大值。花后85 d 至果实成熟,贵妃枇杷果肉的PG 活性均高于另外3 个品种,花后105~115 d,2 个白肉品种PG 基因表达量显著高于2 个红肉品种。
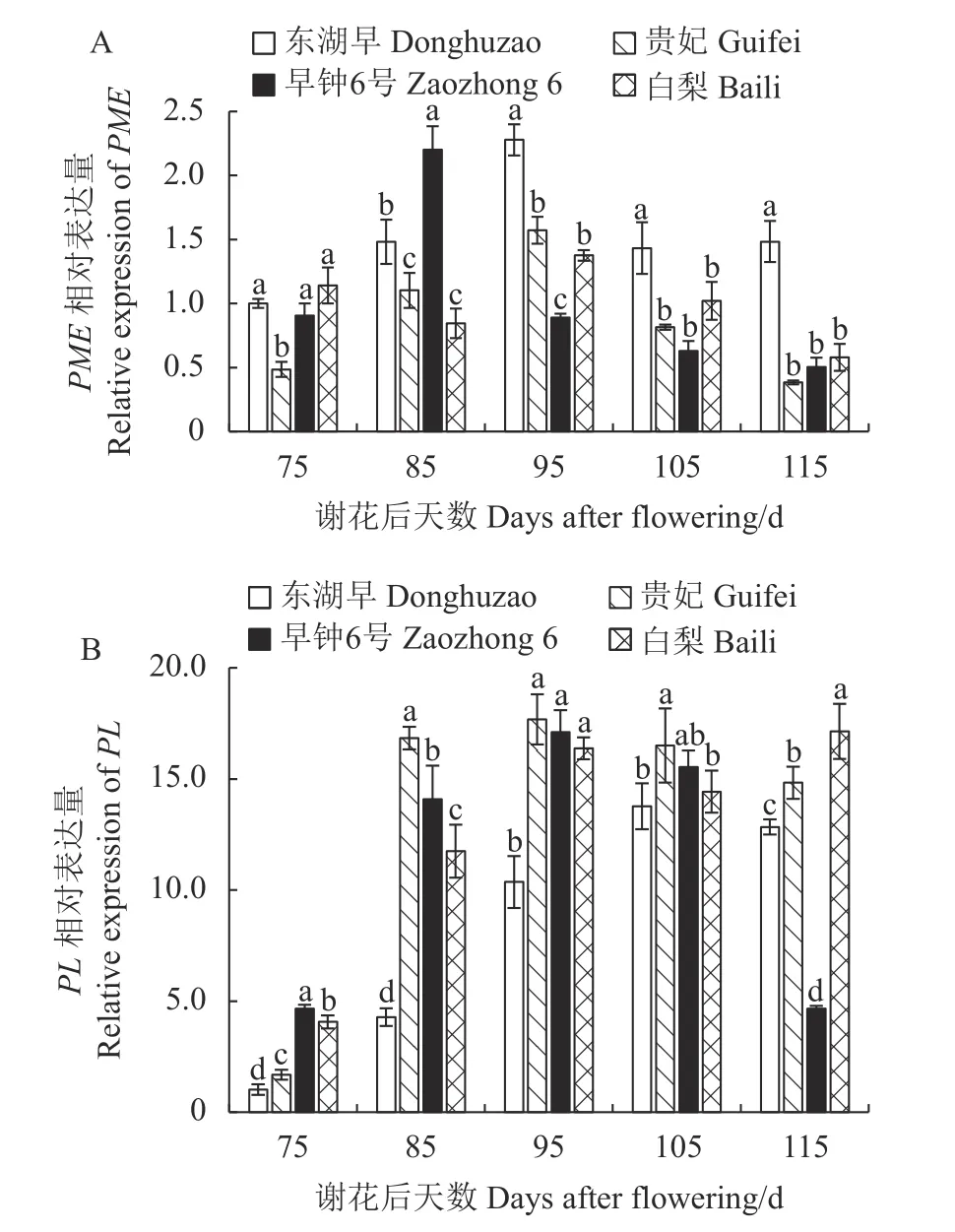
图7 枇杷果实发育期PME 和PL 基因表达的变化Fig.7 Changes in PME and PL expressions of loquat during fruit development
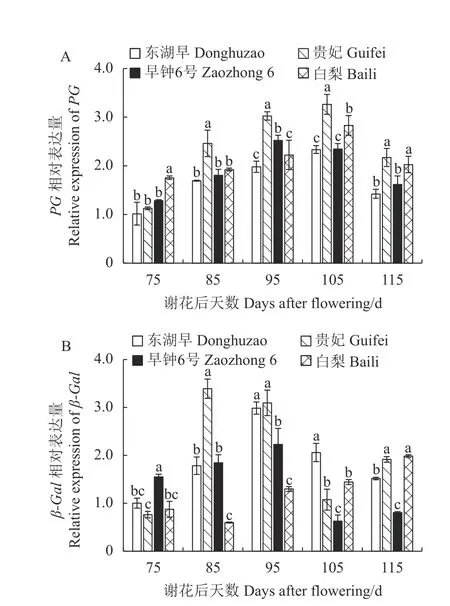
图8 枇杷果实发育期PG 和β-Gal 基因表达的变化Fig.8 Changes in PG and β-Gal expressions of loquat during fruit development
如图8-B 所示,贵妃和早钟6 号β-Gal 基因相对表达量的动态变化基本一致,先增多后减少至果实成熟后期又略有增加,贵妃果肉β-Gal 基因总表达量高于早钟6 号;东湖早β-Gal 基因相对表达量先增加后减少,而白梨与之相反,呈现先减少后增加的变化。谢花后115 d,贵妃白梨果实β-Gal 基因相对表达量显著高于另外2 个枇杷品种。
3 讨论
果胶是植物细胞壁初生壁与中胶层的主要成分,是维持细胞壁机械强度与物理强度的关键因素之一[17]。霍宏亮等[18]研究发现,秋子梨WSP 随果实成熟软化进程逐渐增加,且与果实硬度负相关性达极显著,本试验研究也得到了基本一致结果。本试验与许多研究均表明[19-21],果实WSP 含量的升高,CSP 含量的下降是促使果肉质地变软的重要条件。本研究结果表明,随着枇杷果实发育成熟,白肉枇杷与红肉枇杷的WSP 逐渐增加均与果实硬度存在极显著负相关关系,白肉品种贵妃、白梨果实WSP 上升幅度大且在成熟后期显著高于红肉品种,这可能是造成白肉枇杷果肉细腻、质地较软的因素之一。4 个品种果实CSP 含量在整个发育阶段中整体表现出先增加后减少的动态变化,果实成熟后期,红肉品种CSP 含量高于白肉品种,但差异不显著,这就是东湖早、早钟6 号比白肉品种耐贮运的原因。本试验相关性显示,白肉枇杷果实硬度与WSP 含量之间负相关性达极显著水平,与CSP 含量之间的正相关性也是极显著,但与ISP 含量的相关性较小,由此可见,WSP 的增加及CSP 含量的降低与枇杷果实质地的形成密不可分,而ISP 含量对枇杷果实质地影响较小、甚至没有影响。本研究用WSP/CSP 的比值来表述枇杷果实质地相关性指标,比上述3 个单一指标更能说明果实质地关键因子,在本研究中,谢花后110~115 d,贵妃、白梨果实WSP/CSP 的比值显著高于东湖早与早钟6 号,比值升高通常伴随着果肉质地的软化,这也验证了枇杷果肉质地的差异与细胞壁中果胶存在的形式及比值有很大关系。
迄今为止已在果实中发现多种果胶降解酶,其中最为关键的是果胶酯酶(PME)、多聚半乳糖醛酸酶(PG)、β-半乳糖苷酶(β-Gal)[22]。研究发现[23-25],不同树种或品种的果胶降解相关酶的活性差异很大,这表明果胶降解酶在果实软化方面发挥的作用具有树种或品种的特异性。高利平等[26]研究发现在苹果果实发育进程中,绵肉品种苹果的PME 活性一直高于脆肉品种,PME 可能是导致苹果质地发绵的关键酶。本研究结果中,4 个品种枇杷果实PME 活性均逐渐上升,至谢花后115 d 表现出略微降低的变化,白梨果实PME 活性较另外3 个品种提前快速上升可能会导致其提前进入软化期,果肉质地发生改变。齐秀东等[27]的研究表明PG 导致的果胶多糖解聚的可能是造成不同品种梨果实质地差异的关键因素。本研究枇杷果实PG 活性随生长发育逐渐上升,与果实发育进程中质地变化相吻合,β-Gal 活性动态变化趋势因枇杷品种而异,但整体上果实成熟后期β-Gal 活性上升,且在谢花后105~115 d,均表现出白肉品种果实的PG 与β-Gal 活性显著高于红肉品种的现象,这与杨国慧与庄军平等[28-29]在树莓和香蕉上的相关研究结果相似,同时表明这2 种酶均参与了果实细胞壁果胶物质的降解过程,但发挥的作用不尽相同。果实成熟后期,白肉枇杷果实PG 活性、β-Gal 活性显著高于红肉枇杷,但PME 活性在4 个品种间无显著差异,表明果实成熟后期PG 活性、β-Gal活性差异是造成红肉枇杷与白肉枇杷的关键因素之一。
邓佳等[30]研究发现随着葡萄柚果实后熟软化,与果胶物质降解有关的PG 和PME 基因表达量均随果实软化呈不同程度增加。周敏等[31]认为,PL 基因是调控果实软化的重要靶点。本研究中PME、PL、PG 基因相对表达量的变化趋势因枇杷品种而异,但总体上,PME 与PG 基因相对表达量在果实发育前期维持较高水平,PL 基因相对表达量则在果实发育后期较高,这也说明了这3 个基因作用于果胶物质存在时间上的差异。虽然本研究中在果实发育后期,东湖早枇杷果肉PME 基因表达量显著高于另外3 个品种,但是在谢花后105~115 d,东湖早及早钟6 号果肉WSP 含量显著低于贵妃及白梨这2 个白肉品种枇杷,可以推断PME 基因并不是导致红肉枇杷与白肉枇杷果肉质地差异的关键基因。随果实生长发育PL 基因表达量变化与枇杷果肉质地变化进程一致,且在谢花后115 d,白梨PL 基因在谢花后115 d的上调表达,对果胶的降解起调控作用,使果肉迅速软化,而早钟6 号PL 基因下调表达,这可能是造成二者果肉质地差异的关键。枇杷果实成熟后期,白肉枇杷PG 与PL 基因表达量显著高于红肉枇杷,加快果胶降解,与白肉枇杷果实成熟后期果肉快速软化有关。周厚成等[32]从草莓果实中分离出的新基因FaT β-gal,在果实软化中发挥重要作用。本研究结果中,谢花后105~115 d,贵妃和白梨果实β-Gal 基因均上调表达,东湖早与早钟6 号β-Gal 基因表达量出现下调现象,且白肉枇杷果实β-Gal 基因相对表达量显著高于红肉枇杷,是白肉品种果肉质地较红肉品种更加细腻、化渣性好的关键作用基因。
4 结论
果实成熟后期,白肉品种与红肉品种果实硬度、WSP、WSP/CSP 存在差异,较高的WSP 含量以及WSP/CSP 比值的升高是白肉品种枇杷细腻化渣的因素之一。谢花后115 d,白肉品种果实PG、β-Gal 活性显著高于红肉品种,但PME 活性在4 个品种间无显著差异,表明果实成熟后期PG、β-Gal 活性的不同将造成红肉枇杷与白肉枇杷果肉质地差异的形成。红肉枇杷和白肉枇杷果实成熟后期质地品质的差异是果胶降解相关基因相互协调作用的结果,其中PL、PG、β-Gal 是关键基因。
