17号染色体三体、嵌合体及单亲二体的产前遗传学诊断及临床特征
2020-10-31张建林许晨霞李燕芳赵婧梁少霞杨海鑫王德刚
张建林 许晨霞 李燕芳 赵婧 梁少霞 杨海鑫 王德刚
(1. 江苏南通大学附属医院 妇产科,江苏 南通 226001;2. 南方医科大学附属中山博爱医院 产前诊断中心, 广东 中山 528400; 3. 广州医科大学附属第二医院 产科, 广东广州 510260)
17号染色体在人类染色体中基因密度位居第一,全长81.2Mb,包含1209个编码基因,其中OMIM基因1001个,与疾病相关的OMIM基因309个。目前已知与17号染色体相关的疾病主要有Miller-Dieker lissencephaly 综合征(OMIM#247200)、Smith-Magenis 综合征(OMIM#182290)、Li-Fraumeni 综合征(OMIM#151623)、Koolen-De Vries 综合征(OMIM#610443)、Robinow 综合征(OMIM#618529)、17q23.1-q23.2 微缺失综合征(OMIM#613355)、17q23.1-q23.2微重复综合征(OMIM#613618)、17q12微缺失综合征(OMIM#614527)、17q12微重复综合征(OMIM#614526)等。本综述旨在对17号染色体三体、嵌合体及单亲二体(uniparental disomy of chromosome,UPD)的发生率、产生机制、临床特征、治疗与预后、实验室检查、鉴别诊断及再发风险评估进行汇总,以期为涉及17号染色体的产前遗传学诊断及遗传咨询提供帮助。
1 产生机制及发生频率
17号染色体发生的情况极少,或者是更早期的三体胚胎丢失,文献估计其在流产组织中发生率为0.1%,临床妊娠中发生率为0.02%[1]。
嵌合型17号染色体三体共报道35例(见表1),由于其临床特征不为人所熟识,且存在组织特异性嵌合(三体细胞可见于成纤维组织、颊黏膜、脐带、胎盘和尿沉渣,但脐血及外周血均正常),据推测可能存在报道低于实际发生的情况[2,3]。既往文献中明确4例存在有丝分裂错误,3例由减数分裂染色体不分离造成;因母亲和父亲染色体不分离的病例分别为4例和1例[2-5,7,8]。
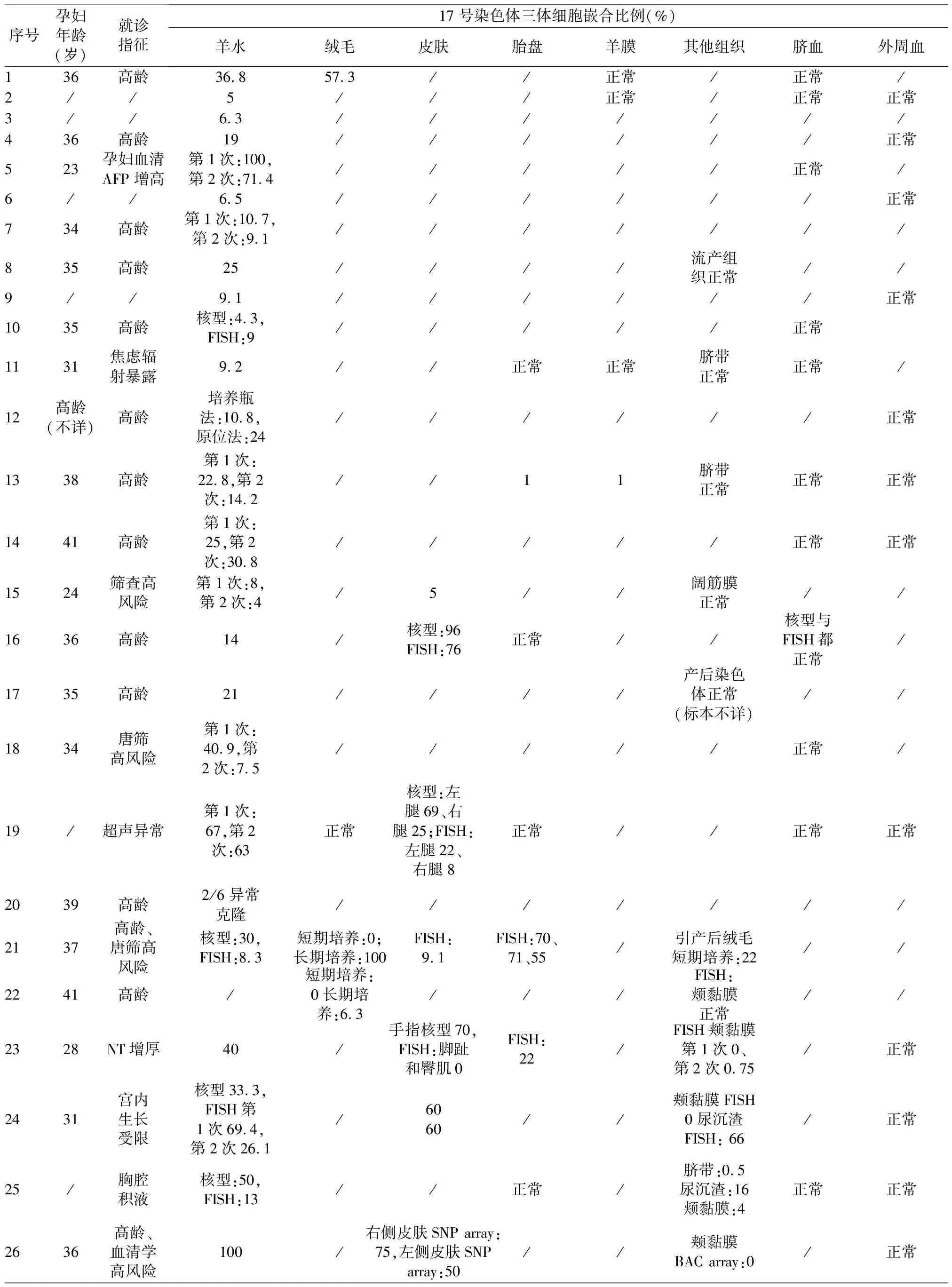
表1 35例嵌合型17号染色体三体细胞分子遗传学结果及随访
17号染色体单亲二体极为罕见,Labrijn等[9]报道1例母源性减数分裂Ⅰ期错误导致的17号染色体混合型单亲二体(mixUPD),17q12-17p13.1和17q25为单亲同二体(isodisomy,iUPD),该条染色体上其他片段为单亲异二体(heterodisomy,hUPD),同时患者17q25区域存在GAA基因错义突变c.871 C>T, p. (Leu291Phe),主要表现为常染色体隐性遗传性疾病庞贝病;片段性单亲同二体(segiUPD)3例,考虑合子后错误事件即受精卵有丝分裂错误导致,其中2例母源,1例父源。
本文对3家单位16 226例产前及流产组织标本中17号染色体三体、嵌合三体及单亲二体发生情况进行汇总,发现流产组织中17号染色体三体异常率为0.44%(详见表2)。
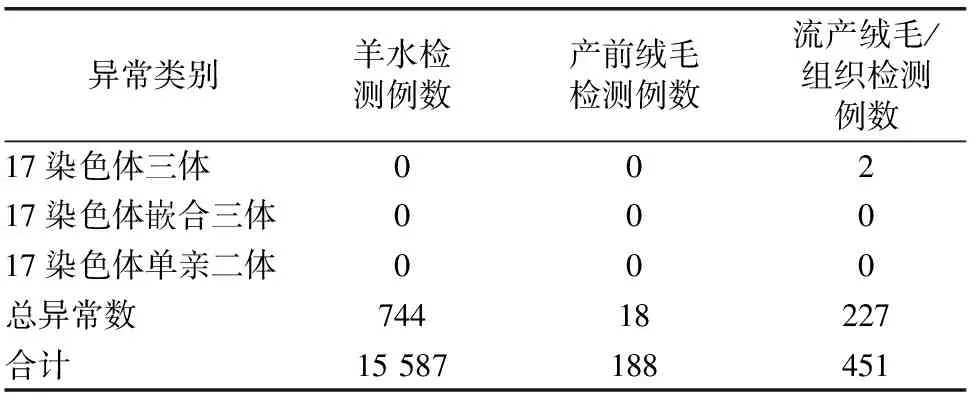
表2 16 226例产前及流产组织标本中17号染色体三体、嵌合三体及单亲二体的检出率(例)*
2 临床特征
17号染色体三体可能因其致死性强,仅偶见于流产组织,活产儿中未见报道。嵌合型17号染色体三体胎儿主要表现为宫内生长受限、长骨(肱骨和腓骨)短、颈部透明层增厚、水囊状淋巴管瘤、室间隔缺损、单心室、单一动脉干、肺动脉狭窄、单脐动脉、第四骶椎阙如、胸腔积液、脑室增大、小脑囊肿、小脑下蚓发育不全、枕骨缺损,脑组织突出于颅骨外、肾脏阙如和多囊肾、眼距宽、小颌畸形、足内翻等[3,5,10-12]。Bullerdiek等[13]首次报道嵌合型17号染色体三体,但缺乏严重畸形的临床资料和对嵌合比例的详细描述。既往研究认为嵌合比例的不同和组织分布差异导致了个体间临床表型的高度异质性,可表现为完全正常、多发微小畸形、生长发育迟缓以及多系统严重畸形。本文汇总了9例嵌合型17号染色体三体活产儿的临床表型,详见表3。几乎所有伴发异常体征的嵌合型17号染色体三体患儿都存在颅面部异常,主要包括小头畸形、眼窝深陷、眼距宽、睑裂水平或下斜、内眦赘皮、鼻梁低平、朝天鼻、鼻尖翘起、球状鼻、鼻小柱发育不全、人中平或短、颚弓高、招风耳或低位耳、无耳垂、小颌畸形、前额凸起、囟门大;同时还存在的异常体征有手脚短小、多指、通贯手、指甲发育不良、趾(指)侧弯、足内翻、爪形趾、趾间隔明显、右脚轻度外翻伴轴后性多指症等。半数以上患者生长发育迟缓、四肢或面部发育不对称、语言发育迟缓、心脏畸形、听力丧失、肾脏异常及小脑蚓部发育不良也常见报道;智力落后、多动症、脊柱侧弯、对疼痛耐受、腹股沟疝、髋关节及肠道发育异常不止一次被报道;精神发育迟缓、色素沉着、自残、REM睡眠短、精囊、输尿管膀胱、甲状腺和唾液腺及主动脉瓣和肺发育异常、肌张力减退、白内障偶见报道。另外1例引产病例存在肝内动静脉复合畸形、右心扩大、胼胝体部分发育不良等[14]。

表3 9例嵌合型17号染色体三体患儿临床表型
17号染色体母源性混合型单亲二体病例17q25区域存在GAA基因的错义突变,文献报道其16个月时因肥厚型心肌病、全身肌无力和酸性α-葡萄糖苷酶不足被诊断为庞贝病(未报道其他异常体征),17个月时接受rhGAA替代治疗。17号染色体片段性单亲二体同时伴GAA基因突变的庞贝病患者表现为呼吸窘迫、心肌病、肝脾肿大、永存左上腔静脉、左心室肥厚、α-葡萄糖苷酶活性下降等[9]。
3 嵌合比例与表型异常严重程度的关系
17号染色体三体嵌合在不同病例及组织之间差别较大,嵌合比例约4%~100%。临床表现多样,绒毛组织短期或长期培养阳性病例出生后表型均正常,文献考虑限制性胎盘嵌合所致,嵌合比例和临床体征的数量及严重程度没有必然联系[4,5,15]。皮肤组织中存在17号染色体三体嵌合的病例都伴发各种异常体征,肢体两侧嵌合比例悬殊的病例身体不对称现象明显,但和严重程度不呈正相关[3,4]。孕期异常表型与产后表型比较,有相当大的一致性,其中超声未见异常的嵌合型17号染色体三体出生后随访结局良好,而伴超声异常的病例大都预后不良[16]。
4 治疗与预后
4.1 17号染色体三体嵌合 如果绒毛膜采样发现17号染色体三体嵌合,应行羊膜腔穿刺验证。如果羊膜腔穿刺发现嵌合,则没有必要重复检查,但要同时密切关注产前超声,超声正常者绝大多数预后良好,超声异常往往预后不良。脐血对判断预后价值不大。
若孕妇坚持继续妊娠至足月产,记录好胎儿发育情况,譬如身长、体重、头围、Apgar评分,注意观察全身有无畸形和临床症状,同时检查留取的胎盘组织以排除限制性胎盘嵌合。若患儿出现多种并发症应请儿科医生协助给予对症处理,包括外科手术和发育迟缓的支持治疗等,比如对存在先天性心脏缺陷的婴儿,根据实际情况评估是否可以通过手术或其他方法来减轻症状或纠正畸形;对存在呼吸道感染的婴儿应及早进行抗感染治疗。交代家属定期随访予以发育评估、记录详细的体格检查等信息。长期跟踪随访若发现存在智力落后、发育迟缓症状,建议取皮肤、颊黏膜或尿沉渣等进行分析研究。目前已经证实皮肤组织17号染色体三体嵌合者都存在异常体征。
若终止妊娠,应对引产胎儿、脐带、胎盘多位置及左右肢体皮肤进行细胞及分子遗传学检查,并为其家族成员做再发风险评估。如果胎儿表型异常同时组织中存在三体细胞,可证明染色体异常效应。注意留取临床照片,为遗传学诊断与表型的相关研究提供依据。
由于羊膜穿刺得到的细胞来自多种胚层,异常的细胞系无法追溯到其起源的特定组织。异常细胞系若起源较早,不仅代表胚胎本身,还代表了胚胎外组织。若是胚胎起源,可反映胎儿的核型;若是胚胎外起源,对胎儿发育影响相对较轻。Hsu等[16]认为,在羊膜穿刺术中的嵌合型三体不应该掉以轻心;Femke等[8]认为羊水17号染色体三体嵌合比例高可能会有严重表型,但最终还是依赖于皮肤成纤维组织的核型进行判断,嵌合程度也会因组织取材不同而异。 Utermann等[5]认为,在羊膜穿刺术中嵌合型17号染色体三体临床意义不明确,需要长期观察积累更多临床资料。由于产前细胞嵌合比例与表型不呈正相关,无法针对结果给予准确的预后判断。鉴于大多数病例是在出生时进行评估的,微小异常不易察觉,出生后发育迟缓可能不会被诊断出。因此对所有产前诊断为嵌合型17号染色体三体的新生儿来说,需要进行长期发育评估。
4.2 17号染色体单亲二体 单亲二体主要由于基因组印迹效应而表现出病理性变化,同时常染色体隐性遗传基因的纯合突变也是其致病的重要机理。文献报道17号染色体单亲二体伴17q25区域的GAA基因突变可致庞贝病。庞贝病采用重组人GAA(rhGAA)替代治疗可取得一定的效果,早期诊断和早期治疗是取得最佳疗效的关键。对于庞贝病婴幼儿型注射用阿糖苷酶α(属于rhGAA 类药物)可延缓病程进展,较好地维持患儿最大肺活量,有效改善其生活质量,降低死亡风险,提高整体生存期;还可改善患儿心肌肥厚程度、心脏功能以及患儿的生长和运动发育。替代治疗对婴幼儿型庞贝病疗效取决于治疗的早晚、交叉反应免疫物质(cross-reactive immunologic material,CRIM)状态。CRIM 阳性的患儿治疗后机体产生的IgG抗体滴度较低,可获得较好的疗效;CRIM 阴性患儿由于机体内完全缺乏GAA,治疗后可产生高滴度的IgG抗体,疗效较差,可予利妥昔单抗、甲氨蝶呤和丙种球蛋白来进行免疫耐受诱导,从而改善替代治疗效果[17]。
5 实验室检查
从标本来源讲,产前诊断可以选择羊水、绒毛组织;皮肤成纤维组织的遗传学分析可以作为产后诊断的金标准;考虑脐血和外周血中异常淋巴细胞生长缺陷,分析不大可能产生有价值的信息,因此不推荐其用作产前和产后的进一步检查;此外,胎盘多点取样、尿沉渣和颊黏膜也可作为产后诊断嵌合三体的辅助验证[8,10,18]。
从技术层面讲,染色体核型分析目前仍是诊断三体及嵌合体的首选,尽管如此,由于培养可能会造成正常细胞的优势生长,对发现真性低比例嵌合体不利,此外,核型也无法分析异常染色体的起源。以荧光原位杂交(fluorescent in situ hybridization,FISH)、短串联重复序列(short tandem repeat, STR)、定量荧光聚合酶链反应(quantitative fluorescence polymerase chain reaction,QF-PCR)为代表的分子诊断技术由于不需要细胞培养,对细胞的分裂周期没有要求,对低比例嵌合敏感性高,结果更加客观真实[5,19]。此外,单核苷酸多态阵列芯片(single nueleotide polymorphism array,SNP array)通过基因分型还可获悉嵌合型17号染色体三体的发生机制及双亲来源、鉴别出单亲二体。目前常用的诊断技术还包括特异性甲基化检测、全外显子测序和全基因组测序。
6 再发风险评估及遗传咨询意见
17号染色体三体极为罕见,减数分裂或有丝分裂不分离引起的17号染色体嵌合再发风险可忽略不计,但由于亲代存在生殖细胞嵌合的可能,需考虑发生三体自救引起的风险[20]。通常很难区别有丝分裂不分离和三体自救,但总的妊娠风险通常较低,除了常染色体隐性遗传有25%的再发风险,为确保下次妊娠正常,应提供相应的产前诊断[21]。
单亲二体从形成机制来看属于新发染色体变异,即变异个体的双亲任何一方体细胞中都不存在染色体畸变,按孟德尔遗传规律来说,再次妊娠复发的几率极低。分子遗传学技术可确定单亲二体染色体来源,其对疾病种类及风险评估有一定帮助。但总的来说,由于单基因疾病在家族内复发的风险非常低,作为上述情况引起的隐性疾病,其复发风险与双亲携带者遗传的25%相比微不足道。可建议(但非必需)曾经生育过17号染色体单亲二体或片段性单亲二体伴GAA基因突变患儿的夫妇双方进行GAA基因检测、孕早期或中期分别行绒毛膜或羊膜腔穿刺进行绒毛或羊水GAA基因突变分析及GAA活性测定。此外,还可采用胚胎植入前遗传学诊断选择优质胚胎进行移植[17]。
