无创检查技术在剖宫产瘢痕部位妊娠早期诊断中的应用性比较
2020-10-30刘燕夏进东许凡勇
刘燕 夏进东 许凡勇
(南京医科大学附属松江区中心医院,上海 201600)
剖宫产瘢痕部位妊娠(cesarean scar pregnancy,CSP)指有剖宫产史孕妇,胚胎着床于子宫下段剖宫产切口瘢痕处,是一种特殊部位的异位妊娠,为剖宫产的远期并发症之一,比较少见,国外文献报道发生率小于1%[1],比宫颈异位妊娠发病率高[2]。因为各种原因,目前国内行剖宫产手术分娩的妇女的数目增多,随着二孩政策的全面放开,剖宫产瘢痕部位妊娠发病率逐步升高。CSP如果未及时明确诊断、早期进行治疗,继续妊娠可引起子宫破裂大出血,甚至造成患者死亡。所以早期做出正确诊断以便及时治疗非常关键。本篇文章回顾性分析37例CSP患者的彩色多普勒超声和磁共振成像(magnetic resonance imaging,MRI)影像特征,比较两种无创检查技术诊断CSP临床价值。
1 资料与方法
1.1 一般资料 收集南京医科大学附属松江区中心医院2012年10月至2015年10月经手术及病理证实的CSP患者共37例,年龄24~44岁,中位年龄34岁。所有患者均有剖宫产史,其中行2次剖宫产手术者9例,1次剖宫产手术者28例。发病距上次剖宫产时间17个月至15年。37例患者均有停经史及血、尿β-HCG 升高,停经时间36~78 d,均处于早孕期。其中9例患者无阴道流血、无腹痛,17例患者有不规则阴道流血伴腹痛;7例要求行终止妊娠手术,4例外院行流产术后阴道流血淋漓不尽。37例患者均行经阴道或补充经腹彩色多普勒超声检查后再行磁共振平扫+增强检查。
1.2 方法
1.2.1 彩色多普勒超声检查 采用GE E8、ALOKAa-5彩色多普勒超声诊断仪器,经阴道超声检查,探头频率平均7.5MHz(5~10MHz),需要时联合经腹探查,探头频率3.5MHz。观察子宫、双附件区情况,对于临床诊断早孕者,若宫内及双附件区未发现妊娠组织,应重点观察原剖宫产瘢痕部位有无异常回声,描述其位置、形态、内部回声情况,测量其大小、外缘距子宫下段切口处浆膜层距离并进行彩色多普勒血流检测。
1.2.2 MRI检查 使用GE SIGNA EXCITE超导型磁共振仪器。检查前嘱患者饮水适量使膀胱处于充盈状态,如有宫内节育器者需检查前取出。37例患者均采用T2WI抑脂、LAVA动态增强扫描序列,进行横轴位、冠状位及矢状位扫描,扫描参数:自旋回波(spin echo,SE)T1WI序列,TR/TE:400ms/10ms;快速自旋回波(fast spin echo,FSE)T2WI序列加脂肪抑制,TR/TE:2000ms/50ms;层厚5mm,层间1mm,矩阵256×256。LAVATR/TE:3ms/0.8ms。按0.2ml/kg体重,经肘静脉注射钆喷酸葡胺注射液,注射完成后15~17s开始进行动态增强扫描,重复4期。
1.3 统计学分析 采用 SPSS18.0统计软件,超声与MRI检查对剖宫产瘢痕部位妊娠的诊断正确率比较,采用四格表确切概率法,按a=0.05水准,P>0.05表示差异无统计学意义。
2 结果
2.1 彩色多普勒超声检查结果 超声诊断正确 31例,误诊为不全流产4例,误诊为宫内早孕1例,误诊为难免流产1例,诊断正确率为83.4%。超声确诊的31例病例可按声像图特点分为3类。①子宫瘢痕妊娠孕囊型23例,子宫正常大小或略大,宫腔中上段无孕囊,宫颈管内口闭,宫颈内未见孕囊,子宫前壁下段切口处(即子宫峡部)可见一孕囊结构(图1),孕囊最大径线8~41mm,内未探及卵黄囊者8例,内探及卵黄囊者9例,探及卵黄囊及胚芽者6例且均有原始心血管搏动。孕囊最外缘距子宫下段切口处浆膜层距离2~6mm;CDFI:孕囊周边可探及环状或半环状血流信号。②不均质团块型6例,子宫不同程度增大,子宫前壁下段切口处见不均匀实性高回声团块或囊实混合性团块(图2),最大径线15~51mm,与子宫前壁肌层分界不清,切口处肌层菲薄。其边缘距子宫下段切口处距离可近至紧贴子宫下段切口处浆膜层,最远距离5mm;CDFI可探及团块内部丰富条状、点状血流。③蜂窝型 2 例,表现为子宫前壁下段肌层内巨大团块,病灶未突破子宫前壁下段浆膜层,最大径线72mm,内见大小不等的液性暗区,呈马蜂窝状,子宫下段膨大,彩色多普勒显示前壁肌层血流异常丰富,呈五彩斑斓花团,彩色血流信号混叠(图3)。超声显示孕囊旁或宫腔内积液9例。误诊的6例中3例可归类为孕囊型,3例可归类为不均质团块型。
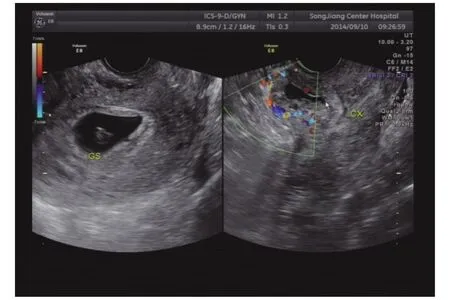
图1 CSP孕囊型
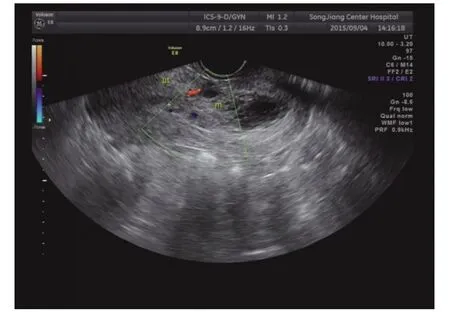
图2 CSP不均质团块型图
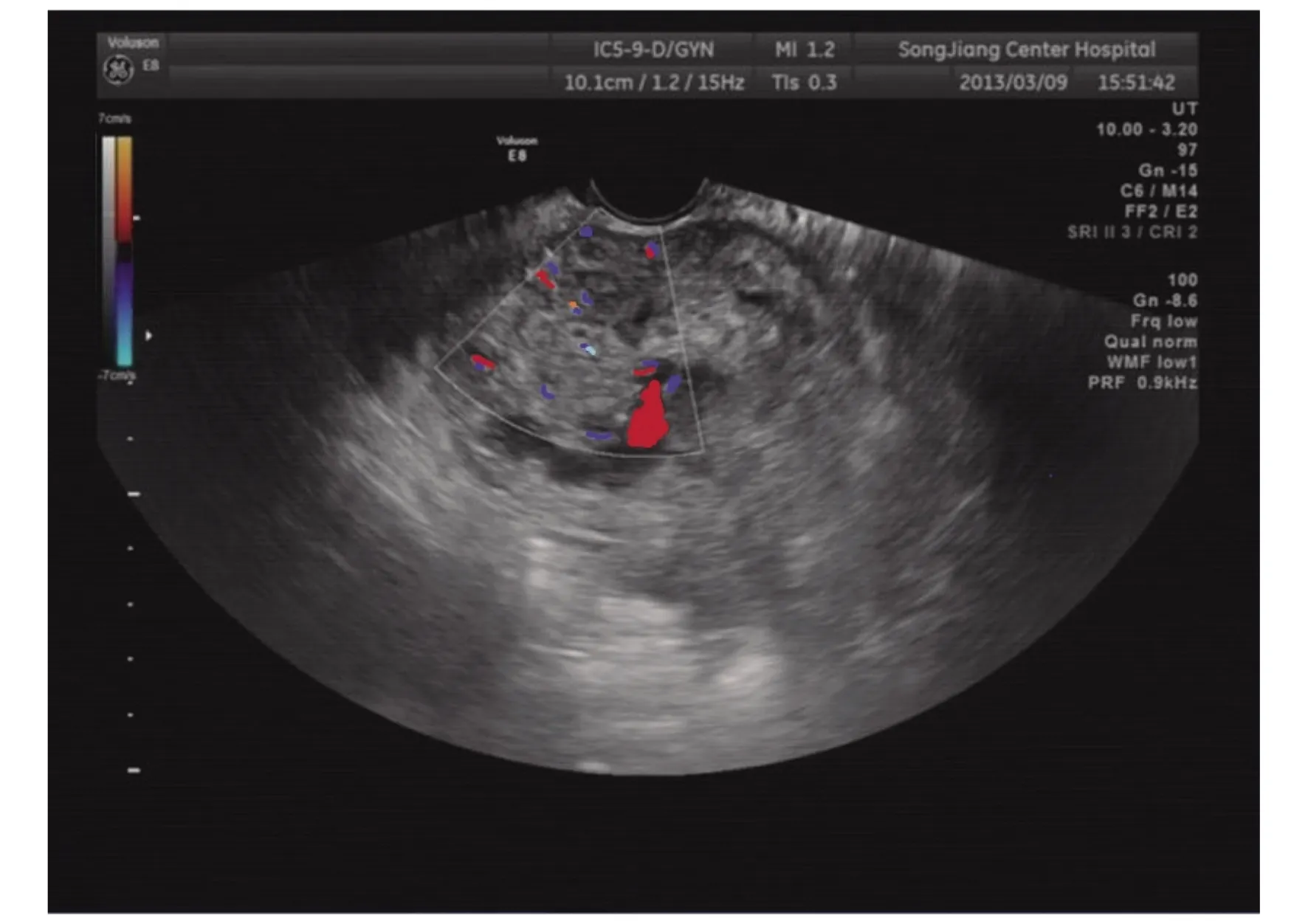
图3 CSP蜂窝型
2.2 MRI检查结果 MRI诊断正确35例,1例误诊为滋养细胞疾病,1例未行肯定诊断,诊断正确率为94.6%。MRI示子宫体积增大,子宫前下壁明显变薄(手术切口瘢痕)、病灶位于瘢痕后方。MRI已确诊的35例按超声声像图分类将相应病例亦分3类。①孕囊型:25例,孕囊大小为12mm×8mm~68mm×21mm,孕囊最外缘距子宫浆膜层距离2.5~6mm,孕囊位于子宫体部下份前壁切口处,呈囊状、类圆形或哑铃状;MRI图像周围可见囊壁23例;T1WI 低信号、T2WI 高信号23例,增强扫描11例呈环形强化,4例呈均匀强化,8例无强化;2例表现为类圆形囊实混杂信号,邻近宫腔内亦见不规则混杂信号灶,与其关系密切,考虑为出血;增强扫描实性部分明显强化,囊性部分无强化。②不均质团块型:9例,病灶大小为约35mm×41mm×27mm和49mm×51mm×35mm,子宫体部下份前壁肌层切口处见不规则形异常信号,T1WI等低信号、T2WI、DWI混杂高信号,其外缘距子宫浆膜层距离分别为5mm、3mm,增强扫描均未见明显强化。③蜂窝型:1例,子宫前壁峡部切口处见60mm×56mm不规则肿块,T1WI等高混杂信号,T2WI/DWI高低混杂信号,病灶边界清楚,增强扫描病灶中央区见条状供血动脉及小斑片异常强化,肿块前缘子宫肌壁菲薄,厚约4mm。 MRI误诊的1例可归入CSP蜂窝型,未明确诊断的1例可归入CSP孕囊型。图4~7所示患者,女性,停经36天,10年前及1年前行剖宫产手术,子宫前倾前屈位,宫体前下方切口处一大小约18mm×17mm×19mm的类圆形异常信号影,内呈长T1、长T2囊状信号,周围有完整包膜,边缘光整,边界清晰,增强扫描囊壁明显均匀强化,囊内无强化。行子宫切口病灶剜出术,病理示子宫切口处妊娠囊。

图4 MRI T2WI 矢状位图
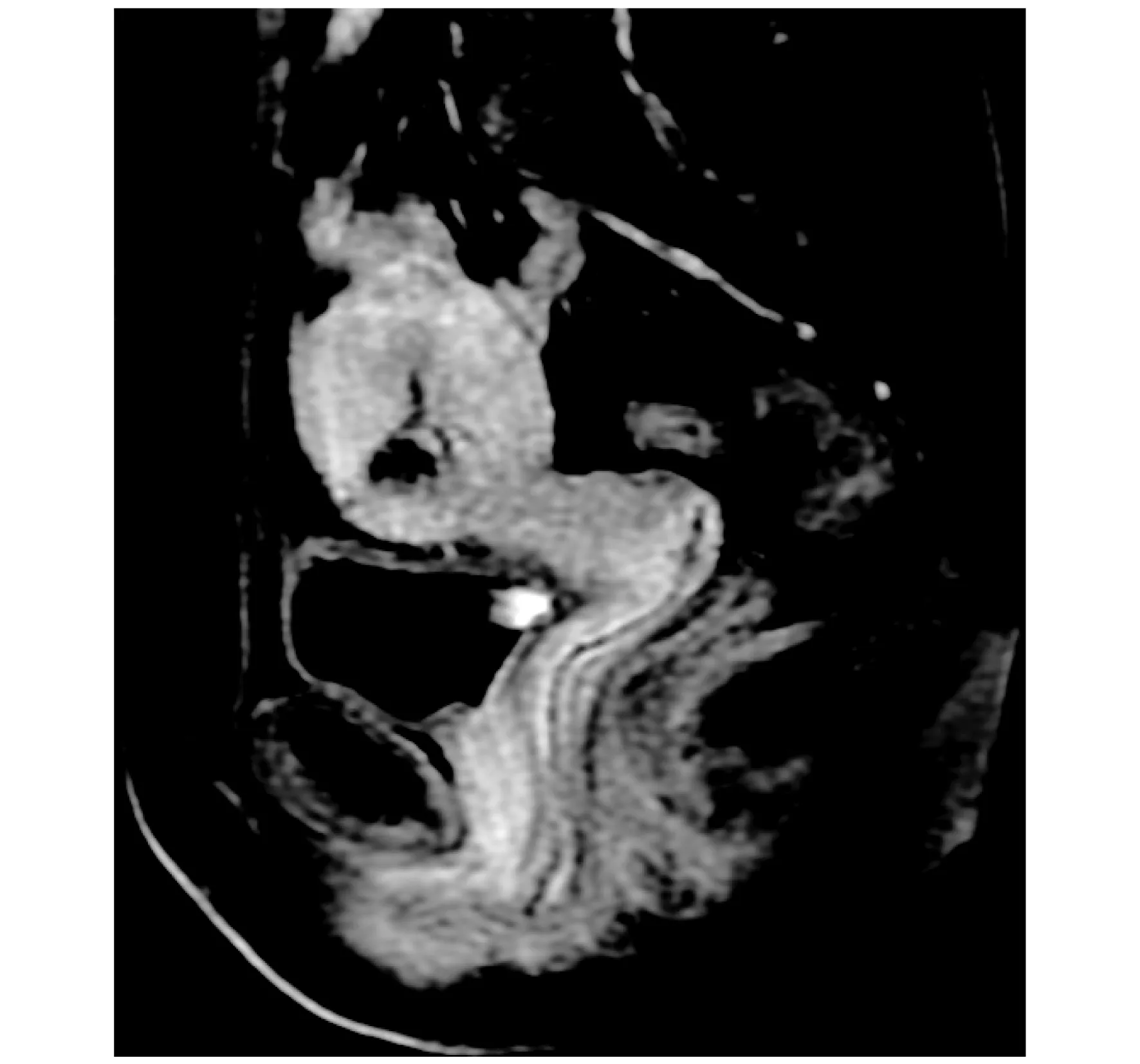
图5 MRI 增强T1WI矢状位
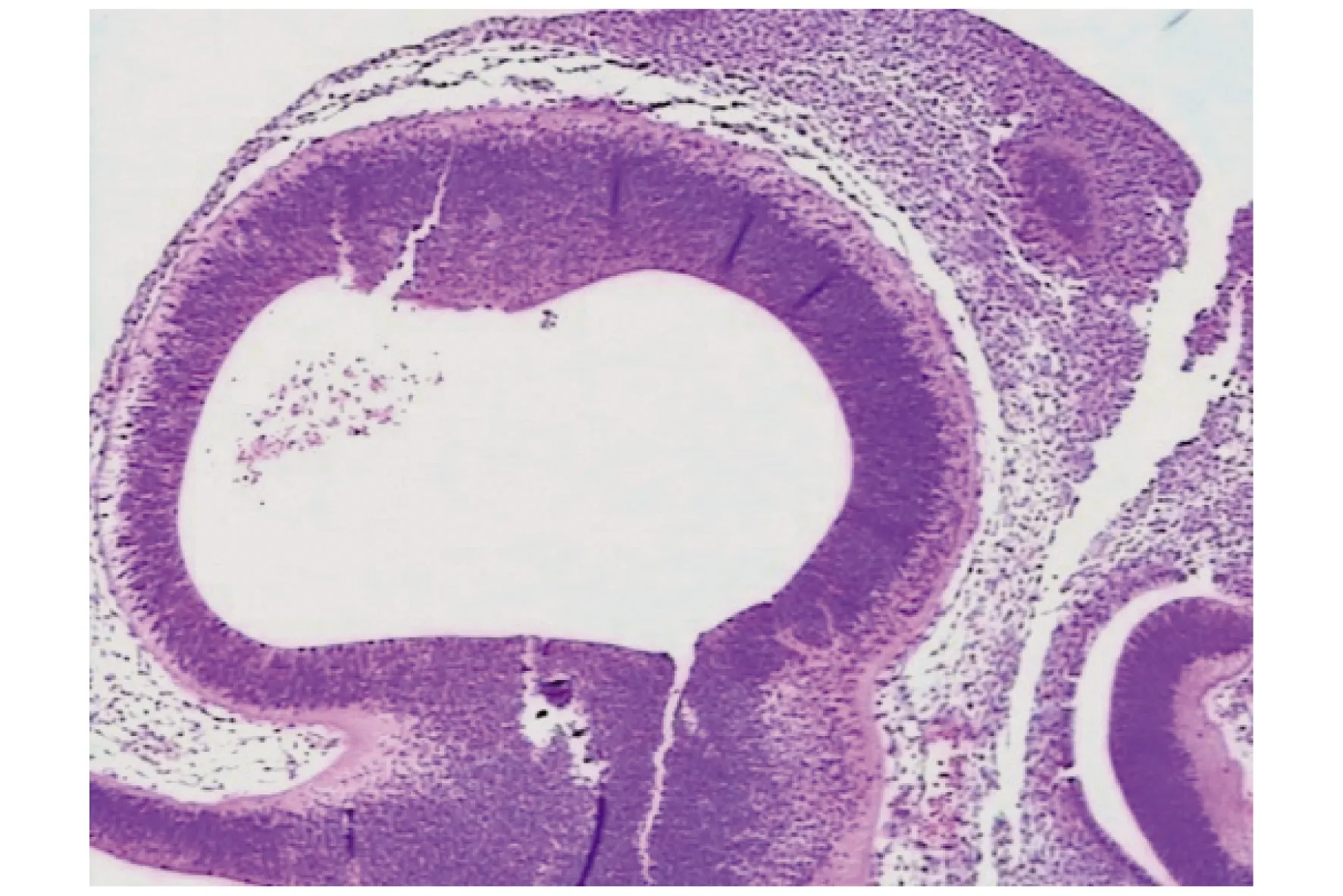
图6 HE×40,可见胎儿成分

图7 HE×40,可见胎盘绒毛
2.3 彩色多普勒超声和MRI诊断结果比较 超声误诊的2例孕囊型CSP及3例不均质团块型CSP,MRI均诊断正确;1例孕囊型CSP超声误诊为宫内早孕,MRI未做出明确诊断;1例蜂窝型CSP超声诊断正确,MRI误诊为妊娠滋养细胞疾病。2种方法对子宫瘢痕妊娠的诊断正确率分别为83.4% 和94.6%,应用四格表确切概率法统计分析,差异无统计学意义(a=0.05,P>0.05)。
3 讨论
1978 年 Larsen等[3]首次报道 CSP。近年来随着剖宫产率提高、经阴道超声及MRI广泛应用,CSP 的文献报道显著上升,其病因目前尚不明确,多数学者认为,可能的发病机制是在子宫内膜与肌层间存在一个可供组织入侵的微管通道,受精卵着床并种植于存在内膜缺损的子宫切口瘢痕处,发生底蜕膜缺失或蜕膜化不足,从而滋养细胞直接侵入肌层,甚至穿透肌层[4]。CSP发病率相对较低,但病情凶险。本组37例患者中,有2例因大出血致失血性休克进行抢救,有3例失血过多进行输血治疗。所以,CSP的早期诊断非常重要,如果继续妊娠或行刮宫手术易导致大出血,危及患者生命。对行剖宫产手术的妇女,再次妊娠时一旦出现阴道不规则流血,应在孕早期行阴道超声或MRI检查。
3.1 彩色多普勒超声在CSP诊断中的价值 经阴道彩色多普勒超声检查技术被广泛的应用于CSP的诊断中。CSP的主要超声诊断标准为①子宫腔与颈管内均未见孕囊;②孕囊位于子宫前壁下段;③约2/3患者的孕囊和膀胱壁间肌性组织厚度(即孕囊最外缘距子宫下段切口处浆膜层距离)<5mm,且有缺损;④偶见子宫下段肌性组织断损,孕囊突于其间[5]。按照该标准,结合文献[6]和本组患者病变特征,认为CSP的超声声像图可分为孕囊型、不均质团块型、蜂窝状无回声型。本组70.3% 的患者在近原剖宫产切口处可见妊娠囊,24.3%为不均质等回声或混合性回声,5.4%为蜂窝状无回声。Wu等[7]认为超声矢状切面是观察CSP的最佳切面。CSP声像图表现主要与误行药物流产、胚胎停育等因素有关。超声可显示孕囊旁或宫腔内积液,提示出血。彩色多普勒超声具有典型特点,即孕囊型孕囊周边可探及环状或半环状血流信号;不均质团块型病灶内部可探及条状或点状血流信号;蜂窝状无回声型病灶内可见丰富的彩色血流信号,五彩斑斓。有学者[7]提出通过观察孕囊旁是否有彩色血流信号来进行鉴别CSP与流产,流产的患者病灶旁无滋养血管显示,且自然流产的病人腹部轻柔施压孕囊有滑动感。但本组5例误诊为流产的CSP,CDFI未见明显血流信号或仅见稀疏点状血流信号。随着经阴道超声在妇产科的应用使 CSP 易早期诊断,必要时联合应用经腹超声,病灶显示更全面,提高了诊断的正确率及敏感度。超声检查给临床提供剖宫产瘢痕处有无占位病灶、病灶大小、内部回声情况以及瘢痕处子宫肌层厚度等信息,有效地指导临床医师选择正确的诊疗方案。临床上应用彩色多普勒超声观察介入治疗(双侧子宫动脉灌注、栓塞术)后,病灶周围血供情况,结合患者血β-hCG值,判断介入治疗是否有效。有学者认为[8],对病灶外缘距切口处浆膜层距离>3mm,孕囊或病灶最大径<30mm者,可选择超声监护下清宫术。本院临床医师在介入治疗后,根据超声报告提供的病灶处血供情况,选择是否需MTX化疗和超声监视下清宫术时机,或选择手术切除病灶。
3.2 MRI用于CSP诊断价值 目前尚无CSP的MRI分类诊断标准,参照超声分类标准,将其分为孕囊型、不均质团块型、蜂窝型。结合本组37例MRI资料分析,认为矢状位是观察的最佳方位,有学者[9]认为孕囊以MRI矢状面增强SPIR抑脂T1WI序列显示最为清晰,这与我们观点相符。结合冠状位及横断位等多方位成像可清晰地显示妊娠囊与周围组织的关系[10]。以下特点可提示子宫瘢痕妊娠:子宫前壁下段见剖宫产术后切口影,妊娠囊植入剖宫产切口处,多向子宫前壁肌层浸润生长,妊娠囊信号多变,大多呈T1WI 低、T2WI 高囊状信号,少数呈T1WI 、T2WI混杂信号。大部分妊娠囊周缘可见囊壁,增强后呈环形强化,囊内部分发育的胚胎组织亦可见强化影。妊娠囊周边组织强化程度与孕囊内发育的胚胎组织强化程度不同,增强扫描对孕囊的所在部位、其大小及其与邻近组织的关系显示得更清晰。MRI具有较高软组织分辨率,可清晰显示妊娠囊内液性成份,观察病灶及子宫周围有无出血、子宫前壁肌连续性是否存在。
4 彩色多普勒超声与MRI诊影像结果对比
本组37例患者中,前、后者对剖宫产瘢痕部位妊娠诊断正确率分别为83.4%和94.6%,经统计学分析,P差异无显著性,可见二者对病变的显示及诊断正确率无明显差异。与MRI相比,彩色多普勒超声检查无需预约,检查时间短,患者易配合,且所需费用较低,可重复性操作,患者更易接受,在监测病变进展方面较MRI有优势。且在本组37例患者中,CSP孕囊型26例彩色多普勒超声正确诊断23例,超声易判断孕囊与膀胱之间肌层连续性是否存在,彩色多普勒超声可显示孕囊周围高速低阻的血流信号。有学者认为超声在诊断CSP中的作用是其他方法不可替代的[8],所以,超声应作为CSP首选检查方法。
本组2例孕囊型CSP及3例不均质团块型CSP,超声误诊而MRI均诊断正确,这5例误诊病例共同特点是彩色多普勒未见明显血流信号,这可能与超声医师对彩色量程、彩色增益调节不熟练有关。超声是单平面成像,MRI可进行多平面观察,对于前倾前屈位子宫或极度后屈子宫,MRI成像可更准确判断病灶最外缘距子宫下段切口处浆膜层距离。MRI具有良好的软组织对比,对妊娠囊及其周围组织信号进行分析,MRI不仅能发现病变, 更易显示病灶与周围组织关系,能准确判断子宫前壁峡部肌层有无破裂。超声和MRI检查均可发现宫腔或孕囊旁积血,由于血红蛋白中铁的性状影响MRI成像,MRI可判断出血时间,临床可依据MRI判断是否存在急性出血或慢性出血而选择合适的手术时机。彩色多普勒超声检查难以鉴别蜂窝型CSP与滋养细胞肿瘤,均表现为血流信号丰富杂乱、五彩混叠,且流速多为低速低阻型。有文献报道[11],滋养细胞肿瘤MRI显示病灶多位于子宫肌层内或弥漫侵犯,常伴有相邻联合带显示不清或中断,动态增强扫描,滋养细胞肿瘤呈现早期明显强化,后期由于子宫肌层明显强化,病灶则显得相对低强化。本组1例蜂窝型CSP,MRI误诊可能与医师临床经验不足,对相关疾病认知不够有关。对于超声难以确诊的CSP病例,应行MRI检查。
总之,彩色多普勒超声检查在各级医院均有开展,简单易行、病人准备时间短、限制条件少(宫腔内有金属节育环者,MRI检查前需先行取环手术),所需费用也较低,病人易于接受且可重复性操作。彩色多普勒超声对CSP诊断正确率亦较高,在CSP的早期诊断和后续治疗中具有重要价值。但超声检查受制于操作者的技术状况及操作方法,可能会产生误诊。MRI具有较高的软组织分辨率,可以多平面、多参数成像,获得的图像异常清晰、对比度好。对于CSP的影像学检查,宜选择简单易行的彩色多普勒超声作为首选检查方法及随访;对于复杂性CSP(不均质团块型、蜂窝型)、判断周围组织关系等,宜选择MRI进一步检查。
