8号染色体三体、嵌合及单亲二体的遗传学诊断及临床特征
2020-10-31刘燕霞安刚高璐璐陈样宜王一帆董晶刘金秀
刘燕霞 安刚 高璐璐 陈样宜 王一帆 董晶 刘金秀*
(1.广东博奥医学检验所,广东 东莞 523808;2.福建省妇幼保健院,福建 福州 350001;3.济南银丰医学检验所,山东 济南 250014;4.东莞博奥木华基因科技有限公司,广东 东莞 523808)
8号染色体属于C组中等大小的亚中着丝粒染色体,该染色体长约146Mb(hg19),包含484个基因,144个OMIM基因,其中93个为隐性遗传病致病基因,59个为显性遗传病致病基因,约占总基因数量的1.5%。这其中8%的基因与神经发育及功能有关,16%的基因与癌症相关。8号染色体上主要的微缺失微重复综合征有8p23.1 重复综合征、8p23.1缺失综合征、8q21.11微缺失综合征(OMIM#614230)及Langer-Giedion综合征(OMIM#150230)。本综述将对8号染色体三体、嵌合型8号染色体三体、8号染色体单亲二体的产生机制、发生率、常见临床特征、诊断技术、治疗、预后及再发风险进行汇总,以期对相关疾病的遗传学诊断及遗传咨询提供帮助。
1 8号染色体三体及嵌合体
1.1 产生机制及发生频率 8号染色体三体综合征(trisomy 8,T8),又称Warkany综合征(Warkany syndrome),由Grouchy于1971年首次报道,1972年,Caspersson等[1]进一步确认和补充,已报道的病例全部为新发突变,约2/3患者为嵌合体,男性患者多于女性(男性∶女性=3∶1)。完全型的T8是由减数分裂期间染色体分离错误导致,通常是致命性的。福建省妇幼保健院在以往3万多例产前诊断样本中未曾发现T8病例;活产婴儿中的发病率未见报道,其在自然流产中发生率约0.8%[2]。我们4家合作单位统计了2015年至今的实验数据,共检测15 375例流产组织样本,其中有131例T8,占0.86%(表1),这些T8胎儿一般于孕14周前就流产。孕12周后进行的无创产前检测(non-invasive prenatal testing,NIPT)样本统计显示,共检测492 515例样本,其中NIPT提示T8样本128例,有效回访样本中未见真阳性(表2)。孕16周以后的羊水穿刺及脐带血穿刺样本统计结果显示,42 749例产前诊断样本未见T8(表3)。
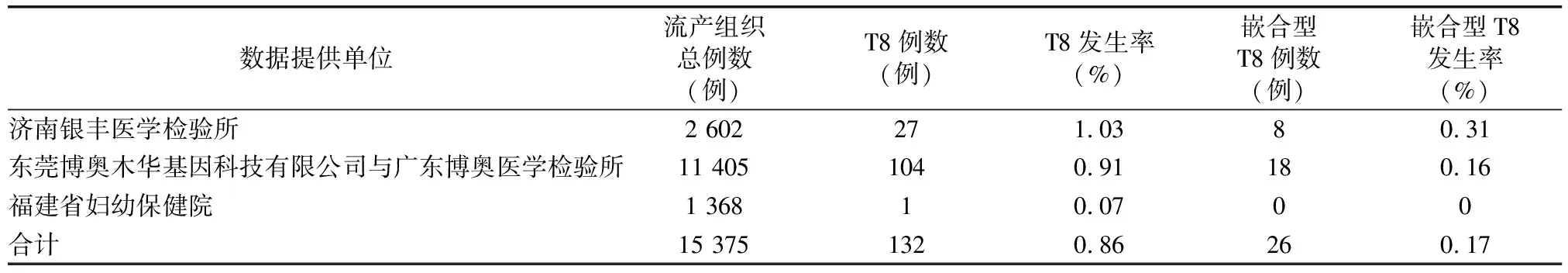
表1 15 375例流产组织中T8及嵌合型T8的发生率
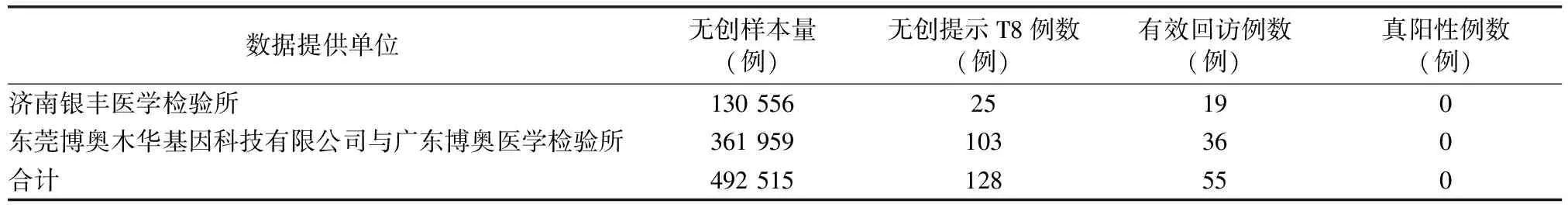
表2 NIPT结果
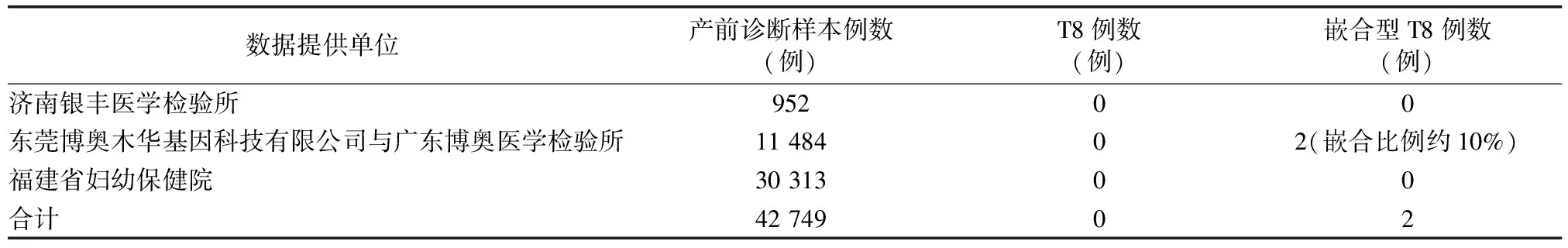
表3 产前诊断结果
嵌合型8号染色体三体(嵌合型T8)是一种较为罕见的常染色体异常综合征。在新生儿中的发病率约为1∶25 000~1∶50 000,男性患者多于女性(男性∶女性=5∶1)[3],临床表型从正常到严重畸形,具有高度表型异质性和遗传异质性,暂未见8号染色体嵌合程度与表型严重性相关的报道。嵌合型三体是合子后错误,由正常核型的胎儿在有丝分裂期间染色体分离错误或三体自救导致[4]。我们统计了2015年至今的实验数据,共检测15 375例流产组织样本,其中有26例嵌合型T8,占0.17%(表1);另外在羊水样本中,检测到2例嵌合型T8,其中1例产前B超异常,表现为胎儿双侧侧脑室呈泪滴状,侧脑室后角宽约10mm,双侧肾盂增宽,胼胝体发育不全(表3)。
嵌合型T8的限制性胎盘嵌合(confined placental mosaicism,CPM)相对常见,即三体细胞局限于胎盘,但胎儿具有正常核型[5]。现阶段研究表明,CPM并未对胎儿产生长期不良影响[6]。
1.2 临床特征 T8的临床表型有智力障碍、特殊面容、髌骨缺失或发育不良、关节挛缩、足底/掌沟、脚趾明显异常、椎体异常、骨盆狭窄等骨骼系统异常,输尿管异常、肾异常等泌尿系统异常或伴有其他系统异常[3]。据文献报道,T8是血液病中最常见的染色体数目异常,广泛存在于恶性血液病,尤其多见于骨髓增生异常综合征(myelodysplastic syndromes,MDS)、急性髓性白血病(acute myelocytic leukemia,AML)、慢性髓性白血病(chronic myelocytic leukemia,CML)、骨髓增生性疾病(myeloproliferative disease,MPD)等髓系恶性血液病,在AML、MDS、MPD中的发生率分别为5.6%、7.5%、7.5%,较少见于淋巴系恶性血液病,因此T8可能在恶性血液病尤其是髓系恶性血液病的发生发展中起重要作用[7,8]。
完全型的T8多在妊娠早期流产,存活者绝大多数为嵌合型患者[9],但也有少数完全型T8存活的案例。Caspersson等[1]曾报道1例男婴,患者因智力发育迟缓和各种异常而确诊,临床表现为隐睾、会聚性斜视、第五指弯曲、骨骼发育不良、右位主动脉弓,核型为47,XY,+8,无嵌合;李佩琼等[10]报道1例习惯性流产的35岁女性,其核型为完全性T8,未伴有其他临床症状;齐海峰等[11]报道1例已存活至13岁的完全T8的患儿,临床表现有前额突出、眼位深、眼间距宽、鼻梁塌、鼻根宽、鼻孔朝天、耳位低、下唇厚等面部形状异常,多动、反应迟钝,先天性胼胝体缺如、枕大池蛛网膜囊肿等中枢神经系统发育异常,左手通贯掌,双肾轻度积水、双侧输尿管上段扩张等泌尿系统异常,心脏节律欠佳,右侧腹股沟异常回声。
嵌合型T8临床表型异质性大,从表型正常到严重畸形均有报道:智力障碍、胼胝体发育不全、无鼻无脑畸形等中枢神经系统异常;头骨不对称、小头畸形、脑积水、前额突出、枕骨扁平、后发际线低、眼距过宽、眼睛深陷、斜视、角膜混浊、白内障、弱视、宽鼻子、鼻孔突出、小颌畸形、下唇外翻、高腭弓、软腭裂、低位耳、畸形耳等颅面部异常;漏斗胸、乳头间距宽等胸部异常;先天性心脏病;Mechel憩室、先天性巨结肠、肛门异常等胃肠道异常;隐睾、单侧肾缺如、肾母细胞瘤、输尿管异常、会阴异常、腹股沟疝、男性生殖器发育不良、不育等泌尿生殖系统异常;身材矮小、锁骨异常、髌骨异常、关节挛缩、椎体异常、骨盆狭窄、肋骨异常、脊柱侧凸、第2~5指/趾全屈曲等骨骼系统异常;掌褶纹深、足底褶纹深等皮肤异常;增加白血病、肾母细胞瘤、囊性肾肿瘤、平滑肌肉瘤等肿瘤易感性等[12]。其中,掌褶纹深、足底褶纹深、智力障碍、精神发育迟滞等表型较为常见。
产前诊断中较少见,超声发现部分胎儿表现为前额突出、耳朵突出、眼距过宽、宽鼻子、大嘴、大头等颅面部异常、单脐动脉、羊水过多、胎儿双侧肾盂扩张、胼胝体发育不良、巨脑室、枕角扩大畸形、室间隔缺损等[13,14],其中胼胝体发育不全是诊断该综合征的最重要依据。
1.3 治疗和预后 完全型的T8胎儿通常在妊娠早期发生流产,存活至出生的完全型T8患儿表型与嵌合型T8类似。目前尚无系统标准的治疗方法,主要为对症支持治疗。治疗手段因具体症状而异,通常需多学科结合治疗。对于行走等运动技能延迟,可采用物理疗法或康复治疗;对于智力异常,根据学习程度可进行早期干预和特殊教育;对于癫痫,可采用促肾上腺皮质激素和氯硝西泮治疗[15];对于严重畸形,需根据患者的表型,定制个性化手术方案[16]。
嵌合型T8患者患肾母细胞瘤、骨髓异常增生和髓样白血病的风险更高[17],对于某些不伴有严重畸形的嵌合型T8患者,预测可有正常寿命。
1.4 实验室检查 对于T8的实验室检测,常用核型分析、荧光原位杂交(fluorescent in situ hybridization,FISH)、染色体微阵列分析(chromosomal microarray analysis,CMA)、低深度全基因组测序(copy-number variation sequencing,CNV-seq)等。针对低比例嵌合,建议核型分析和FISH联合应用。行细胞遗传学诊断时,应检测不同组织样本,淋巴细胞中的异常细胞嵌合比例常随年龄的增长而减少[18]。在部分年长患者中,仅能在成纤维细胞中检测到嵌合现象。
染色体核型分析是产前诊断的金标准,目前采用的样本类型包括绒毛、羊水、脐血。具有特异性探针的间期FISH能进一步确定嵌合体比例。2016年Van Opstal D[19]的研究表明:对于NIPT发现的T8,可以取绒毛穿刺长期培养获得的细胞诊断,对诊断为嵌合型T8病例不建议羊膜穿刺术确诊,而建议采用脐血穿刺进行确诊。
1.5 再发风险评估及遗传咨询意见 T8及嵌合型T8多为新发突变,患者同胞再发风险低;女性患者自然流产风险增加,可能生育核型正常的后代。嵌合型T8需结合核型分析、FISH、CMA等细胞遗传学检测结果及超声监测结果,综合评估胎儿整体情况与预后。
2 单亲二体
2.1 产生机制及发生频率 8号染色体单亲二体(uniparental disomy of chromosome 8,UPD8)主要成因是减数分裂出现错误的精子(卵子)和卵子(精子)结合形成8号染色体三体受精卵,在胚胎早期有丝分裂过程中失去一条8号染色体(三体自救,trisomy rescue),或出现错误的精子(卵子)和卵子(精子)结合形成8号染色体单体受精卵,在胚胎早期的有丝分裂过程中,8号染色体只复制不分离(单体自救,monosomy rescue)而产生的染色体数目正常但是两条8号染色体均来源于一个亲本的胚胎。UPD按其来源可分为单亲同二体(isodisomy,iUPD)和单亲异二体(heterodisomy,hUPD)[20]。UPD8预后往往与是否合并8号三体嵌合、纯合状态区域是否含有隐性遗传病基因致病性位点有关[21]。8号染色体单亲二体现有报道较少,暂未发现该染色体存在可以导致严重疾病的印记基因[22]。
2.2 临床特征 1996年Benlian等[23]报道1例父源8号染色体iUPD导致LPL基因纯合突变个体,继而引起家族性高乳糜微粒血症;2000年Karanjawala等报道1例有早发性回肠类癌病史的母源8号染色体iUPD病例;以上2例生长发育均正常,因此,8号染色体可能不存在导致严重疾病的印记基因。
2007年Varon等[24]报道1例母源8号染色体iUPD导致NBN基因纯合突变个体,继而引起奈梅亨断裂综合症。临床表现包括典型奈梅亨断裂综合症表型:低出生体重、发育不良、小头畸形、前额倾斜、内眦赘皮、低位耳、朝天鼻、小下颌等颅面部异常等。
2016年Ahram等[25]报道1例母源8号染色体hUPD伴8号染色体部分三体嵌合个体(47,XY,+ mar,mar由8号染色体的着丝粒区域组成,推测是三体自救的残余物),临床表现有母亲妊娠期羊水过多,超声检查发现骨盆扩张,出生时自发消退;出生体重为3.8kg,出生早期有胃食管反流,母乳喂养困难;牛奶过敏,4岁之前有慢性哮喘、轻度智力障碍、自闭症、注意力缺陷多动障碍、语言发育迟缓、运动发育迟缓、左眼远视、继发性肌张力低下、易冲动、沮丧、食欲亢进、超重等。
暂未发现有力证据支持父源UPD/母源UPD可导致个体异常表型,若父/母8号染色体存在隐性遗传病致病基因突变,则可能导致相应疾病发生。
2.3 治疗与预后 对于由UPD8导致的隐性遗传病,按相应疾病对症治疗,预后与疾病类型相关,不同疾病预后不一。
2.4 实验室检查 目前常用的诊断技术包括微卫星标记(又称短串联重复序列STRs)分析、特异性甲基化检测、CMA、家系全外显子测序(whole-exome sequencing,WES)、家系全基因组测序(whole-genome sequencing,WGS)。其中STRs、特异性甲基化检测较适用于有明确UPD疾病指征的UPD检测,价格相对较低;CMA一次检测可覆盖全部染色体,无需家系分析即可准确检出发生UPD的染色体,进一步家系分析可明确UPD来源,此外,还可检出>100kb的拷贝数变异(copy number variation, CNV),价格相对适中;WES/WGS可检测点突变、几到几十个碱基缺失/重复,部分检验机构的家系WES/WGS测序产品可以检测UPD,可明确由于UPD导致的隐性遗传病,但是价格相对较高。
2.5 再发风险评估及遗传咨询意见 研究表明UPD的发生率为1/3500~1/5000,Nakka等[26]对214 915个家系研究后发现,UPD的发生率在活产儿中为1/2000,由于UPD来源于父/母一方,若父/母8号染色体存在隐性遗传病致病基因突变,则可能导致相应疾病的发生。
