高聚原花青素新型降解产物生物活性研究
2020-10-29陈梦颖索昊张舒婷孙宝山
陈梦颖,索昊,张舒婷*,孙宝山*
(1. 沈阳药科大学功能食品与葡萄酒学院,辽宁沈阳 110016;2. 深圳大学高等研究院,广东深圳 518060)
葡萄酒酿造过程中可产生大量的副产物——葡萄渣,常作为废物被丢弃,成为环境污染源之一。利用葡萄渣制备具有生物活性的小分子物质无疑具有良好的经济和社会效益。葡萄籽富含原花青素类成分,基于其强效的抗氧化特性,近年来备受关注。原花青素单倍体和低聚体可直接吸收入血,发挥功效[1-2],而高聚体则由于聚合度高,难以被人体吸收,导致生物利用度低;还会抑制机体内的α-淀粉酶、脂肪酶、α-葡萄糖苷酶、胃蛋白酶、胰蛋白酶等消化酶的活性[3-5]。因此,将高聚原花青素降解转化为低分子活性物质成为葡萄酒废渣利用的新途径。本研究选用葡萄酒生产过程中的副产物葡萄籽高聚原花青素作为研究对象,采用实验室首次建立的降解方法,利用新型亲核试剂硫普罗宁完全降解高聚原花青素,获得新型降解产物。对所获得降解产物进行应用1,1-二苯基-2-三硝基苯肼(DPPH)自由基、2,2-连氮-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)自由基清除作用以及总抗氧化能力的体外抗氧化活性研究,建立H9C2和PC12细胞氧糖剥夺模型来研究新型降解产物对两种细胞损伤的保护作用,并从构效关系角度探究降解产物活性的变化规律,对新型降解产物的潜在生物活性及构效关系进行初步探索。
1 材料和仪器
1.1 材料与试剂
葡萄籽原花青素提取物购自天津尖峰有限公司。
硫普罗宁购自玛雅生物科技有限公司;L-抗坏血酸购自瑞士Fluka公司;过硫酸钾、醋酸钠、三氯化铁、磷酸二氢钾、磷酸氢二钠均购自博迪化工有限公司;醋酸购自科密欧化工有限公司;浓盐酸、甲醇(分析级)、乙酸乙酯(分析级)购自富宇精细化工有限公司;无糖DMEM培养液、高糖DMEM培养液、RPMI 1640均购自赛默飞世尔科技(中国)有限公司;四甲基偶氮唑盐(MTT)、DPPH、ABTS、2,4,6-三(2-吡啶基)三嗪(TPTZ)、奎诺二甲基丙烯酸酯(Trolox)、DMSO均购自美国Sigma-Aldrich公司;CT、ECT、ECGT均为实验室自制(纯度>96.5%);大鼠H9C2(2-1)心肌细胞、大鼠PC12神经细胞均购于北纳创联生物科技有限公司。
1.2 仪器与设备
超高效液相色谱ACQUITY UPLC H-CLASS、Waters 2695、Waters PDA检测器、Empower 2工作站,均产自美国沃特世公司;高速逆流色谱仪(TBE-300C),上海同田生化技术有限公司;YMC ODS-A-HG和5% CO2恒温培养箱,日本YMC公司;KH-250DE超声仪,禾创超声仪器有限公司;缺氧小室,加拿大Stemcell公司。
2 方法
2.1 高聚原花青素的制备降解与分离纯化
2.1.1 高聚原花青素的制备
称取适量葡萄籽原花青素提取物加入100 mL蒸馏水溶解。将溶液上样于蒸馏水预处理后的YMC ODS-A-HG(200×25 mm,25~40 μm)C18色谱柱,依次加入蒸馏水(pH7.0)、乙酸乙酯各200 mL洗脱层析柱,最后以200 mL甲醇洗脱出高聚原花青素。将高聚原花青素粗提液蒸发去除溶剂、蒸馏水溶解、冻干,粉末于-20 ℃储存备用。
2.1.2 高聚原花青素的降解
称高聚原花青素提取物约1 g,置于500 mL具塞反应瓶中,依次加入甲醇200 mL、浓盐酸6.6 mL、硫普罗宁1 g,混匀密闭,于55 ℃反应60 min,冰浴终止反应。加入适量的水,并用0.1 mol NaHCO3调节pH7.0,旋转蒸发替换甲醇溶剂,乙酸乙酯(200 mL)萃取3次。合并萃取层,加入适量的无水硫酸钠除水,40 ℃减压浓缩乙酸乙酯萃取层。真空冻干,粉末于-20 ℃储存备用。
2.1.3 高速逆流色谱法分离降解产物
高速逆流色谱法的(H S C C C)色谱条件参考索昊等[6]的方法以正己烷∶乙酸乙酯∶甲醇∶水=0.12∶1.5∶0.5∶1(vol)为溶剂体系,采用正接正转的洗脱模式。在25 ℃恒温条件下,以流速35 mL/min和转速950 r/min对400 mg降解产物进行分离制备。在波长254 nm下检测记录,根据色谱图手动收集流出组分,35 ℃真空浓缩后,冷冻干燥备用。
2.1.4 降解产物的纯化
色谱条件为YMC-Triart C18色谱柱(250 mm×10 mm,5μm)。柱温:30 ℃;检测波长:280 nm;进样量:100 μL;流速:2.5 mL/min;洗脱条件:A为0.2%甲酸水溶液,B为0.2%甲酸乙腈溶液,梯度洗脱程序如表1。
2.2 降解产物的抗氧化活性研究
2.2.1 对照溶液及供试品溶液制备
称取Trolox对照品约10.3 mg至10 mL量瓶中,加入甲醇定容至刻度,摇匀,分别制得摩尔浓度为1.003 mmol的对照品储备液。精密量取上述对照品溶液适量,用甲醇稀释成浓度分别为0.201、0.401、0.602、0.802、1.003 mmol Trolox系列对照溶液。
精密称取儿茶素(C)、表儿茶素(EC)、表儿茶素没食子酸酯(ECG)、儿茶素-4β-S-硫普罗宁甲酯(CT)、表儿茶素-4β-S-硫普罗宁甲酯(ECT)和表儿茶素没食子酸酯-4β-S-硫普罗宁甲酯(ECGT)置于5 mL量瓶中,加入甲醇定容至刻度,摇匀,制得对照品储备液,即C(4 mmol)、EC(4 mmol)、ECG(2 mmol)、CT(2 mmol)、ECT(2 mmol)、ECGT(2 mmol)。分别精密量取上述对照品溶液适量,用甲醇分别稀释成一系列摩尔浓度的供试品溶液。
2.2.2 DPPH自由基清除能力测定
参考Sá和Brand-Williams等[7-8]的方法,略作修改。96孔板中每孔依次加入DPPH工作液200 μL,不同浓度的供试品溶液或Trolox对照溶液5 μL,以DPPH工作液200 μL+甲醇5 μL为空白,每个浓度设3个复孔。室温下暗处放置60 min,用酶联免疫检测仪测定供试品、对照和空白溶液在517 nm处的吸光度,计算清除率SR,同时将能够有效清除50%自由基的样品浓度定义为抗氧化活性(EC50)。
A0为空白液吸光度;Ai为对照或供试品液吸光度。
2.2.3 ABTS自由基清除能力的测定
在96孔板中依次加入200 μL的ABTS工作液和10 μL不同浓度的样品溶液和VC、Trolox溶液,摇匀,室温下动态测定波长734 nm处的吸光度A(n=3)。空白组用pH 4.5醋酸缓冲液代替ABTS工作液,对照组用甲醇代替样品溶液。计算清除率SR,同时将能够有效清除50%自由基的样品浓度定义为抗氧化活性(EC50)。
2.2.4 FRAP法测定总抗氧化能力
在96孔板中依次加入180 μL的FRAP工作液和5 μL不同浓度的样品溶液,Trolox、FeSO4溶液,摇匀,在37 ℃下进行孵育,动态测定波长在593 nm处的吸光度A(n=3)。对照组用甲醇代替样品溶液,空白组用pH 3.6醋酸缓冲液代替FRAP工作液,以FeSO4溶液浓度为纵坐标,A为横坐标绘制标准曲线。根据反应后A值,在标准曲线上求得相对应的FeSO4的浓度(mmol),将其定义为FRAP值[9]。
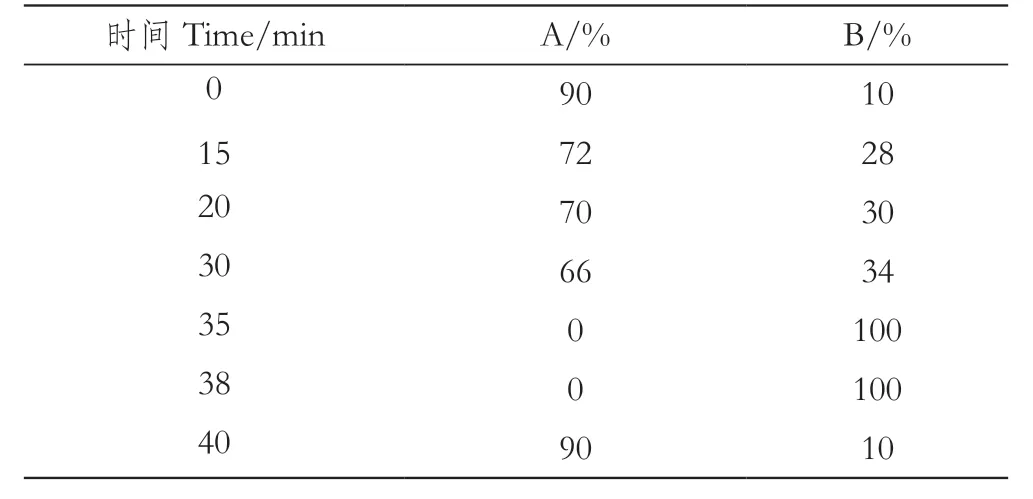
表1 梯度洗脱程序Table 1 Gradient elution procedure
2.3 降解产物对氧糖剥夺12h致大鼠PC12神经细胞及H9C2心肌细胞损伤的保护作用
2.3.1 细胞培养
将H9C2细胞培养于含有89%DMEM、10%Gibco FBS、1%双抗(青霉素和链霉素)的培养基中,置于培养箱内常规培养。PC12神经细胞的培养同H9C2细胞培养,但PC12神经细胞基本培养基为RPMI 1640。
2.3.2 氧糖剥夺试验
将细胞正常培养在培养皿内,待细胞饱和度达到80%~90%时进行传代,待细胞贴壁稳定24 h后,对照组换成正常培养液,于正常培养箱培养;模型组换成无糖DMEM培养液,不含血清;给药组换成无糖DMEM配置相应浓度药物,不含血清。模型组和给药组同时放入缺氧小室(95%N2+5%CO2),氧糖剥夺12 h进行细胞存活率测定。
2.3.3 噻唑蓝(MTT)法测定细胞存活率
氧糖剥夺时间结束后弃去细胞培养液,换成新鲜培养液;每孔加入10 μL配制好的MTT溶液(0.5 mg/mL),使细胞与MTT于37 ℃下共同作用4 h后,弃掉上清,加入100 μL DMSO于570 nm处测定OD值。
国内齿圈热处理主要应用高频感应淬火工艺,但是因感应器的结构会带来不同的淬硬效果。通常齿圈上下两端面的淬硬层深度相同,即两端面的淬硬层硬度也相同,硬度高了就会产生齿心部脆易断裂的缺陷,大大降低齿的耐用性。在齿圈的实际工作时,仅仅与啮合齿轮接近的端面受较大的冲击,而与飞轮连接贴合的端面应该保持较软具有缓冲的功用最佳。这样归结起来就是齿面硬、齿心部相对较软才是最佳的齿圈淬火状态,倒梯形结构的淬火感应器可以达到这个“外硬内软”的理想状态。
数据处理:以一次实验3个复孔计算每组样品的平均OD值。按照公式:CV/%=OD(给药组)/OD(对照组)×100,计算出细胞相对活力变异系数(CV)。相同实验重复3次,以3次CV%平均值进行数据统计。
2.4 数据分析
试验数据用SPSS 22.0软件处理,用GrahPad Prism 6.0作图。采用单因素方差分析(ANOVA)和双变量相关性分析,并用Dunnett's test分析方法比较组间差异,结果表示为平均值±标准差(SD)。
3 结果与分析
3.1 高聚原花青素制备降解及分离纯化
采用硫普罗宁作为亲核试剂完全降解葡萄籽高聚原花青素,运用HSCCC结合半制备液相色谱分离高聚原花青素降解产物,共获得3个原花青素单体成分,分别是儿茶素(C)、表儿茶素(EC)和表儿茶素没食子酸酯(ECG);3种新型降解产物分别为硫普罗宁衍生物儿茶素-4β-S-硫普罗宁甲酯(CT)、表儿茶素-4β-S-硫普罗宁甲酯(ECT)和表儿茶素没食子酸酯-4β-S-硫普罗宁甲酯(ECGT)。一步HSCCC可以成功分离获得3个单体降解产物和一个组分A,其中单体降解产物ECG、ECT、ECGT的产量为6.50 mg、29.8 mg、10.3 mg,纯度分别为90.3%、93.7%、89.5%。组分A经半制备液相色谱分离与纯化,获得C、EC与CT,产量分别为12.2 mg、7.70 mg与11.8 mg,纯度均可以达到95%以上。
3.2 降解产物的抗氧化活性
3.2.1 降解产物的体外DPPH自由基的清除能力
对不同浓度6种降解产物的体外DPPH自由基的清除能力进行测定,对它们的抗氧化性进行初步评价,EC50值与线性范围见表2。6种降解产物的EC50值在210~350,均小于Trolox(阳性对照)的EC50788.24,表明6种降解产物清除DPPH自由基的能力强于Trolox(阳性对照)。其中活性最强的是ECG。C、CT、ECT的抗氧化活性相似。
3.2.2 降解产物的体外ABTS自由基的清除能力
6种降解产物的EC50值在72~141,均小于阳性对照Trolox的EC50值384,即6种降解产物清除ABTS自由基能力均强于阳性对照。C、EC和ECT之间以及ECG、CT和ECGT之间清除ABTS自由基能力无显著性差异,其中ECG清除ABTS自由基的能力最强(表3)。
3.2.3 FRAP法测定总抗氧化能力
6种降解产物的FRAP值与范围见表4。测定结果与DPPH和ABTS抗氧化的结果相似,各降解产物的FRAP值在2.21~2.96,大于Trolox(阳性对照)的FRAP 2.03,即6种降解产物的还原Fe3+-TPTZ能力均大于Trolox(阳性对照)。C和CT之间FRAP以及EC和ECT之间的FRAP还原能力无显著差异。降解产物中ECG的还原能力最大,ECT的还原能力最小。
综合分析DPPH、ABTS和FRAP三种方法的抗氧化活性测定结果,6种原花青素降解产物的抗氧化活性均大于阳性对照Trolox,活性顺序为ECG>ECGT>CT≈C>ECT≈EC>Trolox。降解获得到的6种化合物有希望作为强效的抗氧化剂使用。
3.3 降解产物对氧糖剥夺致大鼠PC12神经细胞及H9C2心肌细胞损伤的保护作用研究
3.3.1 降解产物对氧糖剥夺致大鼠PC12神经细胞损伤的保护作用

表2 DPPH法测定的6种化合物的抗氧化活性和线性范围Table 2 Antioxidant activity and linear range of six compounds by DPPH assays

表3 ABTS法测定的6种化合物的抗氧化活性和线性范围Table 3 Antioxidant activity and linear range of six compounds by ABTS assays

表4 FRAP测定的6种化合物的抗氧化活性和线性范围Table 4 Antioxidant activity and linear range of six compounds by FRAP assays
如图1所示,与对照组相比,氧糖剥夺12 h后模型组细胞存活率明显下降,表明已成功建立了氧糖剥夺致PC12神经细胞损伤模型。在原花青素的6种降解产物中,ECGT在11 μmol和33 μmol时可以显著提高氧糖剥夺的PC12神经细胞的存活率,并呈现出明显地剂量依赖性,而降解产物C、EC和ECG未见其对氧糖剥夺12 h致PC12神经细胞存活率有明显的积极作用。此外,通过C和CT、EC和ECT以及ECG和ECGT的三对母体与衍生物的结果对比中发现,在ECG对细胞损伤不具有明显改善作用时,ECGT能够表现出较好的改善作用。侧面反映ECG在引入硫普罗宁甲酯基团结构发生改变后能够对细胞损伤的保护起到积极作用,说明ECGT的活性强于ECG。
3.3.2 降解产物对氧糖剥夺致大鼠H9C2心肌细胞损伤的保护作用
如图2所示,与对照组相比,氧糖剥夺12 h后模型组细胞存活率显著降低,表明已成功建立氧糖剥夺致H9C2心肌细胞损伤模型。在原花青素的6种降解产物中,ECGT在33 μmol时可以显著提高氧糖剥夺12 h致H9C2心肌细胞损伤的细胞存活率,而降解产物CT和ECT均未见其对氧糖剥夺12 h致H9C2心肌细胞存活率具有改善作用。
通过对氧糖剥夺致神经细胞和心肌细胞损伤两种模型的作用结果可以得出,降解衍生物ECGT对两种模型的细胞损伤均具有显著的改善作用,其活性强于其它两个降解产物CT、ECT。

图1 降解产物对OGD诱导的PC12细胞活力降低的影响Figure 1 Effects of degradation products on OGD-induced reduction of PC12 cell viability###: P<0.001 vs.ctrl, **: P<0.01, ***: P<0.001 vs.model

图2 降解产物对OGD诱导的H9C2细胞活力降低的影响Figure 2 Effects of degradation products on OGD-induced reduction of H9C2 cell viability###: P<0.001 vs.ctrl, ***: P<0.001 vs.model
4 讨论与结论
抗氧化研究方面,6种降解产物的抗氧化活性与其自身化学结构密切相关。总体趋势是母体中的羟基数目越多,其抗氧化能力越强,因此原花青素ECG及其衍生物ECGT的抗氧化活性明显高于非没食子酰基的原花青素C、EC及其衍生物CT、ECT。研究表明,降解衍生物对母体进行修饰,引入带有羟基的化合物,可以增强母体的抗氧化活性。在本课题组的前期研究中,Zhang等[10]采用间苯三酚作为亲核试剂,在酸性条件下葡萄籽高聚原花青素能高效的降解为原花青素单体C、EC、ECG及其间苯三酚衍生物CP、ECP、ECGP。在上述6种降解产物中,连接有间苯三酚(P)的ECGP的抗氧化活性高于其他5种化合物,而相应的衍生物CP、ECP的抗氧化活性也高于其母核C、EC。而本研究中,在母体化合物中引入硫普罗宁甲酯后,其衍生产物的抗氧化活性并没有得到显著加强,这可能与硫普罗宁甲酯的化学结构有关。
氧糖剥夺致细胞损伤的保护作用方面,从新型降解产物CT、ECT和ECGT化学结构看,ECGT的羟基数目最多,说明羟基数目的多少影响对氧糖剥夺致细胞损伤的改善活性。羟基数目越多,其活性越强。在对比母体ECG和降解产物ECGT的活性时发现,在母体ECG没有明显改善作用的浓度下,降解衍生物ECGT对氧糖剥夺后的两种细胞均具有较好的改善作用。从ECG与ECGT的结构分析,引入硫普罗宁甲酯后,新型降解产物ECGT的活性强于母体ECG,说明引入硫普罗宁甲酯也可以增加细胞的存活率。
众所周知,原花青素具有强的抗氧化活性,其对心脑血管具有保护作用[11-13]。亲核试剂硫普罗宁也有减轻阿霉素所致大鼠心肌组织的氧化损伤而达到对心肌组织的保护作用等报道[14]。原花青素-硫普罗宁衍生物的结构特点表明,其有可能成为一种新的抗氧化剂和心脑血管保护剂。本研究以葡萄酒生产过程中的废弃物葡萄籽高聚原花青素为研究对象,采用新型亲核试剂硫普罗宁对其进行降解转化。首次对高聚原花青素的新型降解产物CT、ECT和ECGT的生物活性进行研究。结果表明,3种新型降解产物CT、ECT、ECGT及其母体化合物均具有强抗氧化活性。降解产物对氧糖剥夺致H9C2心肌细胞及PC12神经细胞损伤的保护作用研究中,引入硫普罗宁的新型降解衍生物ECGT对氧糖剥夺损伤后的细胞有显著的改善作用。因此,ECGT等作为原花青素与硫普罗宁加成的降解衍生物,其抗氧化活性可显著的改善细胞损伤活性,即高聚原花青素降解转化为可利用的生物活性物质,为今后葡萄酒废弃物高聚原花青素的开发利用提供又一有效方法。
