氧糖剥夺影响人脐静脉内皮细胞紧密连接相关蛋白的机制研究
2023-02-22李敏甄瑾朱润秀梁子红崔蓝心姚远
李敏,甄瑾,朱润秀,梁子红,崔蓝心,姚远
缺血性脑血管病是临床常见病、多发病,其发病率、致残率、复发率及死亡率较高,给患者家庭及社会带来了沉重的经济负担[1-2]。研究表明,脑梗死后的血管再通、局部血流恢复不仅会引起血脑屏障(blood brain barrier,BBB)结构及功能破坏,且损伤的BBB也会再次加重缺血脑组织损伤,形成恶性循环[3]。既往研究表明,紧密连接相关蛋白变化将导致BBB功能改变,其中Claudin-5和Occludin是两个重要的紧密连接相关蛋白[4]。ZO-1是与紧密连接相关蛋白功能相关的主要胞质蛋白,其可以使Claudin-5和Occludin与肌动蛋白细胞骨架连接,进而构成跨膜蛋白复合体[5]。基质金属蛋白酶(matrix metalloproteinase,MMP)-9可直接降解细胞外基质,导致BBB破坏,与脑组织损伤密切相关[6]。研究表明,排斥导向分子(repulsive guidance molecules,RGM)a可通过细胞分裂周期蛋白42(cell division cycle protein 42,CDC42)而调控丝状伪足,而紧密连接相关蛋白Occludin、ZO-1、Claudin-5水平改变与细胞骨架蛋白及肌动-肌球微细纤维系统的调控关系密切[7]。本研究旨在探究氧糖剥夺影响人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)紧密连接相关蛋白的机制,以期为缺血性脑血管病的临床防治提供新的思路。
1 材料与方法
1.1 主要实验试剂与仪器 实验试剂:DMEM购于Corning公司(货号:R10-017-CV),Gibco®胎牛血清(fetal bovine serum,FBS)购于Invitrogen(货号:16000-044),青霉素-链霉素溶液(100×)购于Gibco公司(货号:15140122),兔抗CDC42抗体(货号:ab187643)、兔抗Claudin-5抗体(货号:ab131259)、兔抗MMP-9抗体(货号:ab38898)、兔抗RGMa抗体(货号:ab169761)、兔抗ZO-1抗体(货号:ab214228)均购于Abcam公司,鼠抗GAPDH抗体购于Proteintech公司(货号:60004-1-lg),羊抗兔二抗购于Beyotime(货号:A0208),抗β-actin抗体购于Proteintech公司(货号:66009-1-Ig),山羊抗鼠二抗购于翌圣生物科技(上海)股份有限公司(货号:33A212ES60),Fluoroshield 封固剂(含DAPI)购于Abcam公司(货号:ab104139)。实验仪器:细胞二氧化碳培养箱购于SANYO公司(货号:MCO-175),离心机购于Thermo Scientific公司(货号:Fresco 21),化学发光成像仪购于Millipore公司。
1.2 实验时间 本实验时间为2021年5月至2022年1月。
1.3 氧糖剥夺模型制备 HUVEC来自上海懿贝瑞生物医药科技有限公司细胞库。在细胞二氧化碳培养箱中,使用含Gibco®FBS和青霉素-链霉素溶液(100×)的DMEM培养基进行细胞培养。制备氧糖剥夺模型:将正常培养的HUVEC按3×105个/孔铺于6孔板,24 h后生长密度达到80%~85%,采用移液枪吸去培养基,加入2 ml 1×PBS清洗1遍,吸掉PBS,换成无糖DMEM培养基(含10% FBS、1%青霉素-链霉素溶液),置于缺氧培养箱(向箱室内充入95% N2和5% CO2,将气流自动控制为20 L/min,约4 min后箱室被完全充满,切断气体来源,关上白色塑料钳夹以紧闭箱室,最后将箱室置于37 ℃环境下温育)培养,制备氧糖剥夺模型;氧糖剥夺后,弃去无糖DMEM培养基,置于含1% FBS、1%PBS的DMEM高糖培养基中,培养24 h。
1.4 细胞形态观察及细胞增殖水平检测 将HUVEC分为正常组和氧糖剥夺6 h组、氧糖剥夺24 h组。正常组HUVEC进行正常培养;氧糖剥夺6 h组HUVEC制备氧糖剥夺模型,并在缺氧培养箱中培养6 h;氧糖剥夺24 h组HUVEC制备氧糖剥夺模型,并在缺氧培养箱中培养24 h。在倒置显微镜下观察HUVEC的形态并拍照。然后分别在96孔板中接种3组细胞悬液(100 μl/孔),向每孔加入10 μl CCK-8溶液孵育,孵育1、2、3、4 d时,采用酶标仪测定450 nm处的吸光度,制成标准曲线,记录细胞增殖水平。
1.5 RGMa敲减质粒的构建 将shRNA序列(RGMa靶点序列:GTGTGTGGACCAGAAGGTGTA)连接至骨架质粒大肠杆菌感受态细胞Top10 LV-002(YBR,YBRLV002)载体中,酶切位点1为EcoR 5-'GAATTC-3',酶切位点2为AgeI 5-'ACCGGT-3',载体连接使用T4 DNA Ligase(EL0016,Fermentas)完成,质粒载体构建成功后进行测序分析,如质粒序列与预设序列一致、测序结果为单一峰,则提示该病毒可敲低RGMa。质粒转化与克隆:采用热激法将质粒转入大肠杆菌感受态细胞Top10(酶康GTC,GTCBC-G001),平板筛选培养,单克隆扩大培养并提取高纯度的质粒DNA。
1.6 慢病毒转染 将RGMa敲减质粒包装成慢病毒,准备HUVEC,复苏HUVEC并进行慢病毒转染:慢病毒转染前18~24 h,将贴壁细胞以1×106个/孔铺到6孔板中培养,使细胞在慢病毒转染时的数量为2×106个/孔左右。第2天用含6 μg/ml polybrene的新鲜培养基2 ml替换原培养基,加入适量病毒悬液,于37 ℃环境下孵育;继续培养24 h,采用新鲜培养基替换含有病毒的培养基,继续培养48~72 h,荧光显微镜下观察转染率达到80%以上,表明慢病毒转染成功。
1.7 Western blot法检测RGMa、紧密连接相关蛋白、MMP-9、CDC42 将HUVEC分为氧糖剥夺组、空质粒组、RGMa质粒敲减组。氧糖剥夺组HUVEC制备氧糖剥夺模型,并在缺氧培养箱中培养24 h;空质粒组HUVEC在氧糖剥夺组基础上,转染空载体;RGMa质粒敲减组HUVEC在氧糖剥夺组基础上,转染慢病毒。然后从培养箱中取出HUVEC,弃去细胞培养液,PBS洗涤1次;弃去PBS,加入细胞裂解液,置于4 ℃冰上;采用移液枪头吹打至细胞充分裂解,将细胞裂解样品转移至离心管,冰上继续裂解10~15 min;离心(4 ℃,12 000 r/min,离心半径10 cm)10 min,取上清液并转移到新的离心管中,加入Loading Buffer(100 ℃,20 min)后再次离心(4 ℃,12 000 r/min,离心半径10 cm)1 min,于-20 ℃环境中保存备用。行SDSPAGE,将蛋白转印到PVDF膜上;加入5%脱脂牛奶,室温封闭1 h,加入一抗兔抗CDC42抗体(1∶3 000)、一抗兔抗Claudin-5抗体(1∶1 000)、一抗兔抗MMP-9抗体(1∶1 000)、一抗兔抗RGMa抗体(1∶5 000)、一抗兔抗ZO-1抗体(1∶2 000)及一抗鼠抗GAPDH抗体(1∶30 000),室温孵育2 h;TBST洗膜3次,10 min/次;加入辣根过氧化物酶-羊抗兔二抗(1∶3 000),室温孵育1 h;TBST洗膜3次,10 min/次。使用化学发光成像仪进行化学发光显色,检测RGMa、Claudin-5、ZO-1、MMP-9及CDC42。
1.8 统计学方法 采用SPSS 23.0统计学软件进行数据处理。计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;两组间比较采用成组t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 氧糖剥夺对细胞形态的影响 与正常组相比,氧糖剥夺6 h组、氧糖剥夺24 h组细胞体肿胀或变形,光晕消失,细胞边缘不清晰,细胞体内出现空泡,突起缩短,连接断裂,视野内颗粒样物质增多,细胞变形,见图1。

图1 正常组、氧糖剥夺6 h组、氧糖剥夺24 h组细胞形态(×200)Figure 1 Cell morphology in the normal group,oxygen glucose deprivation 6 h group and oxygen glucose deprivation 24 h group
2.2 氧糖剥夺对细胞增殖水平的影响 孵育1、2、3、4 d,正常组和氧糖剥夺6 h组细胞增殖水平比较,差异无统计学意义(P>0.05);孵育1、2、3、4 d,氧糖剥夺24 h组细胞增殖水平均低于正常组,差异有统计学意义(P<0.05),见表1~2。
表1 正常组和氧糖剥夺6 h组孵育不同时间细胞增殖水平比较(±s,n=3)Table 1 Comparison of cell proliferation levels between normal group and oxygen glucose deprivation 6 h group at different time of incubation
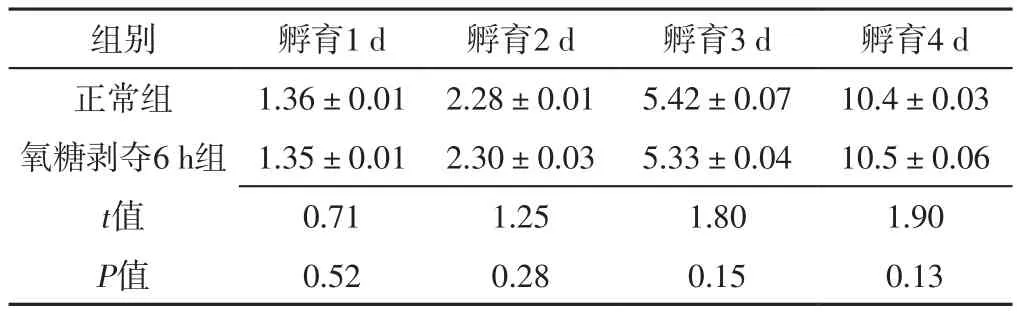
表1 正常组和氧糖剥夺6 h组孵育不同时间细胞增殖水平比较(±s,n=3)Table 1 Comparison of cell proliferation levels between normal group and oxygen glucose deprivation 6 h group at different time of incubation
组别 孵育1 d 孵育2 d 孵育3 d 孵育4 d正常组 1.36±0.01 2.28±0.01 5.42±0.07 10.4±0.03氧糖剥夺6 h组 1.35±0.01 2.30±0.03 5.33±0.04 10.5±0.06 t值 0.71 1.25 1.80 1.90 P值 0.52 0.28 0.15 0.13
表2 正常组和氧糖剥夺24 h组不同时间细胞增殖水平比较(±s,n=3)Table 2 Comparison of cell proliferation levels between normal group and oxygen glucose deprivation 24 h group at different time of incubation
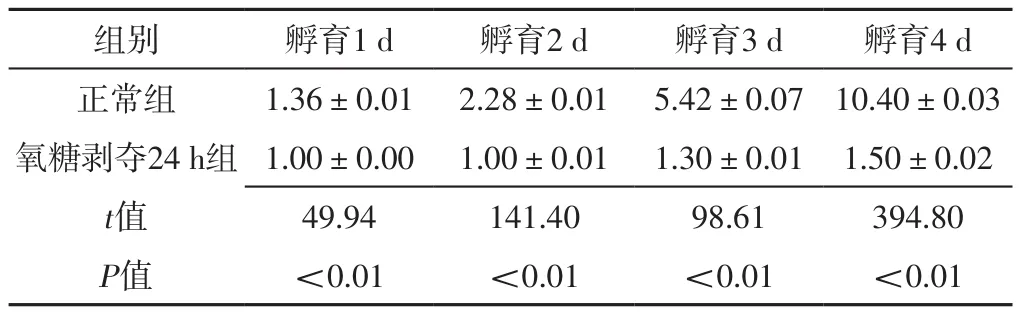
表2 正常组和氧糖剥夺24 h组不同时间细胞增殖水平比较(±s,n=3)Table 2 Comparison of cell proliferation levels between normal group and oxygen glucose deprivation 24 h group at different time of incubation
组别 孵育1 d 孵育2 d 孵育3 d 孵育4 d正常组 1.36±0.01 2.28±0.01 5.42±0.07 10.40±0.03氧糖剥夺24 h组 1.00±0.00 1.00±0.01 1.30±0.01 1.50±0.02 t值 49.94 141.40 98.61 394.80 P值 <0.01 <0.01 <0.01 <0.01
2.3 RGMa质粒敲减对RGMa、紧密连接相关蛋白、MMP-9、CDC42的影响 氧糖剥夺组、空质粒组、RGMa质粒敲减组RGMa、Claudin-5、ZO-1、MMP-9、CDC42比较,差异有统计学意义(P<0.05);氧糖剥夺组和空质粒组RGMa、Claudin-5、CDC42比较,差异无统计学意义(P>0.05);空质粒组ZO-1、MMP-9低于氧糖剥夺组,差异有统计学意义(P<0.05);RGMa质粒敲减组RGMa、ZO-1、CDC42低于氧糖剥夺组,Claudin-5、MMP-9高于氧糖剥夺组,差异有统计学意义(P<0.05),见表3。
表3 氧糖剥夺组、空质粒组、RGMa质粒敲减组RGMa、紧密连接相关蛋白、MMP-9、CDC42比较(±s,n=3)Table 3 Comparison of RGMa,tight junction-related protein,MMP-9 and CDC42 in the oxygen glucose deprivation group,empty plasmid group,RGMa plasmid knockdown group
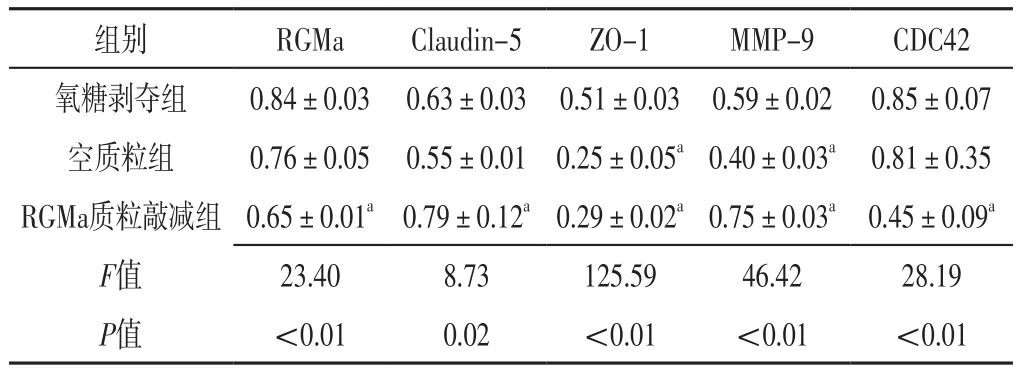
表3 氧糖剥夺组、空质粒组、RGMa质粒敲减组RGMa、紧密连接相关蛋白、MMP-9、CDC42比较(±s,n=3)Table 3 Comparison of RGMa,tight junction-related protein,MMP-9 and CDC42 in the oxygen glucose deprivation group,empty plasmid group,RGMa plasmid knockdown group
注:RGM=排斥导向分子,MMP=基质金属蛋白酶,CDC42=细胞分裂周期蛋白42;a表示与氧糖剥夺组比较,P<0.05
组别 RGMa Claudin-5 ZO-1 MMP-9 CDC42氧糖剥夺组 0.84±0.03 0.63±0.03 0.51±0.03 0.59±0.02 0.85±0.07空质粒组 0.76±0.05 0.55±0.01 0.25±0.05a0.40±0.03a 0.81±0.35 RGMa质粒敲减组 0.65±0.01a0.79±0.12a0.29±0.02a0.75±0.03a 0.45±0.09a F值 23.40 8.73 125.59 46.42 28.19 P值 <0.01 0.02 <0.01 <0.01 <0.01
3 讨论
在发达国家,缺血性脑卒中是仅次于癌症和心脏病的第三大死亡原因,脑缺血/再灌注导致细胞损伤的机制比较复杂。脑血管内皮细胞及其之间的紧密连接、基底膜、周细胞及星形胶质细胞是BBB的结构基础,BBB的结构和功能完整性是维持大脑内环境稳定的重要保障[8]。近年越来越多的证据表明,BBB功能障碍和内皮细胞炎症参与了脑缺血/再灌注损伤的病理过程[9]。BBB功能障碍使大量炎症因子如肿瘤坏死因子α、肿瘤坏死因子β、白介素1、白介素6及其他有害物质进入大脑,进而加重脑损伤[3];而维持BBB的完整性是保护大脑免受脑缺血损伤的关键措施。目前,脑缺血/再灌注损伤后BBB功能障碍的分子机制尚不清楚。血管内皮细胞间紧密连接是维持血管通透性和机械屏障的重要结构基础,胞质附着蛋白家族中ZO-1和跨膜蛋白Occludin、Claudin-5是BBB紧密连接的主要组分,也是研究BBB结构及功能变化的重要指标。
HUVEC是一种具有完整内皮屏障功能的人源内皮细胞,是研究BBB功能的一种理想的内皮细胞模型[10]。因此,本研究采用HUVEC构建氧糖剥夺模型,结果显示,孵育1、2、3、4 d,正常组和氧糖剥夺6 h组细胞增殖水平比较差异无统计学意义,但氧糖剥夺24 h组细胞增殖水平均低于正常组,且氧糖剥夺24 h组细胞形态发生了明显改变,提示氧糖剥夺24 h模拟脑缺血缺氧效果较好。
在成年神经系统中RGMs具有多种生物学活性,其可以参与调节细胞形态和免疫系统、抑制新生血管形成及调控BBB通透性、多种肌动蛋白运动、细胞骨架重组等细胞生理代谢过程[11]。此外,RGMa作为一种新的轴突分子,其主要作用是调控神经元的分化、增殖等[12]。研究表明,RGMa可以通过Rho激酶和GSK-3β信号通路而使脑衰反应调节蛋白2(collapsin response mediator protein 2,CRMP-2)磷酸化,进而抑制轴突生长[13]。Rho激酶和CDC42均属于Ras超家族成员,其中CDC42能结合鸟嘌呤三核苷酸,在哺乳动物细胞信号转导系统中发挥着“分子开关”样的重要作用,且对细胞骨架的动态变化具有重要调节作用[14]。血管内皮之间紧密连接相关蛋白发生改变可引起BBB的结构变化,而RGMa可以通过RhoA或CDC42而影响BBB的紧密连接[15]。既往实验表明,腺病毒载体诱导的RGMa沉默可减轻大脑中动脉闭塞/再灌注大鼠BBB功能障碍[9]。RGMa及其受体Neogenin在大鼠脑缺血/再灌注损伤后皮质神经元及血管内皮上表达,可影响梗死灶周围皮质血管再生[16]。BBB的完整性可由紧密连接相关蛋白维持,而Claudin-5和ZO-1在封闭紧密连接和维持BBB完整性方面起着至关重要的作用,缺血损伤可导致Claudin-5和ZO-1明显减少[17]。MMP是体内重要的细胞外基质降解酶,既往研究表明,在缺血性脑组织中MMP-9表达增加及活性增强,并通过降解细胞外基质而提高BBB的通透性[18]。鉴于Claudin-5、ZO-1及MMP-9在影响BBB通透性中的关键作用,本实验构建RGMa敲减质粒,并将其包装成慢病毒后转染HUVEC,结果显示,RGMa质粒敲减组RGMa、ZO-1、CDC42低于氧糖剥夺组,Claudin-5高于氧糖剥夺组,提示RGMa质粒敲减后CDC42和ZO-1表达下调,Claudin-5表达上调,推测氧糖剥夺引起HUVEC紧密连接相关蛋白改变的机制可能与RGMa影响CDC42蛋白有关。既往研究显示,缺血损伤可导致Claudin-5明显减少[17],而本研究结果显示氧糖剥夺可导致Claudin-5表达上调,分析原因可能与RGMa干预或CDC42有关,仍需要动物实验进一步验证。本研究结果还显示,空质粒组MMP-9低于氧糖剥夺组,RGMa质粒敲减组MMP-9高于氧糖剥夺,提示MMP-9降低与转染空载体有关。
综上所述,氧糖剥夺24 h可引起HUVEC增殖水平降低,氧糖剥夺引起HUVEC紧密连接相关蛋白改变的机制可能为RGMa通过CDC42而影响BBB的紧密连接,这对于探究脑缺血损伤患者BBB功能障碍机制具有重要意义。
作者贡献:姚远进行文章的构思与设计,负责文章的质量控制及审校,并对文章整体负责、监督管理;李敏、梁子红进行研究的实施与可行性分析;李敏、甄瑾、梁子红、崔蓝心进行数据收集、整理、分析;甄瑾、朱润秀进行结果分析与解释;李敏、姚远负责撰写、修订论文。
本文无利益冲突。
