人网膜脂肪源性干细胞对卵巢癌细胞增殖迁移侵袭的影响
2020-10-28焦伊胜王诗卓马宁耶张以薇
余 璐,焦伊胜,王诗卓,马宁耶,柳 祎,张以薇
(中国医科大学附属盛京医院妇产科,辽宁 沈阳 110004)
卵巢癌是常见的妇科恶性肿瘤之一,其死亡率居女性生殖系统恶性肿瘤之首。卵巢位于盆腔深部,早期病变不易发现,大多数患者就诊时已处于晚期,51%的患者为国际妇产科联盟(international federation of gynecology and obstetrics,FIGO)分期的Ⅲ期、29%的患者为FIGO Ⅳ期,而FIGO Ⅳ期患者生存率仅为27%[1]。晚期卵巢癌患者易发生广泛盆腹腔播散转移,且易对化疗产生耐药,临床治疗困难。因此,研究卵巢癌的转移机制对提高患者生存率,改善患者预后有着重要意义。肿瘤微环境是由肿瘤细胞与其周围局部浸润的免疫细胞、间质细胞及所分泌的活性物质等共同构成[2]。肿瘤的发生发展不仅取决于“种子”本身,即癌细胞的分子特征,还取决于“土壤”即肿瘤微环境成分的相互作用。近年研究发现[3],肿瘤细胞可以募集包括间充质干细胞(mesenchymal stem cells, MSCs)在内的细胞进入肿瘤微环境发挥作用。脂肪源性干细胞(adipose derived stem cells,ADSCs)是间充质干细胞家族的重要成员,ADSCs已被证明参与多种肿瘤细胞的增殖、迁移及侵袭过程[4]。有报道ADSCs通过旁分泌方式影响Wnt信号通路增强结肠癌细胞的转移能力[5]。本研究应用Transwell小室共培养ADSCs和卵巢癌细胞,模拟其在肿瘤微环境中的作用,观察并研究共培养前后卵巢癌细胞增殖、迁移和侵袭特性的变化情况,探索ADSCs在卵巢癌发展进程中的潜在作用机制,为卵巢癌的治疗提供新方向。
1 材料与方法
1.1 材料脂肪组织取自中国医科大学附属盛京医院第二妇科良性肿瘤手术患者,排除肝炎、梅毒等疾病,遵循知情同意原则,本研究通过中国医科大学附属盛京医院伦理委员会批准(伦理编号:2019PS523K);人卵巢癌细胞株(Caov-3、OVCAR-3)购于上海中科院。
1.2 主要仪器流式细胞仪(美国BD,型号FACS Aria);光吸收酶标仪(美国Bio-Tek,型号ELX808IU);垂直电泳仪及转印仪(北京百晶生物科技有限公司);激光扫描共聚焦显微镜(日本Nikon,型号C1);恒温振荡器(美国Crystal,型号IS-RDV1)。
1.3 主要试剂胎牛血清(fetal calf serum,FBS)、DMEM/F12培养基、DMEM高糖培养基、RPMI 1640培养基、磷酸缓冲盐溶液(phosphate buffer saline,PBS;以色列BI公司,货号分别为04-001-1ACS、01-172-1ACS、06-1055-57-1ACS、01-100-1ACS、02-024-1ACS);Ⅰ型胶原酶、红细胞裂解液(北京Solarbio公司,货号分别为C8140、R1010);胰酶细胞消化液(碧云天,C0201);StemflowTMHuman MSC Analysis Kit(美国BD公司,562245);成脂、成骨诱导分化培养基(美国Cyagen公司,货号分别为HUXMD-90031、HUXMD-90021);CCK-8试剂盒(日本Dojindo公司,CK04);Transwell共培养体系6孔板及24孔板(美国Corning公司,货号分别为3414、3422);聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF;美国Millipore公司,ISEQ00010);β-catenin抗体(美国Cell Signaling公司,8480T);SALL4抗体(英国Abcam公司,ab57577);XAV-939(美国Selleck公司,S1180)。
1.4 ADSCs的分离、培养将收集的脂肪组织置于装有无菌PBS的离心管中4 ℃保存,4 h内进行分离提取。在超净台中用加双抗的PBS清洗脂肪组织,去除血管后剪碎组织,约1 mm3大小,加入1 g·L-1的Ⅰ型胶原酶,于37 ℃恒温震荡水浴锅中消化1 h,离心后收集下层液体,加入红细胞裂解液吹打重悬细胞沉淀物,室温静置10 min,离心后弃上层液体,加入含10% FBS的DMEM/F12培养基重悬细胞,100目钢筛过滤,1 000 r·min-1离心5 min后弃上清,重新加入含10% FBS的DMEM/F12培养基重悬细胞,接种于25 cm2培养瓶中,置于37 ℃、5% CO2孵育箱中培养。每2~3 d换液1次,待细胞生长融合至80%~90%,用含0.25%乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)的胰蛋白酶消化,按1 ∶ 3比例传代,培养至P3~P6代用做后续实验。
1.5 ADSCs细胞表型鉴定常规消化收集ADSCs,PBS重悬,调整细胞密度为1×109个·L-1分装至EP管中,300×g离心5 min弃上清,PBS重悬细胞,移至标记好的流式管中,按试剂盒操作加入对应试剂,室温避光孵育30 min,300×g离心5 min弃上清,加入含5% FBS的PBS重悬,重复本操作1次,流式细胞仪检测细胞表面标志物。
1.6 ADSCs体外成脂、成骨诱导分化鉴定成脂诱导分化鉴定:常规消化收集ADSCs接种于6孔板中,待细胞融合至100%或过融合,弃原培养基加入成脂诱导分化培养基A液,诱导72 h后弃A液,加入成脂诱导分化培养基B液,24 h后弃B液换回A液继续诱导,A、B液交替作用3~5次继续用B液维持4~7 d,直到脂滴变得足够大圆。诱导12~20 d后,用4%多聚甲醛固定细胞,加入油红O染液染色30 min,显微镜下观察成脂染色效果。成骨诱导分化鉴定:常规消化收集ADSCs接种于6孔板中,待细胞融合至60%~70%,弃原培养基加入成骨诱导分化培养基,每72 h换液1次,诱导14~21 d后固定细胞,加入茜素红染液染色,显微镜下观察成骨染色效果。
1.7 共培养体系构建于Transwell小室6孔板的上室接种ADSCs,下室分别接种卵巢癌Caov-3和OVCAR-3细胞,共同培养72 h后收集下室癌细胞用于后续实验。上下室均加入相同批次相同浓度的DMEM/F12完全培养基,以排除血清及培养基对卵巢癌细胞的影响。
1.8 CCK-8增殖实验收集共培养前后的卵巢癌Caov-3和OVCAR-3细胞,分别接种于96孔板中,每孔5 000个细胞,置于37 ℃、5% CO2孵育箱中培养1~4 d。到达指定培养时间,每孔加入10 μL CCK-8溶液,继续置于孵育箱中孵育3 h,然后酶标仪检测450 nm处的吸光度,计算细胞增殖活力。
1.9 划痕实验常规消化收集共培养前后的卵巢癌细胞,制备密度为5×108个·L-1的细胞悬液接种于6孔板中,待细胞长满后,用200 μL进口移液器tip头紧贴直尺在每个孔中力度均匀地划“井”字,PBS清洗去除划落细胞,加入无血清DMEM/F12培养基,置于37 ℃、5% CO2孵育箱中培养24 h,分别在划痕后0 h和24 h观察拍照,用ImageJ软件计算伤口愈合率。
1.10 Transwell侵袭实验4 ℃过夜融化基质胶,用无血清的DMEM/F12培养基稀释Matrigel至终浓度为1 g·L-1,在上室底部中央垂直加入100 μL稀释的Matrigel,37 ℃温育6~8 h使其凝成胶状。常规消化收集共培养前后的Caov-3和OVCAR-3细胞,用无血清DMEM/F12培养基制备密度为1×108个·L-1的细胞悬液,取100 μL悬液接种于Transwell上室,24孔板下室加入600 μL含20% FBS的DMEM/F12培养基,置于37 ℃、5% CO2孵育箱中培养24 h后取出小室,4%多聚甲醛固定,0.1%结晶紫染色液染色,用棉签擦去上室内未穿膜细胞,显微镜下随机观察6个视野并拍照计数。
1.11 细胞免疫荧光双标实验常规消化收集共培养后的卵巢癌OVCAR-3细胞,制备密度为1×107个·L-1的细胞悬液,接种于放有无菌玻片的12孔板中,用含10% FBS的DMEM/F12培养基培养48 h,4%多聚甲醛固定30 min并用0.3% Triton X-100室温通透10 min,随后加入不同种属的一抗,4 ℃湿盒中孵育过夜。次日吸去一抗,PBS清洗,加入对应种属不同荧光颜色的荧光二抗室温避光孵育1 h,随后加入4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)避光孵育5 min复染,PBS清洗后取出细胞爬片,用含抗荧光猝灭剂的封片液封片,在共聚焦显微镜下随机选取6个视野观察并拍照,通过ImageJ软件分析结果。
1.12 XAV-939处理收集共培养后的OVCAR-3细胞,在培养基中加入20 mmol·L-1XAV-939继续培养24 h,采用CCK-8法检测细胞增殖(方法同1.8)、划痕实验检测细胞迁移(方法同1.9)和Transwell实验检测细胞侵袭(方法同1.10)。
1.13Westernblot收集共培养前后的卵巢癌细胞总蛋白,用BCA法定量,变性后以40 μg总蛋白进行8%或10%聚丙烯酰胺凝胶电泳,转至PVDF膜上,5%脱脂牛奶封闭2 h,孵育一抗,设置内参为甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH),4 ℃摇床过夜,洗膜后二抗室温孵育2 h,增强化学发光法显色拍照。
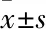
2 结果
2.1 ADSCs细胞形态及鉴定原代ADSCs显微镜下呈细长梭形,贴壁生长,具有典型的成纤维细胞形态(Fig 1A)。流式结果与国际细胞治疗协会(international society for cellular therapy,ISCT)定义的人间充质干细胞的最低标准[6]一致,该细胞群阳性表达CD105、CD73和CD90(≥95%阳性),阴性表达CD45、CD34、CD11b、CD19和HLA-DR(≤2%阳性)(Fig 1B)。在成脂诱导d 21油红O染色可见大而圆的脂滴(Fig 1C),成骨诱导d 14茜素红染色可见矿化结节沉积(Fig 1D),表明分离提取的ADSCs具有成脂、成骨分化能力。
2.2 ADSCs对共培养后的Caov-3和OVCAR-3细胞增殖的影响(CCK-8法)ADSCs与卵巢癌细胞共培养后,通过CCK-8实验观察细胞增殖能力变化。结果(Fig 2A,2B)显示,相比于对照组,共培养后的Caov-3和OVCAR-3细胞增殖活力较强(P<0.05),表明ADSCs能增强卵巢癌细胞的增殖能力。

Fig 1 Characterization of adipose derived stem cells

Fig 2 Co-culture with ADSCs on proliferation in Caov-3 and OVCAR-3

Fig 3 Co-culture with ADSCs on migration in Caov-3 and OVCAR-3
2.3 ADSCs对共培养后的Caov-3和OVCAR-3细胞迁移的影响(划痕实验)ADSCs与卵巢癌细胞共培养后,通过划痕实验检测细胞迁移能力。结果显示,与对照组相比,经共培养处理可升高Caov-3(Fig 3A)和OVCAR-3(Fig 3B)细胞的划痕愈合百分比(P<0.01),提示ADSCs能增强卵巢癌细胞的迁移能力。
2.4 ADSCs对共培养后的Caov-3和OVCAR-3细胞侵袭的影响(Transwell侵袭实验)ADSCs与卵巢癌细胞共培养后,通过Transwell侵袭实验了解细胞侵袭情况。结果显示,实验组穿过的Caov-3(Fig 4A)和OVCAR-3(Fig 4B)细胞数更多,差异有统计学意义(P<0.01),提示ADSCs能增强卵巢癌细胞的侵袭能力。
2.5 Wnt/β-catenin信号通路参与ADSCs促进卵巢癌的作用Western blot结果(Fig 5A)表明,与未处理的Caov-3和OVCAR-3细胞相比,与ADSCs共培养后的Caov-3和OVCAR-3细胞中β-catenin表达水平上调。应用Wnt/β-catenin信号通路抑制剂XAV-939处理共培养后的OVCAR-3细胞,结果提示经XAV-939处理的细胞增殖(Fig 5B)、迁移(Fig 5C)及侵袭(Fig 5D)能力明显低于未经XAV-939处理组(P<0.01)。深入研究发现,与ADSCs共培养的OVCAR-3细胞中SALL4蛋白表达升高(Fig 5E);细胞免疫荧光双标实验显示,在与ADSCs共培养的卵巢癌OVCAR-3细胞的胞核和胞质中可见β-catenin和SALL4共表达;通过ImageJ软件定量分析处理得到共定位散点图、共定位数据Pearson系数和重叠系数,均证明存在共定位(Fig 5F)。
3 讨论
早在1889年,Stephen Paget就提出“种子与土壤”假说,认为肿瘤转移依赖于肿瘤细胞(“种子”)与肿瘤微环境(“土壤”)之间的信息交互作用。MSCs位于肿瘤微环境中,可被募集到肿瘤部位,通过直接细胞接触或分泌的相关活性物质如生长因子、趋化因子、外泌体等发生间接作用[7]。越来越多研究表明,ADSCs可通过增加肿瘤细胞干性、介导迁移、促进血管生成、抑制免疫反应和诱导耐药,对肿瘤的发生发展进程产生影响[8]。然而,ADSCs与卵巢癌细胞之间分子串扰复杂,潜在作用机制研究较少。
本实验原代培养的ADSCs提取于人网膜脂肪组织,通过细胞形态、干细胞表面标记物、成脂成骨诱导分化实验,鉴定其符合MSCs的表型特征并具有多向分化的潜能。传代培养ADSCs至3~6代与人卵巢癌Caov-3和OVCAR-3细胞共培养,应用CCK-8实验、划痕实验、Transwell侵袭实验分析发现共培养后的卵巢癌细胞增殖、迁移及侵袭能力增强,这些结果提示ADSCs可能在卵巢癌的进展中起促进作用。β-catenin是经典Wnt信号通路的核心成分,也是调节多种细胞功能的关键分子[9]。为进一步探索ADSCs如何发挥作用,应用Western blot检测到β-catenin表达上调;通过XAV-939抑制Wnt/β-catenin通路后,经共培养处理的OVCAR-3细胞增殖迁移及侵袭能力同样受到抑制。这一结果表明ADSCs在体外促进卵巢癌细胞的恶性进程,可能涉及Wnt/β-catenin信号通路的激活。
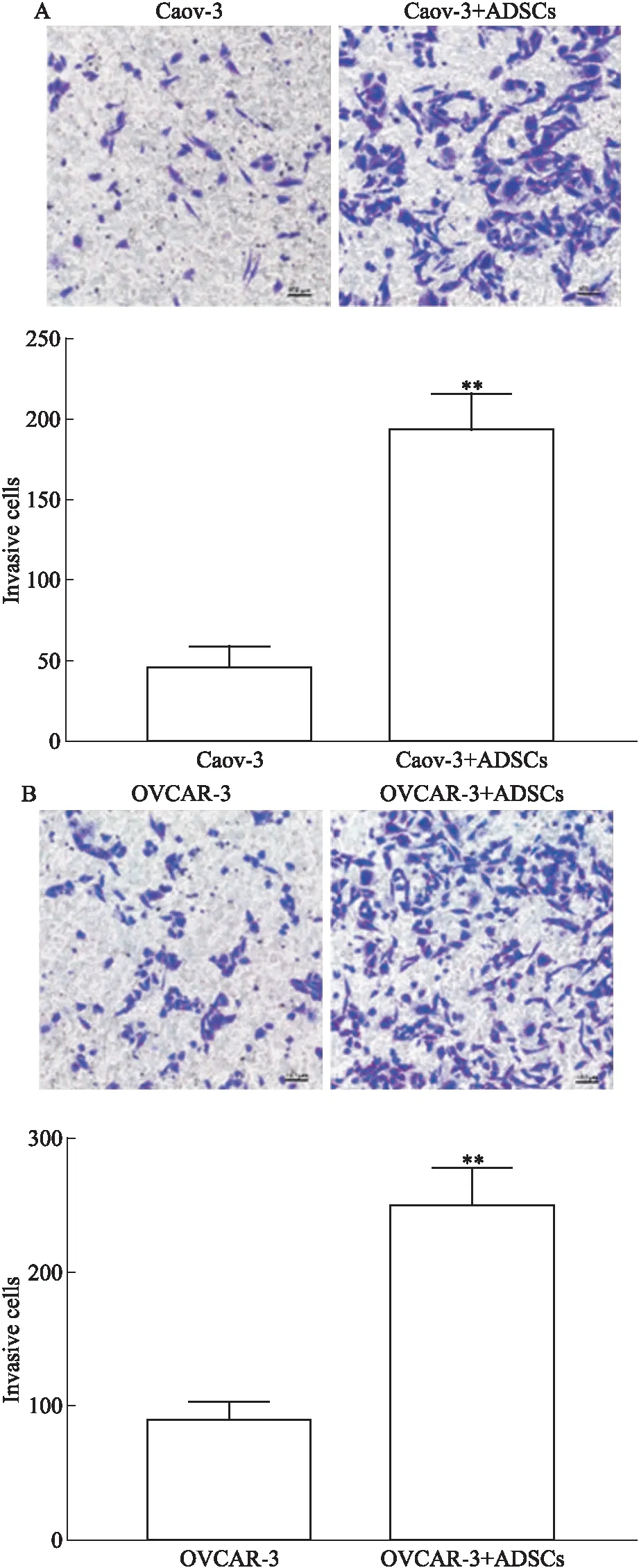
Fig 4 Co-culture with ADSCs on invasion in Caov-3 and OVCAR-3
Fig 5 Wnt/β-catenin signaling pathway involved in role of ADSCs in ovarian cancer cells A: The expression of β-catenin in Caov-3 and OVCAR-3 cells was detected by Western blot; B: After treating with XAV-939,the proliferation of OVCAR-3 cells co-cultured with ADSCs was analyzed by CCK-8 assay; C: After treating with XAV-939, the migration of OVCAR-3 cells co-cultured with ADSCs was measured by Wound healing assay; D: After treating with XAV-939,the invasion of OVCAR-3 cells co-cultured with ADSCs was detected by Transwell invasion assay; E: The level of SALL4 protein was measured by Western blot; F: The co-localization of SALL4 and β-catenin in nuclei and cytoplasm.*P<0.05,**P<0.01 vs control group.
有报道,在对骨髓增生异常综合征患者的研究中发现Wnt/β-catenin途径下游靶基因的激活与SALL4的表达密切相关[10];SALL4可与β-catenin相互作用激活Wnt通路,促进急性髓系白血病的发生发展[11]。SALL4是维持胚胎干细胞和造血干细胞自我更新和多能性的重要转录因子[12];随着组织器官成熟,SALL4表达逐渐降低,在各种类型的恶性肿瘤细胞中又重新表达[13]。进一步研究显示,共培养后的OVCAR-3细胞中SALL4蛋白表达升高,双荧光标记实验显示,SALL4与β-catenin共定位于细胞核和细胞质。SALL4在正常组织中充当“看守基因”[14],起转录因子的作用时主要定位于细胞核;β-catenin主要位于细胞膜,与E钙粘蛋白形成粘附连接,由于不同的亚细胞定位,两者之间不会相互影响。在卵巢癌发生发展进程中,肿瘤微环境中的ADSCs通过旁分泌的方式上调OVCAR-3细胞中SALL4的表达,Wnt/β-catenin信号通路异常激活,β-catenin降解受抑制,积聚在细胞质中[15],后转位至细胞核与SALL4相互作用促进肿瘤进展。其中,ADSCs可能通过分泌多种类型细胞因子,例如白介素6(interleukin-6)、白介素10(interleukin-10)、转化生长因子-β(transforming growth factor-β)等[16,17]作用于卵巢癌细胞促进SALL4的表达,本研究尚未涉及,待后续实验继续跟进。
综上,本研究表明ADSCs在体外参与卵巢癌的进展,能促进卵巢癌细胞的增殖、迁移及侵袭能力,可能涉及Wnt/β-catenin信号通路,且可能与SALL4相关,为卵巢癌的临床治疗提供了新的思路。