槲皮素固体脂质纳米粒对Aβ25-35损伤的PC12细胞雌激素样神经保护作用的研究
2020-10-28郭童林甄艳杰赵雨薇沈丽霞
郭童林,甄艳杰,赵雨薇,沈丽霞
(河北北方学院药学系,河北省神经药理学重点实验室,河北 张家口 075000)
槲皮素(quercetin,Que)来源广泛,可以从多种植物的花、叶、果实以及加工产品中获取,具有诸多药理作用[1-3]。本课题组前期研究发现 Que 具有雌激素样作用[4],可增加初生大鼠海马和皮层神经元的突触的数目及长度,促进突触的生长及发生,有望成为雌激素替代品发挥神经保护作用治疗阿尔茨海默症(Alzheimer’s disease,AD)。因槲皮素为黄酮类化合物,难溶于水,在水中的溶解度仅有0.166~7.700 mg·L-1[5]。低的溶解度限制了 Que 的应用[6]。中枢神经系统疾病尤其是 AD 发病率和死亡率高,构成影响全球人类健康的严重问题。目前临床上的治疗药物由于脑的组织和结构复杂,以及血脑屏障的存在,使给药系统难以直接到达中枢神经系统,为克服这些弊端,研究者致力于研究脂质体、聚合物胶束、纳米粒,树枝状大分子等最有可能应用的新型纳米给药系统。文献中已报道关于制备为固体分散体[7]、纳米粒[8]、胶束[9]等剂型的研究,以解决 Que 的溶解性问题。另外,固体脂质纳米粒(solid lipid nanoparticles,SLN)是由天然或人工合成的固态类脂为载体,将药物镶嵌于类脂核或和黏附于类脂的表面制备而成的固体胶粒给药系统,粒径在10~1 000 nm之间[10]。SLN具有延缓药物的释放速度,增加难溶性药物的溶解度的优点。本研究制备槲皮素固体脂质纳米粒(Que-SLN)以增加槲皮素的溶解度,并考察其雌激素样神经保护作用及血脑屏障通透性,为槲皮素的药物新剂型研发和构建有效的脑部药物递送系统提供参考。
1 材料与方法
1.1 材料
1.1.1细胞株 高分化型的PC12细胞,购自中国科学院典型培养物保藏中心昆明细胞库;大鼠脑微血管内皮细胞(RBMEC细胞),美国 Sciencell 公司。
1.1.2药物与试剂 槲皮素(中国药品生物制品检定研究院,纯度98%,批号:100081-200907);单硬脂酸甘油酯(上海源叶生物科技有限公司,批号:s30304);蛋黄卵磷脂(艾伟拓医药科技有限公司,批号:AL17002);泊洛沙姆188(Sigma Aldrich公司,批号:412325);金雀异黄素(中国药品生物制品检定研究院,纯度99.1%,批号:111704-201302);17β-雌二醇(Abcam公司,批号:APN11282-1-1);Aβ25-35(北京博奥森生物技术有限公司,批号:Y-0044); DMEM高糖培养基(HyClone公司,批号:SH30284.01);四季青无噬菌体低内毒素特级胎牛血清(浙江天杭科技公司,批号:11011-8611);噻唑蓝MTT(Sigma公司,批号:1001904782);香豆素-6(Sigma Aldrich 公司,批号:442631);β-actin抗体(Santa Cruz公司,批号:SC47778);抗体ERα(批号:ab32063)、ERβ(批号:ab3576)(均购自Abcam公司);IRDye 800CW羊抗兔二抗(批号:827-08365)。
1.1.3仪器 二氧化碳培养箱(Thermo公司,美国);SW-CJ-1F超净工作台(苏净安泰公司);倒置显微镜(Nikon公司,日本)。Tacan Safire2多功能酶标仪(Tecan公司,瑞士); FV3000共聚焦激光扫描显微镜(Olympus公司,日本);FM0530多色荧光和化学发光成像系统(ProteinSimple公司,美国);SC-3614低速离心机(安徽中科中佳科学仪器有限公司);Mini-PROTEAN®Tetra 电泳槽, Mini Trans-blot转印槽(Bio-Rad公司,美国)。
1.2 方法
1.2.1Que-SLN的制备及理化性质的考察[11]采用熔融超声法制备Que-SLN,以包封率、载药量为指标,单因素分别考察 Que 投药量、GMS/ EPC 的质量比、P188 的含量和超声时间对处方的影响。经L9(34)正交试验优化得制备方法为:称取100 mg单硬脂酸甘油酯(glycerol monostearate,GMS),(78±2) ℃熔融,将 5 mg Que和100 mg蛋黄卵磷脂(egg phosphatidyl choline,EPC)溶于适量的无水乙醇后依次匀速滴加在1000 r·min-1磁力搅拌下的GMS中作油相;称取1%的P188溶于10 mL超纯水中作为水相。将水相加热到(78±2) ℃,以10 r·min-1滴加至油相,磁力搅拌10 min制备成初乳,补充体积为10 mL。将制备完成的初乳在(78±2) ℃的条件下超声5 min,固化,过0.45μm 针孔滤膜,得Que-SLN。并通过透射电镜、Malvern粒度分析仪测得Que-SLN的外观、粒径及电位,上述实验均平行重复3次。
1.2.2细胞培养 PC12细胞用无酚红的DMEM高糖培养基(终浓度为10%胎牛血清、100 kU·L-1的青霉素和0.1 g·L-1的链霉素),置于37 ℃、5% CO2培养箱中培养,隔天更换细胞培养液,待细胞长满(达70%~80%)进行传代培养;大鼠脑微血管内皮细胞( microvascular endothelial cellsin rat brain,RBMEC)在 ECM培养基中(含 5%牛血清,1%青霉素/链霉素混合液、1% 内皮细胞生长因子)培养,置于 37 ℃、5% CO2恒温培养箱中培养,每天换液。
1.2.3体外血脑屏障模型评价 通过建立RBMEC和PC12细胞共培养模型[12](简称RBMEC- PC12),评价 Que-SLN和Que对血脑屏障的通透性,将RBMEC 按 5×107个·L-1接种于12孔板的Transwell 插入池上层小室中。用Millcell@-ERS测定 RBMEC的跨膜电阻值,当跨膜电阻值大于 200 Ω·cm2时进行以下试验。PC12细胞按照 1×107个·L-1于另一12 孔板培养4 h,将跨膜电阻值大于 200 Ω·cm2的Transwell 上层小室转移到铺有PC12细胞的孔中,建立体外 RBMEC-PC12 共培养模型。
共培养24 h后在Transwell 插入池上层加入用完全培养基稀释的50.0 μmol·L-1Que(溶于DMSO)和Que-SLN,孵育 12 h。移去 Transwell 插入池,下层PC12细胞继续培养24 h。以 Transwell 插入池只加入完全培养基组做空白对照组。 MTT法测定各组对PC12细胞的促增殖作用。
1.2.4MTT法检测细胞存活率
1.2.4.1不同浓度Que及Que-SLN对PC12细胞的影响 实验分组:正常对照组(NC)、溶剂对照组(DMSO)、阳性对照药17β-雌二醇组(0.1 μmol·L-117β-E2)、阳性对照药金雀异黄素组(50 μmol·L-1Gen)、不同浓度槲皮素组(3.125、6.25、12.5、25、50、100、200、400 μmol·L-1Que);正常对照组(NC)、辅料组、阳性对照药17β-雌二醇组(0.1 μmol·L-117β-E2)、阳性对照药金雀异黄素组(50 μmol·L-1Gen)、槲皮素固体、脂质纳米粒组(3.125、6.25、12.5、25、50、100、200、400 μmol·L-1Que-SLW)组,加药培养24 h。
1.2.4.2不同药物对PC12细胞损伤模型的影响 实验分组为:正常对照组、Aβ25-3520μmol·L-1组、Aβ25-35+17β-E20.1 μmol·L-1组、Aβ25-35+Gen 50 μmol·L-1组、Aβ25-35+Que-SLN组(50、100、200 μmol·L-1)。
1.2.5免疫荧光染色法检测ERα和ERβ蛋白的表达 取对数期细胞,以2×108个/L的密度接种到激光共聚焦专用的细胞培养皿中,按照“1.2.4.2”项下的分组给药24 h后,弃去原培养基,依次用细胞组织固定液固定30 min,0.2%TritonX-100透化细胞5 min,5%牛血清白蛋白封闭2 h,以上操作均在室温下进行,分别加入一抗ERα(1 ∶ 200)、ERβ(1 ∶ 200)4 ℃孵育13 h,加入Cy3标记的山羊抗兔(1 ∶ 500),孵育1 h,滴加DAPI染色液作用5 min,对细胞核进行复染,激光共聚焦显微镜下观察,拍照,以上操作均在室温避光条件下进行,使用ImageJ 分析结果。
1.2.6Western blot检测雌激素受体蛋白的表达 将PC12 细胞按照8×108个/L接种于培养瓶培养 24 h 后,按照“1.2.4.2”的分组分别作用PC12细胞24 h,按文献[13]所述进行蛋白的提取和 Western blot 相关实验操作,采用多色荧光和化学发光成像系统曝光,并使用 ImageJ 分析条带灰度值。
2 结果
2.1 Que-SLN的理化性质考察结果制备的Que-SLN包封率为(90.54±1.36)%,载药量(4.33±0.06)%,粒径(191.2 3±3.25)nm,电位(-24.40±1.24)mV,外观呈球形,形态较圆整,大小均一,见Fig 1~3。

Fig 1 Transmission electron microscopy imageof Que-SLN(×20 000)
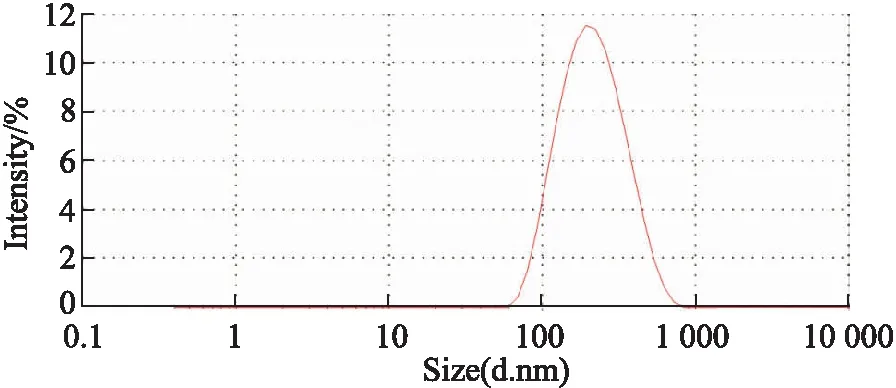
Fig 2 Particle distribution of Que-SLN

Fig 3 Zeta potential distribution of Que-SLN
2.2 体外血脑屏障模型评价结果Que和Que-SLN均能透过血脑屏障,发挥神经保护作用,同浓度的Que-SLN比Que具有更强的血脑屏障通透性(P<0.01),见Fig 4。

Fig 4 Blood-brain barrier permeability of Que and Que-SLN
2.3 Que-SLN与Que对正常状态下PC12细胞的作用Que在浓度低于50 μmol·L-1,Que-SLN在浓度低于200 μmol·L-1时能促进PC12的增殖,见Tab 1。
Tab 1 Effects of Que and Que-SLNon PC12 cell viability
2.4 Que-SLN对Aβ25-35损伤的PC12细胞的影响与Aβ25-35组相比,阳性对照药组和Que-SLN 组细胞存活率均明显升高,见Tab 2。

Tab 2 Effects of Que-SLN on PC12 cell viability damaged
2.5 细胞免疫荧光染色检测雌激素受体蛋白表达的结果与对照组相比,模型组ERα蛋白荧光强度明显减弱(P<0.05);与模型组相比,17β-E2组、Gen组、Que-SLN (50,100,200 μmol·L-1)组中,ERα蛋白表达增强,差异具有显著性;各组ERβ蛋白与模型组相比荧光强度无差别,见Fig 5,6。
2.6 Western blot检测雌激素受体蛋白的表达的结果与对照组相比,Aβ25-35组ERα蛋白表达明显降低(P<0.01);与 Aβ25-35组相比, 17β-E2组、Gen组和Que-SLN 不同浓度组均上调了ERα蛋白的表达,差异具有显著性,而Aβ25-35组和不同给药组对ERβ蛋白表达的影响无差别,见Fig 7。
3 讨论
固体脂质纳米粒的制备方法有多种,包括薄膜-超声法、乳化挥发-低温固化法、微乳法、高压匀乳法、熔融-超声法等。本实验采用熔融-超声法制备Que-SLN,制备方法简单,安全,无污染,制备的SLN包封率高达90%,粒径均匀,呈类球形,与文献[14]中采用乳化蒸发-低温固化法制备槲皮素固体脂质纳米粒相比,本实验通过熔融超声法制备可避免有毒的有机溶剂的使用,且包封率较高。

Fig 5 Expression of ERαby immunofluorescence staining(×200)

Fig 6 Expression of ERβ by immunofluorescencestaining(×200)
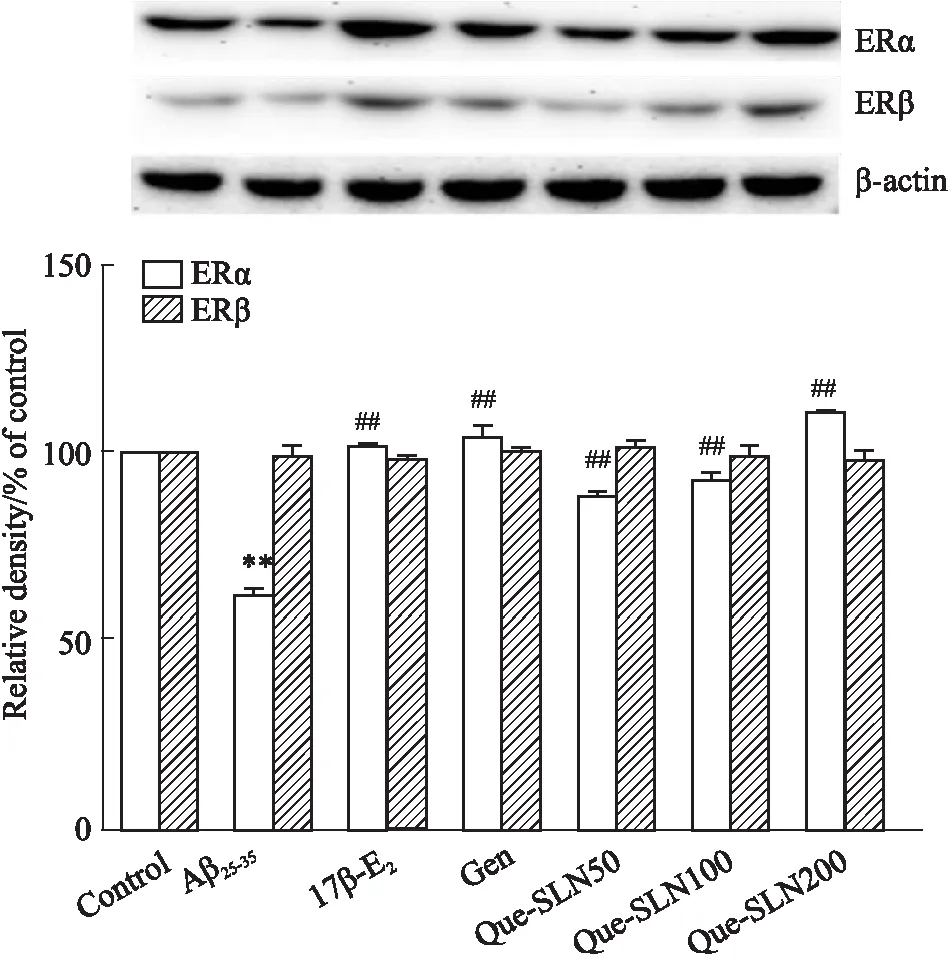
Fig 7 Effects of Que-SLN on expression of ERα, ERβ protein in PC12 cells induced by Aβ25-35 n=3)
在本实验中选用GMS作为载体,GMS不溶于水,但能在水中形成稳定的水合分散体,且本身具备一定的乳化性,研究表明混合乳化剂可以提高SLN的稳定性[15];选用蛋黄卵磷脂和P188共为乳化剂,蛋黄卵磷脂可明显降低油水两相的界面张力,增强乳化效率;P188具有空间位阻效应,防止SLN的聚集,增强稳定性。结合GMS本身的乳化作用,三者合用起到减小粒径增加槲皮素固体脂质纳米粒稳定性的作用。
槲皮素溶解度低,因此限制了其开发和应用。课题组前期实验研究显示,槲皮素应用DMSO 溶解仅在浓度低于80 μmol·L-1时对PC12细胞有促增殖作用,高于80 μmol·L-1时表现出生长抑制。本实验通过制备Que-SLN,增加了Que的溶解度,避免了溶剂DMSO的使用,结果表明Que在低于200 μmol·L-1时对PC12细胞仍具有促增殖作用,扩大了Que的细胞作用浓度范围。可能的原因是首先避免了溶剂 DMSO 的影响,其次是槲皮素固体脂质纳米粒可以使槲皮素缓慢释放,维持相对稳定的浓度,持续发挥神经保护作用。
血脑屏障通透性试验结果显示,与原料药相比槲皮素固体脂质纳米粒更容易透过血脑屏障(P<0.01)可能是由于 SLN 中的亲脂性材料可增加其细胞膜透过率,使槲皮素更容易透过血脑屏障发挥雌激素样神经保护作用,本实验仅在体外细胞方面进行了槲皮素血脑屏障通透性实验的初步研究,槲皮素固体脂质纳米粒在体内能否通过血脑屏障还需进一步的动物实验的研究,槲皮素固体脂质纳米粒和槲皮素发挥神经保护作用的机制一致,主要是通过增加ERα蛋白的表达发挥神经保护作用。
AD 的发病机制复杂,病因尚未阐明,并未提出有效治疗方法,纳米治疗策略还处在实验室研究阶段,纳米技术作为一项递药策略并不能完全解决治疗难题。另外,AD 属于慢性病,需要长期给药,而纳米制剂在脑内长期应用是否会长期蓄积而引发不良反应、能否有效清除等需要进一步验证。