S14G-humanin对APP/PS1转基因小鼠认知功能和脑胰岛素抵抗的影响
2020-10-28贾宁,张泽,韩锟
贾 宁,张 泽,韩 锟
(1. 中国科学院大学宁波华美医院,生命与健康产业研究院,浙江 宁波 315010;2.锦州医科大学附属第一医院,辽宁 锦州 121001)
阿尔茨海默病(Alzheimer′s disease,AD),是发生于老年患者最常见的一种痴呆症。研究表明[1,2],AD存在脑胰岛素抵抗(insulin resistance,IR),且增加痴呆患病风险,并随病程进展而加重。脑内IR促发β淀粉样蛋白(β-amloid protein,Aβ)蓄积、炎症、氧化应激、神经变性和认知功能下降[3]。目前减轻脑IR成为AD治疗的新靶点,但是相关药物的研发仍非常有限。Humanin(HN)是应用cDNA文库的办法从AD患者大脑枕叶通过提取到的线性多肽, S14G-humanin(HNG)是其衍生物,神经保护作用是HN的1 000倍[4]。目前研究表明,HNG可通过减轻炎症反应、抑制氧化应激、改善神经突触功能、减少细胞凋亡等机制发挥神经保护作用[5-6]。但HNG能否通过减轻脑IR发挥其神经保护作用至今仍未有这方面研究的报道。因此本研究探讨HNG对APP/PS1转基因小鼠减轻IR的机制。
1 材料与方法
1.1 材料
1.1.1实验动物 8月龄APP/PS1转基因小鼠及C57BL/6J小鼠购自中国医学科学院实验动物中心,许可证号:SYXK2018-012。
1.1.2主要试剂 HNG(Sigma公司,纯度>97%,货号H6161);兔抗小鼠多克隆胰岛素受体底物-1(insulin receptor substrate-1,IRS-1)抗体、兔抗小鼠多克隆IRS-1pSer636抗体、兔抗小鼠多克隆Akt抗体、兔抗小鼠多克隆p-AktSer473抗体(Santa Cruz公司,货号sc-8038、sc-136470、sc-55523、sc-293125);Aβ1-42 ELISA试剂盒(Cell Signaling Technology公司,货号20882C)。
1.1.3仪器 Morris水迷宫(XR-XM101)上海欣软信息科技有限公司;石蜡切片机(RM2235)德国Leica;电泳仪(PowerPac 3000)、凝胶成像系统(GelDoc EZ)美国Bio-Rad公司;紫外分光光度计(BioPhotometer plus)德国Biophotometer。
1.2 方法
1.2.1动物分组与处理 APP/PS1转基因小鼠随机分成模型组(transgenic group,Tg)及HNG治疗组(transgenic group/HNG,Tg/HNG),对照组(control group,CG)为同月龄C57BL/6J小鼠,每组小鼠8只,雌雄各半,体质量(24±2) g。给药方法:CG组和Tg组腹腔注射双蒸水0.5 mL·d-1,Tg/HNG组腹腔注射HNG(50 μg·kg-1)0.5 mL·d-1,每组给药连续4周。
1.2.2Morris水迷宫试验行为学检测 Morris 水迷宫实验于给药结束24 h后进行,实验程序参照 Morris等[7]方法进行,实验分为定位航行实验和空间探索实验两部分,检测各组小鼠的空间学习记忆能力。
1.2.3免疫组化方法检测IRS-1pSer636蛋白表达 提取小鼠脑组织于4%多聚甲醛中固定,常规石蜡包埋制备切片,切片经二甲苯脱蜡,梯度酒精复水。应用柠檬酸盐缓冲液0.1 mmol·L-1修复抗原及封闭。一抗(IRS-1pSer636抗体,1 ∶ 100)4 ℃孵育过夜。滴加生物素标记的二抗,37 ℃孵育1 h。应用DAB显色,镜下观察染色呈现出淡棕黄色后,用dd H2O冲洗中止显色反应。用显微镜观察每个视野中阳性细胞表达,用Image-Pro Plus v6.0软件分别测定OD值。
1.2.4Western blot检测IRS-1、IRS-1pSer636、Akt、AktpSer473的蛋白表达 提取小鼠海马的总蛋白,BCA法测定蛋白浓度,40 μg蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,电泳后的凝胶按照类似三明治(正极-海绵-滤纸-PVDF膜-凝胶-滤纸-海绵-负极)的方法转膜,5%牛奶封闭,一抗(IRS-1,1 ∶ 1 000;IRS-1pSer636,1 ∶ 1 000;Akt,1 ∶ 1 000;p-AktSer473,1 ∶ 1 000;GAPDH,1 ∶ 5 000)4 ℃孵育过夜,二抗常温孵育1 h后洗去多余抗体,ECL显影及ImageJ软件分析。
1.2.5ELISA法检测海马Aβ1-42水平 将小鼠的脑组织称重,加入盐酸胍裂解液研磨,用反应缓冲液1 ∶ 50稀释样品,离心20 min。取上清用于可溶性Aβ1-42的测定;离心管底部沉淀再用 70%甲酸溶解,离心1 h,收集上清液用于不可溶性Aβ1-42的测定。取标准品按说明书建立标准曲线。将标准品、样品各50 μL分别加入微量酶标板内,立即向每孔加入50 μL Aβ1-42抗体,孵育、洗板,加100 μL染液覆盖、孵育30 min,取出酶标板,每孔加终止液100 μL。450 nm波长读取光密度(OD值),根据曲线方程,求出脑组织中Aβ1-42的浓度。
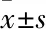
2 结果
2.1 HNG改善APP/PS1转基因小鼠学习记忆能力各组小鼠定位航行试验(Fig 1A),显示寻找平台逃避潜伏期随着测试时间的延长逐渐缩短。Tg组小鼠逃避潜伏期延长(P<0.05);经HNG治疗后明显缩短(P<0.05)。空间探索试验结果(Fig 1B)显示,Tg组小鼠穿梭原平台所在象限次数明显减少(P<0.05),经HNG治疗后次数均明显增加(P<0.05)。各组小鼠定位航行试验最后一天的典型游泳轨迹图(Fig 2)。表明APP/PS1小鼠具有明显的空间学习障碍,HNG可改善其能力。

Fig 1 Measurement of escape latency assessed by Morris water maze(A)and number of times in entering target
2.2 HNG减轻APP/PS1转基因小鼠海马IRS-1 Ser636位点的磷酸化IRS-1pSer636蛋白在细胞质中表达,呈棕黄色的颗粒(Fig 3)。与CG组比较,Tg组小鼠海马CA1区神经元胞质棕黄色颗粒明显增多、OD值明显升高(P<0.05);与Tg组比较,Tg/HNG组小鼠海马CA1区神经元胞质棕黄色颗粒明显减少、OD值降低(P<0.05),提示HNG可减轻痴呆鼠海马IRS-1 Ser636位点的磷酸化,从而减轻脑内IR。

Fig 2 Typical swimming trajectories of mice in Morris water maze
Fig 3 Levels of IRS-1pSer636 in APP/PS1 mice reduced by HCG vs CG;*P<0.05 vs Tg
2.3 HNG减轻APP/PS1转基因小鼠海马神经元胰岛素抵抗Western blot结果显示(Fig 4),与CG组比较,Tg组小鼠海马总IRS-1蛋白、总Akt蛋白表达水平差异无统计学意义(P>0.05),IRS-1蛋白Ser636位点磷酸化水平升高、Akt蛋白Ser473磷酸化水平降低(P<0.05),而说明APP/PS1转基因小鼠通过增加IRS-1蛋白磷酸化水平,减少其下游的Akt蛋白Ser473磷酸化水平,提示痴呆模型鼠脑内存在IR。治疗后的Tg/HNG组小鼠海马IRS-1Ser636磷酸化水平较Tg组明显降低(P<0.05)、p-AktSer473蛋白表达明显升高(P<0.05),而IRS-1总蛋白表达水平无明显差异(P>0.05),提示HNG可减轻痴呆鼠IRS-1蛋白的过度磷酸化及增加下游Akt蛋白的磷酸化,从而改善脑IR。
2.4 HNG减轻APP/PS1转基因小鼠脑内Aβ1-42水平ELISA结果显示(Tab 1), Tg组小鼠海马可溶性及不可溶性Aβ1-42含量较CG组明显增高(P<0.05);与Tg组比较,Tg/HNG组小鼠海马Aβ1-42含量明显降低(P<0.05),提示HNG可减轻APP/PS1小鼠脑内Aβ沉积。

Tab 1 Effects of HNG on levels of Aβ1-42 in hippocampus
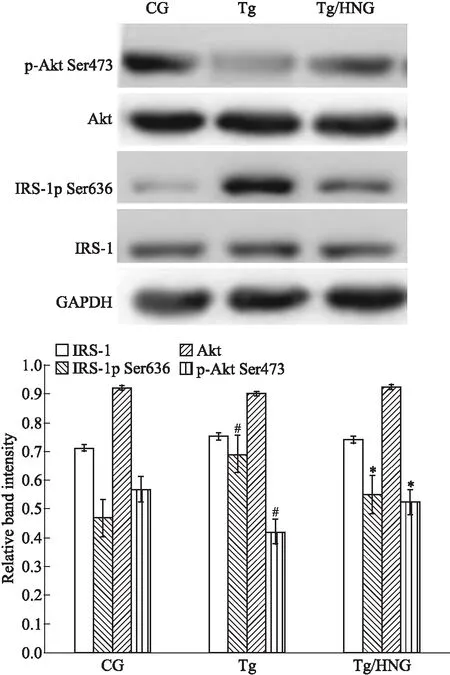
Fig 4 Effects of HCG on insulin resistance related proteins in hippocampus of APP/PS1
3 讨论
HN是日本学者Hashimoto教授从AD患者大脑枕叶提取到的由24个氨基酸组成的线性肽,HNG是Gly取代其第14位的Ser残基后的衍生物,但神经保护作用增加了上千倍[4]。实验证明,HNG可通过抑制Aβ形成及沉积、改善突触功能、活化神经营养因子、减轻炎症反应、抗细胞凋亡等机制,从而对AD发挥神经保护作用[5-6]。但HNG调节脑胰岛素信号转导的机制进而改善认知功能尚无相关报道。
文献报道胰岛素信号通路转导异常与痴呆相关且增加患痴呆风险, AD发病初期就出现脑内胰岛素通路异常,并随AD的病程进展而加重[1]。IRS-1 作为胰岛素信号转导中的关键分子,在海马、大脑皮层、嗅球、下丘脑及小脑均有大量表达,其本身无激酶活性,但可通过磷酸化/去磷酸化改变自身活性,特别Ser636、Ser639、Ser312位点磷酸化,导致IRS-1活性受抑制,阻断胰岛素通路的下游信号抑制Akt的磷酸化,从而导致IR[2]。IR被定义为由于胰岛素的信号通路改变所致不能有效刺激葡萄糖转运至细胞内的状态[8],脑内IR可以减少脑内葡萄糖代谢,最终导致神经元丢失和功能异常,因此AD大脑被描述为IR状态。胰岛素是通过胰岛素降解酶(insulin degrading enzyme,IDE)降解的,IDE也能降低Aβ神经毒性,减少Aβ在神经元沉积,IR时增多的胰岛素竞争性结合更多的IDE作用位点,阻断IDE与Aβ结合,使IDE降解Aβ作用受限,Aβ沉积增加,继而参与氧化应激、神经炎症及免疫系统失衡反应,加速AD形成和恶化[9-11];AD患者中丁酰胆碱酯酶和乙酰胆碱酯酶的病因学作用也是通过IR介导的,从而导致AD脑内乙酰胆碱递质减少,诱发和加重AD[12-14]。
本研究结果显示,APP/PS1转基因小鼠海马神经元IRS-1蛋白Ser636位点磷酸化水平增加、Akt蛋白Ser473位点磷酸化水平减少,提示APP/PS1转基因小鼠脑内存在胰岛素信号转导障碍,与IRS-1的抑制性丝氨酸位点磷酸化表达增加相一致,说明APP/PS1转基因小鼠脑内存在IR,进而导致脑内Aβ形成及增高,导致痴呆模型的空间学习及记忆能力下降。HNG通过下调IRS-1pSer636蛋白表达,进而上调p-AktSer473活性,调节胰岛素信号转导,减轻脑IR,减少脑内Aβ沉积,从而改善认知功能。Bomfim 等[15]发现给予APP/PS1双转基因小鼠腹腔内注射长效胰高血糖素样肽-1受体激动剂exendin-4 能够减轻IRS-1pSer636水平并且改善小鼠认知功能,而HNG也是通过下调IRS-1pSer636的表达及上调Akt Ser473的磷酸化水平从而改善认知,而exendin-4能否上调p-Akt Ser473的表达减轻脑IR,目前尚无这方面结论。因此,有学者推测IRS-1pSer是中枢胰岛素抵抗的决定性因素。本文揭示了HNG治疗AD的新靶点,为HN衍生物药物的研发提供了新的方向。但HNG减轻脑IR的剂量效应关系仍需进一步研究。
(致谢:本文在中国科学院大学宁波生命与健康产业研究院实验室和锦州医科大学附属第一医院药理学实验室完成,感谢实验室老师的指导和帮助!)