黏膜相关恒定T细胞体外扩增的技术及其抗肿瘤特性的研究
2020-10-28朱晨文
朱晨文,王 华,2
(安徽医科大学1.第一附属医院肿瘤科,2.肝病研究所,安徽 合肥 230022)
黏膜相关恒定T细胞(mucosal-associated invariant T cell,MAIT)是免疫调节功能强大而广泛的非特异淋巴细胞,它不仅在抵御病原体入侵及炎症性疾病的防御中扮演重要角色,在肿瘤甚至是免疫耐受等免疫反应调节中也发挥着不可替代的作用。MAIT细胞对各种肿瘤进行免疫疗法的相关研究受重视程度也逐渐增加。然而在生理情况下,MAIT细胞在外周血中约占淋巴细胞的1%~10%,不足以发挥其抗肿瘤作用,因此建立一种有效的MAIT细胞体外扩增体系是深入研究MAIT细胞功能的重要基础,也是MAIT细胞免疫治疗的关键。建立科学的MAIT细胞体外扩增、临床应用体系等,将给肿瘤患者的治疗提供未来。本文综述了MAIT细胞的生物学特性,识别杀伤肿瘤细胞的机制,以及应用于临床治疗上的潜力。
1 MAIT细胞体外扩增技术的进展
1.1 MAIT细胞生物学特征MAIT细胞是一种作为先天和适应性免疫之间桥梁的特殊T细胞亚群。它最先是在肠黏膜淋巴组织中被发现[1],因为这些T细胞在粘膜组织中相对富集,随后,MAIT细胞这个术语才被确立。MAIT细胞具有多样性有限的T细胞受体(T cell receptor,TCR), 由半不变的TCRα链(人类的Va7.2-Ja33和小鼠的Va19-Ja33),与变化有限β链(人类的Vβ2和Vβ13片段以及小鼠的Vβ8和Vβ6的片段)共同组成受体,受主要组织相容性复合物I类相关蛋白(major histocompatibility complex class Ⅰ-like molecule,MR1)的限制[2]。MAIT细胞子集可根据CD4和CD8的表达情况,确定为CD8+、CD4+和CD8-CD4-(double-negative,DN)3种细胞亚群,CD8+MAIT细胞还可根据表达CD8同源二聚体的不同分为CD8αα和CD8αβ两个亚群,尽管这些子集的功能性意义还不完全明确。MAIT细胞起源于造血干细胞,起初在胸腺内以天然的表型存在并且发育分化,随后转移到外周组织中,主要分布于肠、肝、肺等部位,再随着抗原的接触获得记忆表型[3]。人类MAIT细胞表现出效应记忆表型(CD95hiCD62LloCD122intCD127hi),并表达介导组织归巢的趋化因子受体,如CCR6、CCR5hi、CCR9int和CXCR6[4]。MAIT细胞还表达多种NK受体,如CD161(NK1.1)、NKP30和CD314(NKG2D)等。此外,MAIT细胞表达的表型标记还包括细胞因子受体,例如IL-7Rα、IL-18Rα、IL-12Rβ2、IL-23R、IL-2Rβ等,以及转录因子PLZF,RORγt,T-bet。进一步分析这些细胞,发现MAIT细胞可以通过TCR介导直接识别维生素B代谢物产生的配体或通过细胞因子(如IL-12和IL-18)信号被激活,根据触发的环境分泌IFN-γ、IL-17,TNF-α或者颗粒霉素B等其他效应分子,使其拥有细胞溶解能力和杀死靶细胞的能力[6]。
1.2 MAIT细胞体外扩增技术从外周血中分离后,一定数量的MAIT细胞即可获得(Fig 1),但其对培养环境要求较高,在不受干预的情况下,细胞增殖效率和杀伤活性低下。此外,MAIT细胞在实验室常用的小鼠品种中频率很低。因此,怎样提高MAIT细胞体外扩增效率和杀伤活性一直是当下研究的焦点。

Fig 1 Factors affecting expansion of MAIT cells in vitro
1.2.1MAIT细胞来源 MAIT细胞在人类中的来源可分为成人MAIT细胞和脐血MAIT祖细胞,其中成人MAIT细胞可分为健康人和患者两种来源。Gherardin等[6]分离健康供者的外周血单个核细胞(peripheral blood mononuclear cell,PBMC),在人T细胞培养基中体外扩增。类似地,Zumwalde等[7]报道的乳腺癌患者MAIT细胞可在RPMI 1640的培养下扩增,并高表达NKG2D,在抗肿瘤免疫监视中起作用。相对于成人血液中MAIT细胞含量,MAIT细胞在脐带血中含量很少。Wakao等[8]将从脐带血中提取的MAIT细胞被含有重编程因子的仙台病毒感染,经转导后诱导成为诱导多能干细胞(induced pluripotent stem cell,iPSC),再从这些iPSC中有效地重新分化成MAIT样淋巴细胞。此外,因为小鼠中MAIT细胞比例很低,限制了在小鼠模型上进行MAIT细胞的研究,所以对小鼠来源的MAIT细胞开展体外扩增研究也是当务之急。尽管不同来源的MAIT细胞在扩增方法和效果上各不相同,但寻找到具有更强扩增活性的MAIT细胞的来源仍是MAIT细胞体外活化扩增研究重点。
1.2.2培养基和血清类型 AIM-V培养基,RPMI 1640培养基和IMDM培养基是体外MAIT细胞扩增培养体系中常用的培养基。Gherardin等[6]使用健康人的MAIT细胞在RPMI 1640和AIM-V等体积混合的培养基(包括体积分数为0.1的FBS,体积分数为0.02的人AB血清)中体外培养21 d,MAIT细胞比例平均扩大12倍,比例由原先占PBMC中淋巴细胞的5.8%增加到扩增后的70%。类似地,Gherardin等[9]在另一项研究中也选择相同培养基对健康个体的MAIT细胞进行体外扩增。但Zumwalde等[7]将乳腺癌患者的MAIT细胞仅在RPMI 1640培养基(含有体积分数为0.15的热灭活牛血清和体积分数为0.03的人AB血清)中培养扩增。Melo等[10]也是如此,使用RPMI 1640完全培养基(包括体积分数为0.1的FBS)对健康个体的MAIT细胞培养10 d。而在小鼠中,培养基的选用也不尽相同。Rahimpour等[4]将野生型C57BL/6小鼠的MAIT细胞在RPMI 1640培养基(含体积分数为0.02的胎牛血清)中培养。Varelias等[11]对野生型C57BL/6小鼠的MAIT细胞则选择使用IMDM培养基(含体积分数为0.1的FBS)进行体外扩增。而Wakao等[8]采用iPSC技术研究人MAIT细胞的扩增时,用的是相对不常用的α-MEM培养基。综上各培养基的选用情况,对于人MAIT细胞的体外扩增,RPMI 1640和AIM-V混合培养基是常用的方案,效果明显,而其他的未作具体的解释。但在小鼠MAIT细胞的体外扩增方面,相关实验较少,所以最优的选择目前并不明确,还有待进一步的研究。
1.2.3特异性激活剂 MAIT细胞表达半不变的TCR,可以识别由非多态MR1分子表达的非肽性微生物抗原。Kjer-Nielsen等[3]确定了微生物核黄素合成途径的产物作为主要的生理抗原来源,其在体外驱动MAIT细胞活化。MR1在微生物核黄素合成途径中向MAIT细胞提供中间体。5-Amino-6-(D-ribitylamino)uracil(5-A-RU)即是细菌核黄素的前体,也是MAIT细胞激活剂,尽管5-A-RU不直接结合MR1来激活MAIT细胞。但其通过与来自其他代谢途径的小分子(如乙二醛和甲基乙二醛)的非酶反应形成有效的MAIT激活抗原5-(2-oxopropylideneamino)-6-D-ribitylaminouracil,即5-OP-RU,常被用作MAIT细胞的体外激活剂[2]。Rahimpour等[4]研究显示,WT小鼠的MAIT细胞能够以剂量依赖的方式识别并特异性地响应激动剂配体5-OP-RU而扩增。类似的,Koay等[12]发现在5-OP-RU抗原特异性作用下,存在明显的WT小鼠的MAIT细胞群扩增。另外,以TCR依赖的方式,用5-OP-RU体外扩增的健康人MAIT细胞还可以有效且特异地裂解的多发性骨髓瘤细胞系[6],发挥效应功能。除此之外,在药物和药物代谢产物中,由MR1分子捕获的一些配体在体内外常常抑制MAIT细胞,但包括双氯芬酸及其代谢物在内的其他配体则是激动剂,尽管与5-OP-RU相比,它们的活性要弱的多[13]。
1.2.4细胞刺激因子 IL-2、IL-15、IL-12和IL-18等细胞因子单独或组合,在促进MAIT细胞的活化、增殖及发挥细胞毒活性过程中不可或缺。IL-2是维持T细胞的生存和促进T细胞的扩增以及增强细胞免疫的杀伤作用方面的必要因素。Melo等[10]在对健康人血中MAIT细胞体外扩增培养中仅添加了IL-2一种细胞因子,而Gherardin等[6]经实验发现IL-2、IL-7、IL-12、IL-15和IL-18可使人MAIT细胞在21 d的培养过程中获得大量扩增。IL-15是体外扩增MAIT细胞体系中常用的细胞因子。同时,IL-18和IL-12也已被证明可以刺激MAIT细胞效应功能[5],虽然IL-12和IL-18对诱导MAIT细胞产生细胞因子尤为重要,但诱导MAIT细胞增殖似乎更依赖于IL-15[14]。此外,IL-7也是一种多效性细胞因子,对T细胞有很强的生存与稳态作用。IL-7、I型干扰素等亦可刺激MAIT细胞活化与增殖,但相对于IL-2较弱[15]。Wang等[16]在野生型B6小鼠体外MAIT细胞扩增的研究中使用IL-23作为其细胞刺激因子,IL-23可直接作用于MAIT细胞,也能通过正调控可诱导型T细胞共刺激分子(inducible T cell CO-Stimulator,ICOS)表达,促进细胞增殖。这些研究表明,细胞因子对MAIT细胞的活化和扩增是必不可少的,但是仅有细胞因子也并不能刺激MAIT细胞达到最优的扩增状态。
1.2.5其他因素 先前研究表明,在没有细胞因子刺激的情况下,仅靠TCR连接不足以在体内产生MAIT细胞的增殖和激活。因此,需要第二个信号,体外扩增中也相同。共刺激分子就是T细胞激活的第二信号,可以协助抗原呈递细胞(antigen-presenting cells,APC)激活T细胞。CD28-CD80/CD86相互作用对CD1d限制的iNKT细胞的激活至关重要,相比之下,CD28-CD80/CD86信号传导似乎对MAIT细胞激活和增殖并不重要,正如Miyazaki等[17]在研究中所发现的一个有趣特性,人类MAIT细胞对CD3和CD28的刺激几乎无反应。众所周知,CD28和ICOS在T细胞扩增、存活和分化过程中功能相似,ICOS在MAIT细胞上高度表达,是体内最佳MAIT细胞激活状态所必需的[16],所以ICOS在体外扩增中是否必不可少值得进一步探究。此外,MAIT细胞还可以在细胞因子和TCR作用下增殖,大肠杆菌诱导的MAIT细胞扩增主要依赖于TCR[14],事实上,MAIT细胞的扩增需要暴露在共生菌群中,只限于表达核黄素生物合成途径的微生物。而对于Toll样受体(Toll-like receptors,TLR),它可通过激活细胞因子的方式诱导激活MAIT细胞,体外实验中已经显示TLR1、TLR2、TLR6可以提供共同刺激信号来驱动MAIT细胞的细胞因子分泌[5]。因此,在特异性TLR刺激的情况下,MAIT细胞TCR的特异性活化足以实现迅速和持久的MAIT细胞扩增。然而,TCR和细胞因子介导的激活以及扩增还受到诸多相关因素的影响。例如,MAIT细胞在抗原特异性激活后,通过在细胞表面迅速上调CD40L,并与TLR配体协同作用,来诱导DC细胞分泌具有生物活性的IL-12,而IL-12可以再作用于MAIT细胞[18]。另外,还有研究发现,B细胞可能是MAIT细胞的APC的来源之一,同时,MAIT细胞在体外还能直接增强B细胞自身抗体的产生[19]。MAIT细胞可以与DC、B细胞以及巨噬细胞在体外相互作用,但是否能够增强MAIT细胞的活性和数量仍有待进一步研究。值得关注的是,Wakao等[8]将具有MAIT细胞特异TCR基因的人工多能干细胞分化诱导,并将上述的人工多能干细胞与饲养细胞一起体外共培养,可得到扩增的MAIT样细胞。
2 MAIT细胞的抗肿瘤免疫作用
2.1 MAIT细胞识别肿瘤细胞的分子机制MAIT细胞能够通过TCR以及NGK2D等受体识别肿瘤细胞上异常高表达的分子(Fig 2)。MR1的表达是MAIT细胞发育和扩增所必需的,不仅如此,MR1还是一种进化上高度保守的非经典MHC-Ⅰb分子,是MAIT细胞的限制性分子。MR1基因在所有细胞类型中都广泛转录,但在许多细胞类型的细胞表面水平上MR1表达通常很低[20]。正如我们所了解的,MAIT细胞是通过MR1将APC上的配体呈递给MAIT的TCR而被激活,要注意的是,抗原呈递细胞还可以通过抗原结合的蛋白质稳定作用上调MR1的细胞表面表达,而且有证据表明,MR1存在基础性细胞表面表达,包括在癌细胞上的表达[21]。如前所述,MAIT细胞可以识别抗原呈递细胞显示的MR1限制性抗原以及对包括IL-12和IL-18在内的部分细胞因子作出反应。尽管尚未定义结合MR1的肿瘤抗原,但肿瘤细胞本身也有可能存在MR1配体,可以直接激活MAIT细胞,携带表面分子MR1的癌细胞因此可以被MAIT细胞识别并杀伤。这些研究表明了MAIT TCR-MR1轴在肿瘤免疫中的重要性。但是,Yan等[22]在一项动物的体内研究中发现,肿瘤细胞MR1的表达对MAIT细胞的抑制功能至关重要,提供了利用阻断MR1来遏制肿瘤免疫逃逸来作为肿瘤治疗新策略。与此相对,另一份最新报告显示,一种MR1限制性的新型T细胞所介导的疗法,可通过MR1分子识别并有效杀伤各种类型癌细胞[21]。
MAIT细胞表达的NKG2D能感知到肿瘤细胞上MHC I类分子相关链A和链B(MHC class Ⅰ-related chain A and chain B,MIC A/B)和巨细胞病毒包膜糖蛋白UL16结合蛋白(UL16-binding proteins,ULBPs)的存在。MAIT细胞还具有强大的细胞毒性效应分子库,包括直接识别并杀死肿瘤细胞在内的功能都可以由其所释放的穿孔素和颗粒酶等细胞毒性效应分子所完成。MAIT细胞可以通过TNF-α作用途径引起肿瘤细胞死亡,但是,在TNF超家族的其他成员中,TRAIL和FasL(CD178)在外周血MAIT细胞表面都很难检测到,其中FasL无法通过与TCR结合在细胞上而上调,而MAIT细胞是否有上调TRAIL和其他TNF超家族成员表达的潜能仍然是未知的[23]。此外,激活后的MAIT细胞是IFN-γ的重要来源之一,已知肿瘤细胞通常表达低水平的MHC Ⅰ类分子来避免CD8+CTL的监测,而IFN-γ能够上调肿瘤细胞上MHC Ⅰ类分子和Fas(CD95)的表达,继而促进其各种杀伤细胞类型的细胞溶解作用。IFN-γ还可以经交叉途径激活NK细胞、M1型巨噬细胞和CD8+CTL等效应细胞类型,进而共同促使肿瘤细胞死亡。此外,IFN-γ诱导的趋化因子CXCL9和CXCL10能促进某些肿瘤细胞中T细胞的肿瘤浸润,并抑制肿瘤性新生血管形成。除了激活性受体外,MAIT细胞还能与NKG2A/CD94等抑制性受体相互作用来调节自身活性。另外,相当比例的MAIT细胞,特别是CD8+MAIT细胞,表达CD16(FcγRIII),这将通过抗体依赖性细胞介导的细胞毒性(antibody dependent cell mediated cytotoxicity,ADCC)破坏肿瘤细胞,尤其是循环肿瘤细胞[24]。
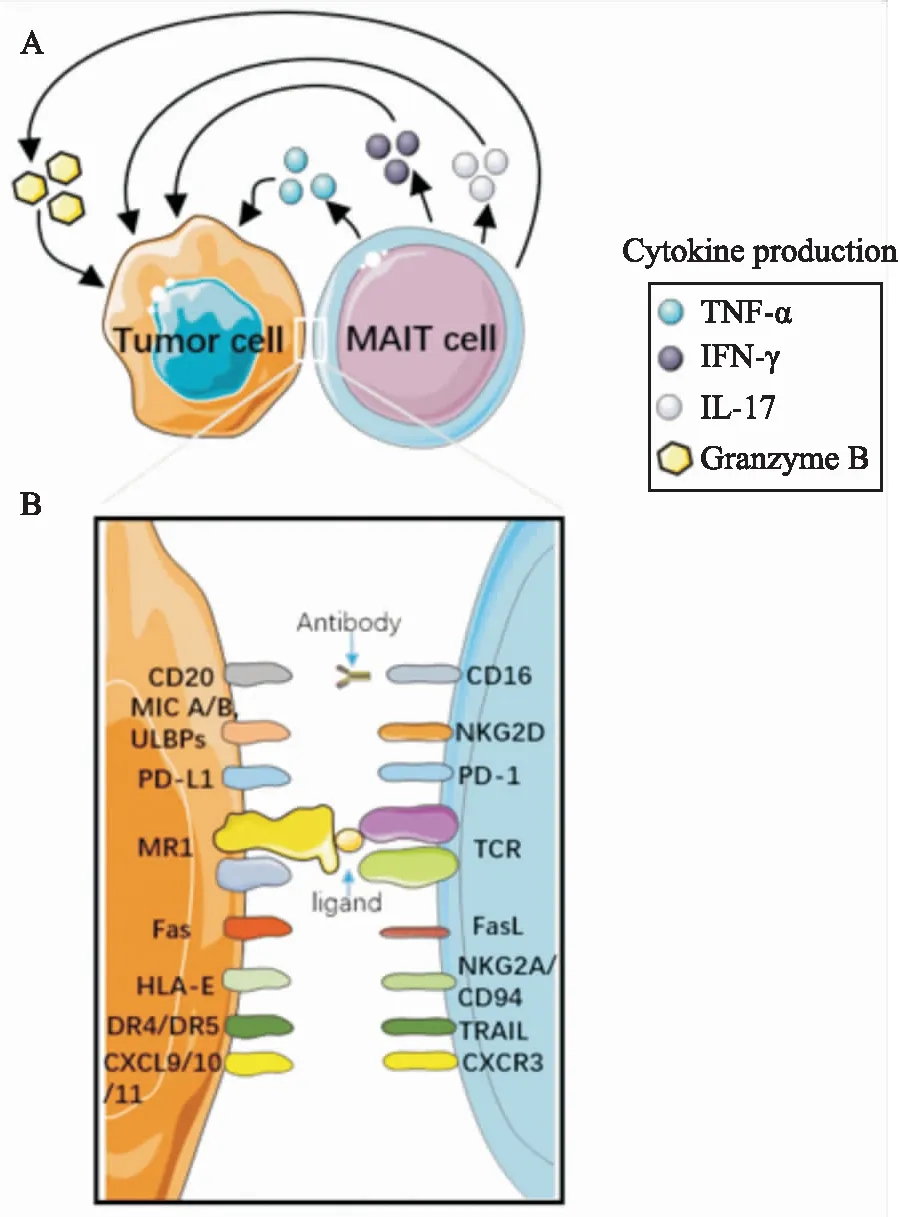
Fig 2 Schematic illustration of molecular interaction mechanism involved in process of MAIT cell recognition and killing of tumor cells
2.2 MAIT细胞介导的肿瘤免疫MAIT细胞是抗肿瘤保护性免疫效应中的关键细胞。由于MAIT细胞作为非常规T细胞可拥有先天性和适应性免疫的特征,其参与抗肿瘤免疫应答可通过以下两种方式:抗肿瘤免疫细胞的“效应”功能可实现直接对肿瘤细胞发挥迅速杀伤和溶解作用和通过Th1型细胞因子反应来触发“辅助”功能,募集并活化其他天然和特异性免疫细胞,继而间接发挥抗肿瘤效应。
正如Leeansyah等[15]所报道的那样,MAIT细胞可通过释放穿孔素和多种颗粒酶发挥强大抗肿瘤活性,导致靶细胞裂解。类似的,Brozova等[24]在体外用离子霉素和PMA刺激人外周血MAIT细胞后,发现其表达高水平的CD16和NKG2D,同时,MAIT细胞不仅可以产生促炎细胞因子(TNF-α和IFN-γ),还拥有较高的细胞毒作用(含颗粒酶B较多和LAMP-1表达量较高),包括ADCC作用的增强。最近,Gherardin等[6]的研究证明,健康供体来源的MAIT细胞在特异性抗原激活后能够以MR1依赖性方式杀死多发性骨髓瘤细胞系,这表明MAIT细胞可以直接对人类肿瘤细胞进行杀伤。Melo等[10]还观察到,体外扩增的MAIT细胞的抗肿瘤细胞毒能力能够杀死食道癌细胞系。此外,Won等[25]在结肠癌为主的粘膜相关癌患者中发现循环MAIT细胞向结肠癌肿瘤微环境聚集,这些活化的MAIT细胞不仅具有淋巴因子激活的杀伤细胞(lymphokine activated killer cells,LAK)活性,而且还通过直接的细胞毒性在体外作用于人类红白血病细胞系。这些结果证实了MAIT细胞可促进细胞毒性甚至以直接的“效应”功能摧毁肿瘤细胞。
在肿瘤发展初期,MAIT细胞即可驱动抗肿瘤免疫功能,在短时间内刺激DC细胞、肿瘤抗原特异性T淋巴细胞和NK细胞等发挥间接抗肿瘤效应。Salio等[18]报道了被激活的MAIT细胞能够上调CD40配体以及诱导单核细胞和树突状细胞成熟,这些细胞随后即上调共刺激分子和分泌Th1极化细胞因子(如IL-12),进而激活NK细胞产生IFN-γ。与此同时,IL-12还可与IL-18协同活化MAIT细胞,一起形成正反馈。众所周知,MAIT细胞在激活后分泌TNF-α和IFN-γ来开启Th1型反应。不仅如此,Th1型细胞因子IFN-γ和TNF-α还可以共同活化NK细胞和细胞毒性T淋巴细胞,从而启动它们分别所介导的天然和适应性抗肿瘤免疫。随着肿瘤的进展,MAIT细胞暴露于慢性炎症刺激中,其中部分MAIT细胞的应答状态逐渐降低,进而丧失抵抗肿瘤发生的能力。在Duan等[26]的研究中,肝癌微环境中肿瘤浸润的MAIT细胞具有PD-1、CTLA-4和TIM-3三种分子高表达的耗竭表型,当这些MAIT细胞与健康个体的MAIT细胞相比,其产生IFN-γ的能力下降,并且还分泌了与肿瘤血管生成相关的IL-8,揭示了MAIT细胞向促肿瘤表型发展,从而促进肿瘤生长和免疫逃逸的现象。此外,还有研究表明,当肿瘤浸润的MAIT细胞分泌IL-17的能力增强时,其功能也逐渐向促肿瘤的Th17极化型MAIT细胞偏移,这些细胞在肿瘤部位的富集通常与患者预后不良有关[27]。然而,在另一项肝癌患者的单细胞组学研究中,大量的MAIT细胞浸润却与更好的预后相关[28]。
综上,MAIT细胞在肿瘤免疫中可能具有双重作用,一方面,MAIT细胞在许多肿瘤模型中为抗肿瘤免疫应答做出贡献;相反的,MAIT细胞在一些肿瘤中释放促肿瘤细胞因子IL-17A,还可诱导肿瘤微环境对骨髓来源的抑制性细胞(myeloid-derived suppressor cells,MDSCs) 的招募,并增强对抗肿瘤反应的抑制,来加速肿瘤的侵袭和转移。因此,将来在利用MAIT细胞进行抗肿瘤治疗时,如何增强MAIT细胞的抗肿瘤免疫效应以及抑制MAIT细胞致瘤作用是研究者们需要解决的问题。
2.3 MAIT细胞在临床抗肿瘤免疫治疗中的潜在应用MAIT细胞是癌症免疫治疗中被寄予希望的治疗候选细胞。采用MAIT细胞治疗或MAIT细胞靶向治疗来重新编程其抗肿瘤功能是值得探索的重要途径。嵌合抗原受体T(chimeric antigen receptor,CAR-T)细胞疗法是过继性T细胞转移(adoptive T-cell transfer,ACT)的一部分。传统的T细胞免疫疗法治疗恶性肿瘤一直受到许多因素的阻碍,包括HLA基因型的高多态性限制了“现成的”T细胞或CAR-T细胞疗法在遗传多样性人群中的应用,因为可能出现移植物抗宿主病(graft-versus-host disease,GVHD)等副作用。而MR1是类Ⅰ型单形分子,其所限制的T细胞对完全不同种类的抗原具有独特的T细胞受体特异性。所以使用MAIT细胞可为任意受者生产通用的、随时可用的CAR-T,这种细胞不会对宿主MHC产生同种异体的排斥反应,也不会诱发移植物抗宿主病。因此,这些CAR-MAIT可以用于同种异体的情况[29]。Wakao等[8]通过使用自体MAIT细胞体外扩增制备MAIT-IPSC(redifferentiation of MAIT,reMAIT),并通过过继性转移reMAIT细胞到免疫缺陷小鼠体内,由此可以观察到reMAIT细胞的成熟以及细胞因子和趋化因子在体内的产生,证明了reMAIT细胞可以迁移到免疫缺陷小鼠的各种组织来产生功能效应。利用MAIT细胞进行治疗的临床试验还在探索阶段,但Crowther等[21]发现了一种通过稳定的MR1分子在泛癌细胞中具有识别能力的T细胞受体,它可以识别并杀死大多数人类癌症类型,同时对非癌细胞保持惰性。一旦安全性得到确认,CAR-T细胞疗法的局限性即可通过结合以TCR为靶点的MR1,这样的T细胞疗法来克服。
在免疫检查点治疗的可行性上,Favreau等[30]在循环MAIT细胞中发现PD-1水平升高,在体外阻断PD-1受体即可使MAIT细胞功能恢复,从而证明了免疫检查点疗法可抵抗外周血中的MAIT细胞缺乏和其功能损伤。Melo等[10]报道了MAIT细胞还可以在与耗竭的CD8+T细胞相似的水平上共同表达抑制受体NKG2A和PD-1,这意味着MAIT细胞能够参与以单独或联合的免疫检查点抑制剂疗法主导的靶向治疗。所以,可能需要一种MAIT细胞刺激与免疫检查点抑制剂相联合的治疗才能获得最佳和长期的抗肿瘤反应。众所周知,治疗性肿瘤疫苗是一种主动免疫疗法,旨在诱导荷瘤机体产生以CD8+T细胞为核心的抗癌免疫应答,从而消灭肿瘤。由于MAIT细胞的主要表型是CD8阳性,同时它还高表达与抗癌免疫监视有关的NKG2D,因此MAIT细胞显然是治疗性癌症疫苗设计的一个理想的靶点。人MAIT细胞在外周血和肝脏中相对丰富,这两处也是循环肿瘤细胞的常见目的地,不仅如此,在转移癌中还可以检测到MAIT细胞[27]。所以,利用MAIT细胞的体外扩增,并通过释放IFN-γ等抗肿瘤细胞因子,以及激发ADCC作用来施展MAIT细胞的抗癌潜能,这种方式可能会有助于MAIT细胞在治疗性癌症疫苗接种中发挥重要作用。简而言之,这些研究表明了MAIT细胞疗法的相关研究具备转化到临床上,并应用于临床肿瘤免疫治疗上的发展潜力和应用前景。
3 总结与展望
肿瘤免疫治疗的发展突飞猛进,是当前治疗肿瘤最热门的有效手段之一。活化状态的MAIT细胞可以直接或间接调控抗肿瘤免疫效应,并有能力召集多种免疫细胞,从而迅速而持续地增强抗肿瘤活性。而且与其他T细胞类型不同,MAIT细胞的水平不受化放疗治疗的影响。因此,MAIT细胞免疫治疗给癌症患者提供了一个好的选择。那么怎样获得充足的活化MAIT细胞就是成功开展癌症临床免疫治疗的关键。MAIT细胞培养基的选择,特异性的激活剂,细胞因子刺激以及共刺激分子等一系列高效体外扩增MAIT细胞的方法为开展MAIT细胞的肿瘤临床治疗提供了依据。不可否认,将体外扩增的MAIT细胞再转输回患者体内来杀伤肿瘤的过继性细胞转移疗法在临床治疗上表现出了一定程度的潜力,然而,扩增后活化的MAIT细胞是否保持相对较好的活性,并维持对肿瘤细胞持久性杀伤作用仍需进一步探索。尽管MAIT细胞疗法在基础研究上取得了一些令人鼓舞的成绩,但在临床试验上仍处于研究的起步阶段,因此未来还需要开展的更多临床试验以获得更多可行性的数据,相信MAIT细胞免疫疗法终将成为人类阻击肿瘤的尖端武器。