经皮肾镜与腹腔镜手术治疗重症急性胰腺炎并感染性胰腺坏死的临床疗效比较
2020-10-28李少一张昆鹏甄忠广
李少一,张昆鹏,甄忠广
(河北省邢台市人民医院 肝胆胰外科,河北 邢台 054000)
重症急性胰腺炎(severe acute pancreatitis,SAP)起病急、病情重、病死率高[1-6]。SAP约60%并发感染性胰腺坏死(infectious pancreatic necrosis,IPN),是导致多器官功能衰竭死亡的主要原 因[7-9]。除了内科综合治疗以外,外科手术清创仍是处理SAP合并IPN的最合理方式[10-11]。目前,重症胰腺炎的外科临床实践有几个变化趋势[2,12]:早期无菌性坏死不手术处理、感染性坏死采用更保守的处理、延迟进行微创手术干预[13]。微创手术方式如PCD引流、腹腔镜清创引流、腹膜后入路经皮肾镜清创及超声内镜下穿刺已逐渐成为主流[14-15]。本研究对比观察两种微创手术方式:经腹膜后入路肾镜胰周脓肿清创与腹腔镜清创的疗效,以进一步探讨经皮肾镜在SAP合并IPN患者中的应用 价值。
1 资料与方法
1.1 一般资料
选取我院2014年1月—2019年9月SAP合并IPN患者53的临床资料。按照手术方法分为经皮肾镜组26例和腹腔镜组27例。经皮肾镜组:男18例, 女8例;平均年龄(53.4±5.1)岁;入院至手术平均(29.8±3.3)d。腹腔镜组:男16例,女11例;平均年龄(52.8±6.7)岁;入院至手术平均(28.2±2.9)d。纳入标准:符合2019版中华医学会消化病学分会胰腺疾病学组制定的《中国急性胰腺炎诊治指南》[16],严重程度符合SAP合并IPN;所有患者术前规范保守治疗,均已行PCD引流。所有患者感染中毒症状明显,PCD引流效果欠佳。所有患者均签署手术治疗同意书,通过医院伦理委员会审批。排除标准:合并严重心肺功能不全,合并凝血功能异常者。两组患者一般资料比较无统计学差异(均P>0.05)(表1)。
1.2 手术方法
经皮肾镜组患者平卧于手术室,左侧适当垫高,静脉基础麻醉,局部消毒,铺无菌单,皮肤贴膜。术前PCD引流的入路即为本手术经后腹膜肾镜探查的入路。循PCD引流管置入梨型导丝,撤出导管。沿导丝使用经皮肾镜扩张套管,将窦道从8-F r逐步扩张至22-F r,置入鞘管或腹腔镜Trocar,脓液随即流出。使用经皮肾镜探查,在肾镜下生理盐水冲洗、吸引,洗净脓液,沿肾镜的操作孔置入抓钳抓取坏死组织。同时应用胆道镜配合探查,取石网篮清理。满意后置入双套管引流管,术毕(图1)。
腹腔镜组患者平卧于手术室,给予全身麻醉,上腹部常规消 毒,铺无菌单。于脐下缘切一小口做为观察孔,充入CO2,维持腹压在10~12 mmHg(1 mmHg=0.133 kPa)。再分别于剑突下和右锁骨中线肋缘下3 cm切口,必要时左侧锁骨中线肋缘下3 cm做第4孔。置入分离钳、吸引器、电钩等操作 器械。先钝性分离周围组织,打开胃结肠韧带,探查胰腺,打开胰腺背膜,从小网膜囊进入脓腔,吸净脓液,同时对照腹部CT,彻底切除清理坏死组织,钝性操作为主,大量生理盐水反复冲洗脓腔,满意后视情况置引流管1~2枚,术毕。

表1 两组患者一般资料比较Table 1 Comparison of the general data between the two groups of patients

图1 经皮肾镜手术治疗SAP 合并IPNA:手术器械;B:建立通道,脓液流出;C:镜下表现,可见脓液及坏死物质;D:镜下进行抓取操作;E.取出的坏死组织;F:术后置入引流管Figure 1 Percutaneous nephroscopic surgery for SAP with IPN A: Surgical instruments; B: Establishment of channels and the outfl ow of pus; C: Endoscopic appearance and the presence of pus and necrotic tissue; D: Grab operation under the nephroscope; E: Necrotic tissue removed; F: Postoperative drainage tube placement
1.3 术后处理
观察记录患者体温、引流量,检测白细胞计数(WBC)、降钙素原(PCT)、C反应蛋白(CRP)、白介素6(IL-6)、复查腹部CT。引流管内置入细输液管自制为双套管,每日使用2000 mL生理盐水对脓腔持续冲洗1 周。专人床旁换药,换药时注意保持引流管通畅,牢固固定,护理管周皮肤。若引流量少,体温仍高,说明坏死组织堵塞,脓液积存,及时更换引流管。各项指标稳定好转,引流减少后,分次退出引流管。体温正常,引流清亮,每日<30 mL,化验及CT满意,撤除引流管,约术后4周。
1.4 统计学处理
使用SPSS 19.0软件对数据进行处理。计量资料以均数±标准差(±s)表示,行t检验,计数资料行χ2检验,P<0.05定为差异有统计学意义。
2 结 果
2.1 两组患者手术情况与治疗结果
所有患者手术均顺利完成,经皮肾镜组中5例患者术后2 周床旁局麻下二次经窦道探查清理,腹腔镜组2例中转开腹。经皮肾镜组平均手术时间短于腹腔镜组[(51.8±3.5)minvs.(57.4±4.6)min]、平均术中出血量少于腹腔镜组[(50.2±1.2)mLvs.(65.8±2.7)mL]、平均术后排气时间短于腹腔镜组[(21.6±0.9)hvs.(22.7±2.4)h]、平均术后住院时间少于腹腔镜组[(48.5±3.9)dvs.(51.2±3.1)d]、平均住院费用少于腹腔镜组[(8.2±1.8)万元vs.(10.6± 1.3)万元]。差异均有统计学意义(P <0.05) (表2)。经皮肾镜组典型病例手术治疗前后CT影像资料见图2。
表2 两组患者手术相关指标比较(±s)Table 2 Comparison of surgery-related variables between the two groups (±s)
表2 两组患者手术相关指标比较(±s)Table 2 Comparison of surgery-related variables between the two groups (±s)
指标 经皮肾镜组(n=26)腔镜组(n=27) t P手术时间(min) 51.8±3.557.4±4.64.9740.000术中出血量(mL) 50.2±1.2 65.8±2.726.9970.000术后排气时间(h) 21.6±0.922.7±2.42.1930.033术后住院时间(d) 48.5±3.951.2±3.12.7960.007住院费用(万元) 8.2±1.8 10.6±1.35.8510.000
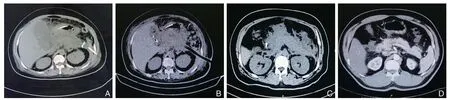
图2 经皮肾镜治疗SAP 合并IPN 患者CT 资料 A:术前影像,可见PCD 引流管和空肠营养管;B:术后1 d 影像,可见引流管;C:术后7 d 影像,CTSI 评分已明显下降;D:术后6 周影像,痊愈Figure 2 CT data of one patient with SAP and IPN treated by percutaneous nephroscopy A: Preoperative image, and the presence of PCD drainage tube and jejunal nutrient tube; B: Image of the first postoperative day, and the presence of drainage tube; C: CTSI score decreased significantly on postoperative 7 d image; D: Image of 6 weeks after operation showing complete healing
2.2 两组患者手术前后引流量与感染指标的变化
两组术后1、7 d引流量均较术前增加,体温、WBC、PCT、CRP、IL-6、胰腺炎CT 严重指数(CTSI)评分均较术前下降(部分P<0.05)。两组间上述指标在相同时间点差异均无统计学意义(均P>0.05)(表3)。
2.3 两组患者术后并发症与随访情况
两组患者术后均随访6 个月,肾镜组患者术后胰瘘2例,肠瘘2例,窦道出血3例,肺炎胸腔积液1例,胰腺假性囊肿1例,并发症共计9例,发生率34.6%,无复发病例;腹腔镜组术后胰瘘1例,肠瘘1例,腹腔出血1例,肺炎及胸腔积液5例,假性囊肿2例,并发症共10例,发生率37.0%,无复发病例。两组总并发症发生率差异无统计学差异(P>0.05)(表4)。
表3 两组患者感染指标比较(±s)Table 3 Comparison of infection indicators between the two groups of patients (±s)

表3 两组患者感染指标比较(±s)Table 3 Comparison of infection indicators between the two groups of patients (±s)
注:1)与同组术前水平比较,P<0.05Note: 1) P<0.05 vs.the preoperative value in the same group
指标 经皮肾镜组(n=26)腹腔镜组(n=27) t P 指标 经皮肾镜组(n=26)腹腔镜组(n=27) t P体温(℃) CRP(mg/L) 术前 39.71±0.86 39.45±0.69 1.2160.229 术前 153.05±15.59150.46±16.510.5870.560 术后1 d 38.44±0.751) 38.69±0.771) 1.1960.237 术后1 d 151.08±23.82149.16±21.130.3110.757 术后7 d 37.62±0.471) 37.26±0.821) 1.9510.057 术后7 d 22.91±3.251) 24.54±3.561) 1.7340.089引流量(mL) IL-6(pg/mL) 术前 13.4±3.8 12.8±2.4 0.6900.493 术前 53.61±5.17 52.06±5.81 1.0250.310 术后1 d 201.9±26.61) 195.4±23.11) 0.9510.346 术后1 d 22.89±3.631) 24.52±3.971) 1.5580.125 术后7 d 97.7±9.11) 92.6±11.31) 1.8050.077 术后7 d 12.35±2.741) 13.76±2.461) 1.9760.053 WBC(×109) CTSI 评分 术前 23.06±3.19 21.57±3.54 1.6080.114 术前 8.5±1.3 8.7±2.9 0.3220.749 术后1 d 22.89±4.62 25.09±4.881) 1.6840.098 术后1 d 8.4±1.5 8.3±1.4 0.2510.803 术后7 d 10.34±2.811) 11.72±2.741) 1.8100.076 术后7 d 7.6±1.11) 7.9±1.21) 0.9480.347 PCT(ng/mL) 术前 27.13±3.04 26.61±3.482) 0.5780.566 术后1 d 15.94±2.481) 14.74±2.331) 1.8160.075 术后7 d 6.87±1.511) 7.04±1.951) 0.3540.725

表4 两组患者并发症比较[n(%)]Table 4 Comparison of complications between the two groups [n (%)]
3 讨 论
微创手术为处理SAP合并IPN的理想方式,目前微创手术以腹腔镜清创和肾镜清创两种方式为主。2000年,英国的Carter教授[10]首次成功地开展了经皮肾镜胰周坏死脓肿的清除,2003年英国利物浦大学进一步报道了经皮肾镜治疗SAP合并IPN的手术方法[17],国内为2008年由中国人民解放军总医院肝胆外科蔡守旺等[18]率先开展了此手术。我院肝胆外科团队从2012年开展此项技术以来,经过多年摸索借鉴,对肾镜治疗SAP合并IPN具有了一些认识,对比于腹腔镜治疗的区别,现总结如下。
本研究入组所有患者感染中毒症状明显,行PCD引流效果欠佳,对此首先谈一下对PCD引流的认识。无论从日本急性胰腺炎处理指南(2015)[19]、意大利重症胰腺炎共识指南(2015)[2],到我国最新的急性胰腺炎诊治指南(2019)[16],均认为 4周以后为微创清创的最佳时机。4周内患者多处于S I R S 阶段,胰腺坏死组织与正常组织分界不清,过早清创只能增加手术风险[20-21]。所以此时以内科治疗及PCD多点引流为主[22]。对于肾镜治疗组的医师来说,PCD绝不能满足于穿上就行,而更应注意穿刺路径,为后续的微创肾镜手术做准备。最常用的为左右侧肾前间隙腹膜后通路,为了减少消化道损伤结肠瘘,应统一在CT定位下由本科医师进行操作。PCD引流2周后再根据病情决定是否进行下一步手术,期间PCD管应冲管、扩管、换管。这样既符合胰腺炎“创伤递进”“升阶梯”的治疗原则[23],又可使窦道壁逐渐牢固,显著降低下步肾镜手术后窦道出血的发生率。
其次,与腹腔镜相比,肾镜更具有微创精准的特性。全身麻醉不是必须的,局麻、基础麻醉、镇静止痛下床旁也可进行。与其说手术,更像是一种有创操作。这样,一些老年患者就避免了气管插管的麻醉风险,降低了术后转入ICU的风险,扩大了手术的适应范围。与腹腔镜手术相比,腹膜后入路经皮肾镜对患者肌体影响小,直接瞄准感染部位进行处理,对腹腔骚扰小,感染不易扩散,术后应激反应小。两组手术时间、术中出血量、术后排气时间、术后住院时间的对比可以看出,肾镜组患者创伤较小,恢复更快。随着肾镜使用熟练度的提高,也可以达到腹腔镜的手术效果。通过各项感染指标的对比,可见两组疗效相当。而软-硬镜结合技术[24-25],即肾镜联合胆道镜的运用,扩大了手术清除范围,减少了手术次数。肾镜组26例患者中仅5例术后二次经窦道探查清理。相对于早期报道[26],需多次经窦道清理的情况,有了一些进步。从术后处理上来看,除了双套管冲洗以外,笔者认为常规换药更是应该注意的。因为腹腔镜组的引流管在体腔中,而肾镜组患者的引流管在窦道中,相比之下后者更容易出现引流不畅,感染坏死堵塞的情况。所以日常的换药工作既是技术活,更是责任活,必须固定专人。换药时挤压、旋转引流管,或将管少量拔出再还纳,或更换新的引流管。
再次,从术后两组的并发症情况比较可以看出,虽然总体并发症发生率相比无差别,但每种并发症的发生有区别。腹腔镜组术后肺炎胸腔积液的发生率明显升高,说明已经影响了邻近器官,对肌体整体的创伤较大;肾镜组在窦道出血和消化道瘘上仍是偏高,这是肾镜本身的局限性所致,也是下一步应该在手术时机、操作手法、阶段性、器材选择上考虑的方向。现阶段两种方式各有优势无法替代:腹腔镜长于处理胰头胰颈胰腺前方的感染,还可以顺便处理胰腺炎的胆源性因素;肾镜长于处理胰体尾胰腺后方的感染,关键是创伤更小,使用灵活。进一步发展两者,有望取代开腹胰周清创。
近年来,随着微创手术及创伤控制理念的推广,以微创和内镜为中心的创伤递进式引流策略成为治疗SAP合并IPN的新标准[27]。超声内镜经胃壁穿刺内引流联合经内镜清创治疗的最新技术方案,同PCD引流联合软硬镜的清创治疗方案并称为“双模式引流”[22]。同超声内镜相比,肾镜要求的技术水平略低,更适合在地市级医院甚至基层医院广泛开展。本研究也只是在本单位单中心现有条件下两种治疗方案的比较,有一定临床参考价值但也有一定局限性。下一步,笔者团队将继续临床实践,积累病例资料,扩大病例数量,改进手术技巧,尝试一些腹腔镜和肾镜联合的病例与之进行比较,以进一步观察临床疗效。
