腹腔镜治疗功能性胰岛素瘤的临床应用疗效:附11例报告
2020-10-28崔永义马洪艳张国杰张春晨
崔永义,马洪艳,张国杰,张春晨
(河北燕达医院 普通外科,河北 廊坊 065201)
胰岛素瘤虽然罕见,但却是最常见的功能性胰岛细胞肿瘤[1],每年的发病率为1~5/100万[2]。约90%以上为胰岛B细胞的良性肿瘤[3],且90%为单发,10%为多发,90%左右的肿瘤位于胰腺内,发生在胰头、体和尾部的各占1/3[4-5]。80%~90%的胰岛素瘤最大径≤2 cm[6]。因为肿瘤过度分泌胰岛素,致使反复发作的低血糖症状,部分患者因合并神经系统症状,首诊误诊率高,危害性大[7-8]。
随着腹腔镜技术的进步,术中超声技术的广泛应用,安全、有效、创伤小的手术方式被外科医生所追求[9]。腹腔镜下胰腺手术近年来报道逐渐增多,其疗效与开腹相当,且并不增加并发症发生率[10],本文对我院11例行腹腔镜胰岛素瘤切除术患者的临床数据进行分析,旨在探讨腹腔镜胰岛素瘤切除术的可行性及疗效,以期为今后的临床工作提供一定的借鉴。
1 资料与方法
1.1 一般资料
2016年7月—2019年5月,我院行腹腔镜胰岛素瘤切除术的11例胰岛素瘤患者,男4例,女7例;就诊时年龄21~62岁,平均44.8岁;病程8 d至4年。11例患者均有“Whipple”三联症,即空腹低血糖症状发作,进食后症状缓解,发作时或至少有1次 空腹血糖<2.8 mmol/L,最低空腹血糖1.1 mmol/L。1例最初表现为精神异常,给予抗精神药物治疗,效果不佳,伴3 次晨起低血糖发作。低血糖发作时,均测胰岛素和血糖(IRI/B G)比值,且IRI/BG 比值>0.3。术前肿瘤标志物CA 19-9、癌胚抗原、CA 125、甲胎蛋白均为阴性。患者一般资料见表1。术前均行腹部B 超、增强CT 检查(图1 A),7例行腹部MRI 检查 (图1B)进行术前定位诊断。术中均应用腹腔镜术中超声进行术中定位诊断。

表1 11例患者的一般资料[n(%)]Table 1 The general data of the 11 patients [n (%)]

图1 影像学资料 A:增强CT 提示胰岛素瘤;B:MRI 提示胰岛素瘤 Figure 1 Imaging data A: Enhanced CT suggesting insulinoma; B: MRI suggesting insulinoma
1.2 手术方法
采用仰卧位,患者取头高位15°利于术野展开,术中根据操作步骤调整体位。胰腺体颈部肿瘤采用四孔法置入各型Trocar,观察孔(10 mm)位于脐下,切口穿刺制作气腹(12~14 mmHg, 1 mmHg=0.133 kPa)。腹腔镜监视下在左侧锁骨中线肋缘下置入12 mm Trocar作为主操作孔,在右侧腹直肌旁肋缘下、左腋前线肋缘下2 cm处分别穿刺5 mm Trocar 作为辅助孔。胰尾部肿瘤,腹部戳孔位于脐下、左右腹锁骨中线与平面交点脐、左右腋前线肋下5 cm置入各型Trocar。按序行腹腔探查后,胰腺颈体部肿瘤经小网膜入路,根据其所在部位用超声刀打开小网膜囊,显露胰腺 (图2 A)。腹腔镜下超声(L U S)全面探查胰腺,明确肿瘤部位、大小、数量及其与周围组织、胰管、血管间的关系,结合术前影像学检查共同评估肿瘤是否可安全切除及手术方式的选择。肿瘤直径≤2 cm,且距离主胰管2~3 mm以上者,若突出于胰腺表面,用超声刀沿肿瘤周围,完整切除肿瘤,创面电凝止血;肿瘤位于胰腺实质内者,结合术中超声定位,用4-0 不可吸收线贯穿缝合牵引瘤体,超声刀沿瘤体边缘完整切除(图2 B),纤维蛋白胶覆盖肿瘤床。当肿瘤位于胰腺实质内且距主胰管最短距离≤2 m m,考虑损伤主胰管可能性大,行保留脾脏的胰体尾切除术。切除肿瘤后均送术中快速冷冻明确肿瘤良恶性。成功切除肿瘤后,再次行腹腔镜下超声检查,以防遗漏多发肿瘤而导致手术失败。手术创面留置乳胶引流管1根。离断标本后30 min、术后第1天清晨均测血糖。
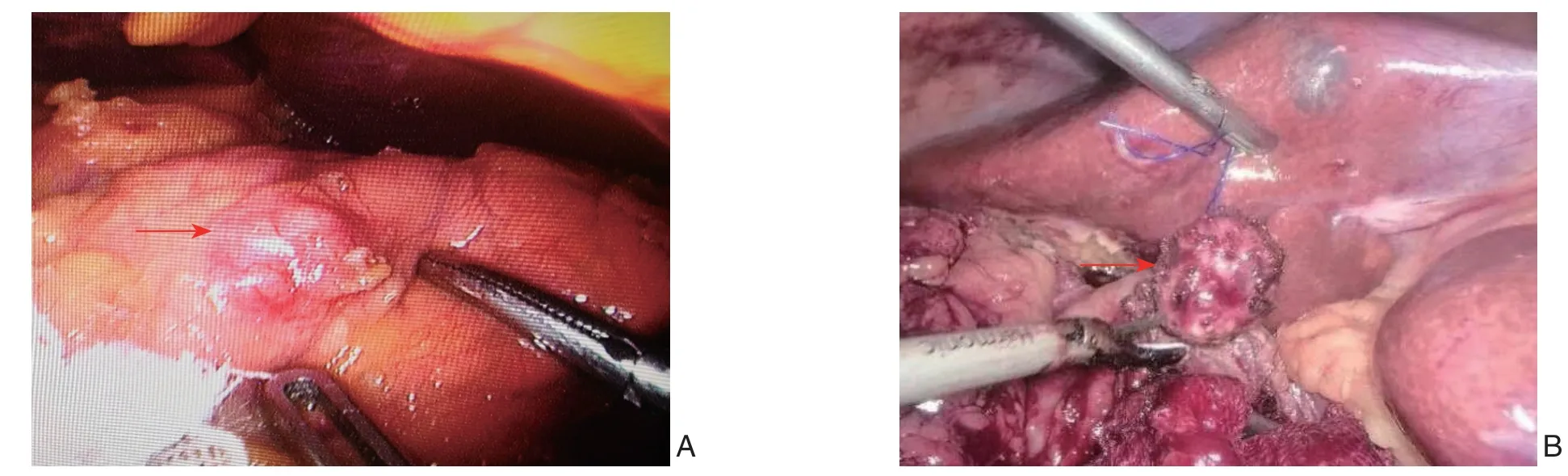
图2 术中照片 A:肿瘤探查;B:切除肿瘤Figure 2 Intraoperative views A: Tumor exploration; B: Tumor resection
2 结 果
2.1 手术情况与手术结果
10例患者成功在腹腔镜下完成手术,手术时间85~380 min,术中出血量10~530 mL,均未输注红细胞和血浆。其中8例行胰岛素瘤切除(胰腺颈部2例,体部5例,尾部1例);2例行保留脾脏的胰腺体尾部切除(胰腺体部1例,尾部1例)。术中发现肿瘤11枚,其中0.5~1 cm肿瘤4枚,1 ~2 cm肿瘤6枚,2.2 cm肿瘤1枚。1例患者因术中腹腔镜超声未探及肿瘤,与家属交代病情后终止手术。术中经取物袋完整取出肿瘤后,送快速冷冻,均为良性胰岛素瘤(表2)。

表2 患者的术中指标与手术结果[n(%)]Table 2 The intraoperative variables and surgical results of the patients [n (%)]
2.2 术后情况与随访结果
3例出现术后并发症,1例出现胰瘘(A级),经禁饮食、药物治疗后治愈。2例出现反跳性高血糖,血糖范围10.4~17.2mmol/L,经保守治疗,血糖恢复正常。术后首次下床活动时间1~2 d,术后肛门排气时间1~3 d;术后首次进食时间1~2 d;患者术后拔除腹腔引流管时间为3~13 d,术后住院时间5~15 d。肿瘤切除30 min后,血糖升高1.5~ 2.3 mmol/L。术后病理均证实为良性胰岛素瘤。术后第1天清晨血糖3.9~10.4 mmol/L,出院时血糖2.4~12.8 mmol/L。11例患者出院后,10例低血糖症状完全消失,1例因未能探及肿瘤,对症治疗。术后11例患者获得随访,随访时间为10~43个月。10例切除肿瘤者,低血糖症状完全消失,肿瘤无复发和转移,症状无再发,1例因手术未成功,术后血糖依然降低,是否存在胰岛素瘤需进一步 随访(表3)。
表3 患者的术后指标与随访结果[n(%)]Table 3 The postoperative variables and follow-up results of the patients [n (%)]
3 讨 论
胰岛素瘤虽然罕见,但它是最常见的功能性胰岛细胞肿瘤。以分泌大量胰岛素而引起发作性低血糖症候群为特征,常有典型的Whipple三联征[11],临床表现多样且复杂,容易误诊而延误治疗,危害极大。
随着影像学技术的进步,越来越多的胰岛素瘤被早期发现而需要治疗,虽然非手术治疗可以取得一定的效果[12-15],但是手术是唯一能治愈胰岛素瘤的方法[16-17]。手术方式需根据肿瘤的大小、数目、位置与良恶性进行选择。以往,胰岛素瘤切除只能开腹手术,通过手触摸的感觉结合术中超声寻找并切除肿瘤,由于胰腺位置深且周围解剖结构复杂,为了充分暴露手术视野探查并寻找胰腺肿瘤,致使手术切口大,创伤大且并发症多,可谓切除“小小的肿瘤”而留下“大大的创伤”,所以亟需精准微创的手术方式解决“小小的肿瘤”。
腹腔镜设备的进步、微创外科理念的深入人心,外科医师腹腔镜技术的提高,腹腔镜胰腺外科手术逐渐成熟[18]。相较开腹胰腺手术,腹腔镜的“微创”优势明显[19-20],随着影像学检查技术的进步,结合腹部彩超,腹部增强CT,腹部增强MRI检查,术前定位诊断并不困难,术中准确定位发现肿瘤是成功切除肿瘤的关键。胰岛素瘤瘤体质韧偏硬,位于胰腺表面者容易发现,但胰腺实质内的较小肿瘤,胰腺形态变化不大,很难发现。腹腔镜手术缺少了外科医生手的触摸,无法通过触觉感知肿瘤的存在,降低了术中肿瘤的准确定位,所以术中必须结合腹腔镜超声探查。腹腔镜超声结合了腹腔镜探查和术中超声的优势,分辨率高,可以发现<1 cm的隐匿病灶,其对胰岛素瘤定位的平均准确率可达到90%[21],腹腔镜与术中超声对胰岛素瘤进行精准切除,最大限度保留正常胰腺组织,减少手术创伤.缩短手术时间,出血、感染发生率极低[22]。本组患者中,10例通过腹腔镜超声成功定位肿瘤并切除,其中需要注意的是,1例胰腺体部肿瘤患者,肿瘤切除后用腹腔镜术中超声再次复查,发现胰尾部直径0.5 cm肿瘤并行肿瘤剜除,所以建议肿瘤切除后腹腔镜术中超声再次探查避免因多发肿瘤的存在而致手术失败。1例患者因术中腹腔镜超声未探及肿瘤而终止手术。
对于手术适应证的把握,胰岛素瘤切除术适用于直径≤2 cm,距离主胰管2~3 mm以上、快速冷冻病理学检查提示良性者[23]。2009年,戴梦华等[24]报道了18例全腹腔镜下胰岛素瘤切除术,证实全腹腔镜胰岛素瘤切除术安全可行,尤其肿瘤位于胰头表面或胰体尾部,更优于经典的开腹手术。就腹腔镜手术适应证把握而言,腹腔镜胰岛素瘤切除术主要适用于胰体尾部比较表浅的胰岛素瘤摘除,或适合行胰体尾切除的病例[25]。根据术前影像学定位,如果肿瘤位于胰腺钩突部, 或位置较深与Wirsung管关系密切者,建议行传统的开放手术。
通过严格的病例筛选,本组患者通过术前影像学明确肿瘤大小、位置及与主胰管、血管的关系,10例患者通过腹腔镜术中超声配合,多方位、多角度探查,在寻找肿瘤的同时,明确肿瘤与主胰管的关系后,8例行胰岛素瘤切除,2例行保留脾脏的胰腺体尾部切除术,均完整切除肿瘤,术后患者血糖恢复正常,取得了良好的手术效果。1例腹部增强CT发现胰体部直径0.7 cm肿瘤者术中未发现肿瘤,考虑为胰岛细胞增生症,需进一步随访。
既往开腹手术,由于胰腺的解剖位置原因,不论胰腺肿瘤位于何处,为了增加操作空间和用手法触及肿瘤,均需要打开胃结肠韧带进入小网膜囊,将胃向头侧牵拉,暴露胰腺,胰头部肿瘤则需打开十二指肠侧腹膜寻找肿瘤,导致创伤较大,增加手术时间和术中出血。2017年,刘荣等[26]报告了6例经小网膜入路腹腔镜下胰腺颈体部的胰岛素瘤的切除,该入路简单直接,能安全快速地获得良好的手术视野及操作空间[27]。本组患者,经术前影像学定位,明确肿瘤的位置及与胰管、血管的关系,做到心中有数。术前影像学评估肿瘤位置表浅,距离主胰管2~3 mm的7例患者,术中首先打开小网膜,暴露胰腺,探查发现位于胰腺表面的肿瘤7枚,术中超声探及8枚,再次明确肿瘤与主胰管、血管的关系后用超声刀沿肿瘤进行切除,手术时间短,均顺利完成;1例位于胰腺体部肿瘤未能直视下发现,经腹腔镜术中超声明确位置后,用4-0不可吸收线贯穿缝合牵引瘤体,超声刀沿瘤体边缘完整切除。另外2例患者,体部 1枚,尾部1枚,肿瘤直径均<2 cm,术前MRI评估肿瘤与主胰管关系密切,术中打开胃结肠韧带、脾胃韧带、小网膜囊,用扇形撑开器将胃抬起,术中超声再次明确肿瘤与主胰管关系密切,行肿瘤切除容易损伤胰管导致胰瘘,故行保留脾脏的胰体尾切除术,顺利切除肿瘤。
术后胰瘘是胰腺切除术后发生率最高,也是后果最严重的并发症,是决定胰腺切除术后预后的最主要因素[28-29],对手术相关病死率、住院时间和医疗费用有重要影响[30]。本组1例胰腺体部肿瘤切除患者出现胰瘘(A级),抑制胰酶保守治疗13 d后拔除腹腔引流管出院。胰岛素瘤局部切除后胰腺创面往往无法缝合,易发生胰瘘[31],故术中应沿着肿瘤边缘切除,尽可能保留正常胰腺组织的,防止胰瘘的发生。对于较浅的肿瘤,创面用电凝处理;若肿瘤创面较深,纤维蛋白胶覆盖肿瘤床,术中常规将乳胶引流管放置在小网膜囊肿瘤切除部位附近。对于2例胰体尾切除患者,因胰腺较薄,胰腺残端经Endo-GIA处理后闭合良好,断端留置乳胶引流1枚。术后如排除胰瘘发生可能,应早期拔除腹腔引流管,促进患者快速康复。
通过对本组11例患者的诊疗过程进行总结,术前完整的定位、定性诊断,术中腹腔镜超声定位保驾护航,对位于胰颈、体尾部表面及适合胰体尾切除的良性胰岛素瘤者,腹腔镜下手术切除安全、有效、创伤小,是一种可选择的手术方法,值得临床推广。
