气肿性胰腺炎3例报告并文献复习
2020-10-28曹利军张频捷胡秋源陈虎孙昀
曹利军,张频捷,胡秋源,陈虎,孙昀
(安徽医科大学第二附属医院 重症医学科,安徽 合肥 230601)
急性胰腺炎是一种常见的急腹症,具有较高的发病率和病死率。气肿性胰腺炎(emphysematous pancreatitis,EP)是急性胰腺炎一种罕见的表现[1],具有较高的病死率。虽然近年来EP 的文献报道逐渐增多,但多以个案报道为主,无大样本的研究,故EP的发病率达尚未见确切统计[2]。2012年亚特兰大标准中未对EP进行明确归类,国外关于EP的治疗原则方面尚未达成共识,且国内文献尚未见相关报道,造成国内医师对该病缺乏认识,延误了患者的治疗。本文总结了2018年6月—2019年 2月收治的3例EP患者的临床病例特点,查阅国内外文献,分析讨论该病的临床特征、发病机理及影像学特征、治疗及预后,加强临床医生对该病的认识,提高此类患者的存活率,现报告如下。
1 资料与方法
1.1 病例资料
患者1 男,72 岁。腹痛半日于2018年6月 29日入院,既往有高血压病史,自服吲达帕胺控制血压在正常范围,无糖尿病病史。病程中伴恶心呕吐,呕吐物为胃内容物,无发热,无胸闷及呼吸困难,无呕血及黑便。入院体检:体温36.0 ℃,脉搏78次/min,呼吸19次/min,血压157/95 mmHg(1 mmHg=0.133 kPa)。神清,精神可,痛苦貌,皮肤、巩膜无黄染,双肺呼吸音粗,未闻及明显干湿性啰音,心律齐,腹膨隆,腹部压痛阳性,未及反跳痛,肠鸣音可闻及,双下肢无水肿,四肢活动可。CT提示急性胰腺炎征象。入院实验室检查:白细胞计数18.89×109/L,红细胞计数5.67×1012/L,血红蛋白176 g/L,血小板计数176×109/L。谷丙转氨酶36 U/L,谷草转氨酶32 U/L,总胆红素14.0 μmol/L,直接胆红素6.0 μmol/L,肌酐135 μmol/L,总胆固醇3.23 mmol/L,甘油三酯0.41 mmol/L,淀粉酶608 U/L,脂肪酶3160 U/L。入院后予以禁食,胃肠减压,头孢他啶预防感染,抑酸抑酶,补液等对症治疗。2018年7月1日B超定位下腹腔穿刺置管引流,引出黑褐色及坏死样液体约800 mL。2018年7月2日出现谵妄,高热(39 ℃),呼吸急促转入ICU,当日腹部CT提示胰腺坏死、胰周有大范围气体影,给予美罗培南抗感染治疗,7月3日口服泛影葡胺后CT检查提示胰周有大范围气体影及胰尾部高密度影,未见肠道内造影剂外溢(图1)。7月5日因患者仍持续发热伴意识转差,行 剖腹探查+胰周坏死组织清除”。术中见:胰周大量坏死组织及深褐色渗液约300 mL及大量气体。术中组织培养为屎肠球菌,给予利奈唑胺应用。术后28 d出现腹膜后大出血,保守治疗无好转当日自动出院并于当日死亡。

图1 CT 显示胰周有大范围气体影(白色箭头)及胰尾部腹膜后出血(箭头)Figure 1 CT showing an accumulation of gas (shown by the white arrow) in the pancreas and retroperitoneal hemorrhage in tail of pancreas (shown by the arrowhead)
患者2 女,70岁。因腹痛1 d于2018年12月25日入院,无胆道结石、糖尿病、高脂血症及结缔组织病病史,发病前无饮酒及暴饮暴食史。患者于2018年12月24日无明显诱因下出现腹痛,为上腹部持续性胀痛,以脐上最为明显,无畏寒发热、恶心呕吐、呕血黑便等不适,当时自觉疼痛尚能耐受,未行诊治。2018年12月25日自觉症状较前明显加重,当地医院就诊行上腹部彩超检查后以胰腺炎收治,症状改善不明显且出现少尿,遂转入我院进一步诊治。入院急诊CT提示胰腺形态饱满,胰腺周围及腹腔多发渗出及积液,门静脉及胰腺周围多发积气(图2),拟胰腺炎、消化道穿孔可能收住重症医学科。入院体检:体温36.8 ℃,心率100次/min,呼吸25次/min,血压90/60 mmHg。神清,精神差,呼吸急促,腹部稍胀,腹肌紧张,全腹可触及压痛及明显反跳痛,未闻及肠鸣音。实验室检查:白细胞计数1.97×109/L,血淀粉酶2840 U/L,脂肪酶6448 U/L,血降钙素原19.650 ng/mL,C-反应蛋白166.2 mg/L。入院诊断急性胰腺炎,急性弥漫性腹膜炎,感染性休克,消化道穿孔,当日急诊在全麻下行腹腔镜探查+中转开腹胰腺被膜切开减压+腹腔引流术,术中腹腔镜探查见腹盆腔黄色脓性液体约300 mL,胆囊未见结石及坏死穿孔,胃,小肠,结肠,回盲部肠管壁暗红色,胰腺被膜水肿,表面覆盖黄色脓苔样皂化斑,腹膜后较多坏死组织及气体,中转开腹行胰腺被膜切开减压+腹腔引流术。术前、术后血培养和术中组织液培养均阴性。术后休克仍难以纠正,出现多脏器功能不全(呼吸循环衰竭、肝衰竭、肾衰竭、消化道衰竭等),给于血液净化等治疗后病情仍进一步恶化,2018年12月28患者家属要求自动出院并于当日死亡。
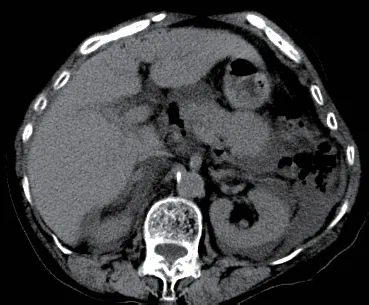
图2 CT 显示胰头与胰尾区域多发积气(白色箭头)并扩展至腹膜后间隙Figure 2 CT of showing air in the region of pancreatic head and tail (white arrows) extending into the retroperitoneal space
患者3男,76岁。2019年2月3日因腹痛20 h余入院。既往有高血压病史,不规律服药;5年前行胆囊切除术,2年前行胆石症手术治疗,具体不详。无糖尿病、高脂血症及艾滋病等病史。患者入院前20 h进食鱼汤鱼肉后出现右上腹痛,持续不能缓解,逐渐加重伴呕吐,呕吐物为内容物,无畏寒发热、呕血及黑便。入院体检:体温36.7 ℃,脉搏120次/min,呼吸26次/min,血压160/80 mmHg。神志清楚,精神可,皮肤巩膜未见黄染,双侧肺呼吸音清,心律齐,右上腹压痛,无反跳痛,肝脾肋下未及,耻骨上膨隆,余腹无压痛反跳痛,移动性浊音阴性。入院实验室检查白细胞计数13.71×109/L,红细胞计数5.83×1012/L,血红蛋白179 g/L,血浆凝血酶原时间13.5 s,纤维蛋白原2.45 g/L,纤维蛋白(原)降解产物23.33 μg/mL,血浆D-二聚体6.98 μg/mL,白细胞介素6546.0 pg/mL,降钙素原1.360 ng/mL,总胆红素58.7 μmol/L,直接胆红素49.8 μmol/L,总蛋白76.2 g/L,白蛋白35.5 g/L,肌酐85 μmol/L,尿素氮7.60 mmol/L,钾4.91 mmol/L,钠141.7 mmol/L,甘油三酯0.30 mmol/L,淀粉酶1484 U/L,脂肪酶3181 U/L。外院CT提示急性胰腺炎。入院后立即给予脉搏指示连续心输出量监测指导下补液扩容,腹腔穿刺置管引流,引流出黄褐色液体,间断无创通气。入院后出现发热不适,高峰达38.5 ℃,2月12日复查CT提示胰腺显示不清,胰周积气影,2月13消化道造影显示胰周积气、未见造影剂外溢(图3)。2月17日因反复发热,行左侧腹膜后穿刺置管引出红豆色含气高张液体后体温下降,穿刺液培养为大肠埃希氏菌,血培养为洋葱伯克霍尔德氏菌。2月28日突然出现血压下降,血红蛋白偏低,急诊行选择性动脉造影见胃网膜右动脉远端可疑异常染色,用直径为4 mm微弹簧圈栓塞血管,复造影异常染色消失。随后患者病情平稳,但左侧引流管处有粪臭味,考虑有结肠漏可能,于2019年3月5日剖腹探查见腹膜后较多坏死组织,降结肠穿孔,周围渗出较多并可见粪水样,行腹腔坏死组织清除及横结肠造瘘术,术后1个月康复出院。

图3 CT 显示胰腺腹膜后间隙积气影(白色箭头)Figure 3 CT showing an accumulation of air in the pancreas and retroperitoneal space (white arrow)
2 讨论并 文献复习
EP是急性坏死性胰腺炎的一种亚型,以胰腺内部和周围出现气体为特征[3-5]。虽然近年来EP的文献 报道逐渐增多,但国内文献尚未见相关报道,原因可能与把EP直接归类于坏死性胰腺炎继发腹膜后感染、未单独列出有关。EP主要发生在糖尿病、慢性肾病、心血管疾病疾病或其他免疫损害的虚弱患者以及嗜酒者[6-10]。临床主要表现为腹痛,恶心呕吐以及发热等[3,11]。
EP的确切发生机制尚不完全清楚。根据气体出现的早晚,EP可分为两种亚型:急性发作的侵袭性早发型EP和迟发型EP,气体出现时间的差异可能与病因有关[2]。胰腺内及胰腺周围气体的两种主要来源是由可以产生气体的微生物引起的多菌感染,如肠杆菌科或厌氧菌,以及胰腺和消化道两者之间的瘘管[12-13]。肠腔内产气菌进入胰腺导致EP的主要途径包括血源性和淋巴扩散,以及回流经壶腹或邻近横结肠经系膜的直接侵入[14]。在病原菌中,大肠杆菌、肺炎克雷伯杆菌、铜绿假单胞菌、产气荚膜杆菌等是最分离到的致病菌[3,11,15]。患者1、3血培养和组织液培养均阳性,考虑气体来源为肠道内产气菌感染感染所致;尽管患者2血培养和组织液培养均阴性,但术中并未发现胆道结石、肠瘘以及胰瘘,肠管呈缺血表现,故仍考虑气体系肠道黏膜缺血菌群移位感染所致。胰腺坏死感染引起的败血症和腹膜后出血引起的低血容量血症是急性胰腺炎的主要致命并发症。大约10%~40%的急性坏死性胰腺炎患者会坏死组织感染[12]。当感染和坏死同时存在时,病死率可高达50%~70%[7]。EP作为急性坏死性胰腺炎的一种亚型,是一种罕见的危及生命的疾病,既往有文献报道,EP的病死率可以达到10%~36%[3,15]。Wig 等[6]认为如果采用积极的管理策略,EP患者的临床结果与非气肿性感染性胰腺坏死患者相似。Bul等[3]认EP的预后较差,病死率较高,多器官功能衰竭是患者死亡的一个重要预测因素,与性别、年龄等因素无明显相关性,这与先进的支持性护理和减少手术干预可以提高生存的观点密切相关。但目前还没有文献对这一患者群体进行系统分析,以确定与病死率相关的风险因素。
由于超声评估很难发现胰腺或胰腺周围局灶性气体,因此不能单独用于EP的诊断[16]。在CT出现之前,EP的诊断主要通过X线片、术中检查或尸检来确诊[3]。腹部CT被认为是检测异常气泡的最佳成像方式,具有较高的灵敏度和敏感性,通过CT图像很容易发现胰腺内/胰腺周围气体,故CT成为诊断EP的首选[5,9,17-19],本文3例均系经CT检查诊断为EP。CT图像上出现胰腺或胰腺周围气体并不代表一定能诊断为EP,需排除内镜下仪器或括约肌切开术后或盲放营养管等医源性因素导致出现腹膜后气体才能确诊EP[1]。
急性胰腺炎的治疗趋于保守,已经由过去积极的外科手术转向各种微创引流或清创的方法,大大降低了胰腺炎感染性坏死患者的病死率与并发症发生率[20]。以经皮穿刺置管引流为基础的“升阶梯”治疗策略已成为治疗胰腺坏死继发感染的主流策略[21-22]。国内有多项研究显示,B超或CT引导下的各种穿刺置管引流治疗重症急性胰腺炎继发胰周坏死感染均取得较好的疗效,且并发症发生率低[23-24]。但EP的治疗策略国外目前还没有达成共识。关于气肿性胰腺炎的治疗方法主要有两种:保守治疗,包括广谱抗生素治疗,经皮穿刺引流和内镜技术;手术清创,可剖腹或腹腔镜[17]。既往一些报道[12,25]表明,EP可以通过保守治疗和重症监护获得良好的治疗效果,然而,这些选择的患者预后较好,往往与其为迟发性EP有关。本文患者3在发病10 d后出现腹膜后气体,属于迟发型EP,预后较好,与上述文献相符。相反,在早期出现胰腺或胰周气体的患者,病情往往会急骤恶化[26-27]。本文患者1、2在发病1周内即出现腹膜后气体,属于早发性EP,预后较差,患者3为迟发型EP,预后较好,与Birgisson等[26]研究相吻合。已经有较多文献报道了EP经保守治疗成功的案例。Nadkarni等[15]报道保守治疗存活率可以达到89%(8/9),而Rasslan等[28]报道了 6例EP 患者经过保守治疗完全治愈。与前述相反,部分研究人员则认为对于EP患者应该积极手术干预治疗。Wig等[6]报道了11例气肿性胰腺炎均行坏死性组织清除术,病死率36.4%,其中5例患者行手术前行经皮穿刺置管引流术,病死率达 20%(1/5),低于总病死率水平。另有学者认为对于EP的治疗应当遵循和坏死性胰腺炎相同的原则。Bul等[3]就认为由于对于EP的治疗除了像感染坏死性胰腺炎治疗那样除静脉输液外,还应包括广谱抗生素和营养支持,并根据具体情况确定经皮穿刺置管引流治疗。在感染坏死的稳定患者中,最好将引流延迟至少4 周,以使内容物液化并形成封闭坏死。对于有难治性症状或其他急诊手术适应症的患者,如腹腔大出血、内脏穿孔或腹腔间隔综合征的,微创手术是首选。Xi等[29]也认为及时使用抗生素和/或经皮引流积液是至关重要的,手术切除受感染的坏死组织可作为保守治疗失败的后备措施。Verbeeck等[30]认为EP是一种危及生命的疾病,需要早期诊断和积极的多学科治疗,包括胃肠病学、重症监护医学、介入放射学,甚至外科。本文患者1虽为早发性EP,但如果当时能够给予经皮腹膜后穿刺置管引流,同时加强支持对症等处理,延迟4周后再行开腹手术,降低术后大出血的可能,可能会有不一样的结局。患者2 亦为早发型,但情况与患者1 又不完全相同,腹膜后积气同时出现了门静脉积气,术中发现肠道有缺血表现,但因存在侥幸心理,未行坏死肠管切除,出现多脏器功能不全,导致病情进一步恶化,最终死亡。患者3遵循了感染性胰腺坏死的治疗原则,预后较好。
回顾分析3例患者的治疗经过,本研究认为:(1) 临床医师对EP缺乏认识,当CT表现为EP时容易误认为消化道穿孔等情况而过早进行手术干预。(2) 造成EP的病原菌多种多样,以肠杆菌多见;可为单菌感染,亦可为混合菌感染,可以为杆菌感染,亦可为球菌感染或真菌感染,在抗生素治疗时应该覆盖这些可能的病原菌。(3) EP作为急性坏死性胰腺炎的一个亚型,治疗方式与感染坏死性胰腺炎并无多大差异,无论早发型还是迟发型,均需在广谱抗生素抗感染治疗的基础上进行穿刺置管引流等微创方法治疗,避免进行积极的手术干预,增加术后腹膜后出血等并发症的风险,从而增加了病死率。开腹清创手术尽量延迟至发病4 周后再进行,但对于同时出现门静脉积气,高度怀疑肠管坏死感染者,应积极剖腹探查并切除坏死肠管,避免术后多器官功能不全的发生,从而降低患者的病死率。
EP 是一种可危及生命的疾病,成功的治疗需要早期积极的广谱抗生素使用,控制感染性休克,经皮引穿刺流等保守治疗,如仍不能治愈,尽量延迟至发病4周后再行坏死组织清除术。
