开放胰腺坏死组织清除术治疗感染性胰腺坏死的适应证及临床价值分析
2020-10-28宁彩虹朱帅申鼎成曹昕彤林嘉晏李嘉荣纪连栋魏伟黄耿文
宁彩虹,朱帅,申鼎成,曹昕彤,林嘉晏,李嘉荣,纪连栋,魏伟,黄耿文
(中南大学湘雅医院 胰腺外科,湖南 长沙 410008)
由于重症医学的进步、各类微创技术的发展以及多学科合作(multidisciplinary team,MDT)机制的建立,急性坏死性胰腺炎(acute necrotizing pancreatitis,ANP)的外科治疗在干预时机、干预指针以及干预方法等方面均发生着深刻而重大的变化[1-3]。在大型、专业化的胰腺炎治疗中心,以经皮穿刺引流(percutaneous catheter drainage,PCD)[4-6]、微创入路腹膜后胰腺坏死组织清 除术(minimal access retroperitoneal pancreatic necrosectomy,MARPN)[7-9]、超声内镜下胰周积液穿刺及胰腺坏死组织清除术[10-12]等为代表的各类微创技术已经成为主流。大量的临床研究表明,与传统开放胰腺坏死组织清除术(open pancreatic necrosectomy,OPN)[13]相比,微创手术可显著改善患者病死率,降低器官功能衰竭等并发症的发生率[7-8,14]。然而,OPN 作为感染性胰腺坏死(infected pancreatic necrosis,IPN)外科治疗的最终策略,仍然占据着不可替代的地位。在微创的时代背景下,OPN在手术时机、指征、方法等方面呈现出新的特点。现有的研究已经证实在合理的指针及时机下,开展创伤递升式OPN手术的安全性和有效性[15-18]。鉴于此,本文回顾性总结2014年1月—2019年5月间,中南大学湘雅医院连续收治的140例IPN患者,重点对其中24例行OPN治疗的IPN患者进行分析,旨在探讨微创 时代下OPN治疗IPN的新特点。
1 资料与方法
1.1 病例资料
回顾性分析2014年1月—2019年5月中南大学湘雅医院连续收治的140例IPN患者临床资料,患者均符合ANP诊断标准,且胰周引流液的细菌或真菌培养为阳性[19-20]。其中男98例,女42例,平均年龄47.3岁;病因包括胆源性54例,高脂血症性70例,其他原因16例。行OPN治疗24例(17.1%),行单纯微创手术治疗116例(82.9%)。24例行OPN治疗的IPN中,参照2012年修订的亚特兰大分类标准[21]分为中度重症3例,重症21例;病因主要包括胆源性(50.0%,12/24),高脂血症性(45.0%,11/24),其他原因(5%,1/24)。OPN 组与微创手术组间比较,前者重症患者比例高于后者(P <0.05),其他资料均无统计学差异(均P>0.05)(表1)。
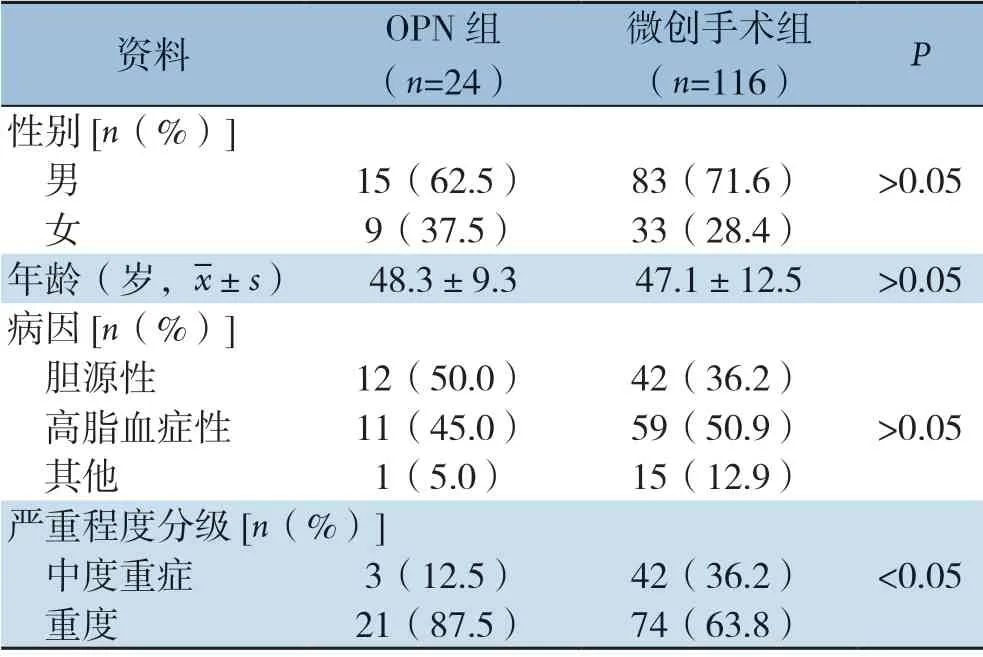
表1 OPN 组与微创手术组一般资料Table 1 The general data of patients undergoing OPN and minimally invasive surgery
1.2 治疗方法
所有患者均按照急性胰腺炎诊治指南进行规范化治疗[19-20,22]。我院建立了由胰胆外科、重症医学科、消化内科、感染控制中心、影像科、介入科、康复科、中西医结合科、神经内科等在内的MDT 团队,通过定期会诊共同决策重症胰腺炎的治疗方案。早期主要治疗措施包括积极的液体复苏、早期肠内营养、器官功能支持、依据细菌培养和药敏结果合理选用抗生素等。晚期治疗措施包括OPN和微创手术治疗(包括PCD、MARPN)。其中,IPN合并出血患者采取微创、创伤递进式处理原则,优先采取经DSA行经导管动脉栓塞术治疗;当患者无介入手术条件或介入手术无法找到出血点时,则采取OPN方式,术中结扎止血或采用 外科纱布、止血材料压迫填塞广泛渗血的胰床。IPN合并肠瘘的患者通过充分控制感染源结合积极有效的肠内营养支持进行治疗。
1.3 OPN 的手术指征和原因
本组OPN 的手术指征和原因包括:(1) 无PCD路径1例(3.2%);(2) 虽有PCD穿刺路径,而且并无严重并发症,但仍主动选择OPN 5例(20.8%);(3) 微创治疗后感染仍难以控制6例(25.0%);(4) 继发严重的并发症,如肠管损伤、肠瘘、胆瘘、大出血等9例(37.5%);(5) 外院已行腹腔开放,但感染仍无法控制3例(12.5%)(图1)。

图1 OPN 的手术指征和原因构成Figure 1 Constitute of indications or reasons for OPN
1.4 OPN 的手术时机和手术步骤
本组OPN干预距离起病的平均时间为49.3 d,延迟干预是本组OPN手术时机的总特点。本组所有OPN手术均采取气管插管全身麻醉。主要根据CT等影像学检查结果,依据就近原则,路径精准地灵活选择手术切口,包括上腹部横行切口、上腹正中切口、一侧肋缘下斜切口等。如果转入我院时已经在外院行开腹手术,甚至腹腔开放,则往往选择原切口。一旦进入坏死组织脓腔,采取“通畅引流、适度清创”的总原则,采取轻柔的外科手法,尽量避免造成新的肠瘘或出血。脓腔内往往需要放置多根引流管,以利术后冲洗,保持畅通。术中脓液及坏死组织常规送培养和病理学检查。
1.5 与OPN 同时进行的其他手术方式
本组24例OPN患者除了采取开放手术之外,还经历了PCD治疗39例次、MARPN手术20例次、胆囊造瘘术6例次、胆总管切开取石或探查术2例次、胆囊切除术1例次、胆囊部分切除术1例次、胃造瘘术2例次、营养性小肠造瘘术5例次、结肠瘘修补术2例次。微创手术与OPN的联用方式,按照联用的顺序可以归纳为:PCD+OPN(9例)、PCD+MARPN+OPN(5例)、PCD+OPN+MARPN(1例)、PCD+OPN+PCD(1例)、OPN+PCD(1例)、OPN+MARPN(1例)、OPN+MARPN+PCD (1例)、OPN+PCD+OPN (1例)、单纯OPN(4例)。
1.6 统计学处理
采用SPSS 23.0统计学软件对研究数据进行统计学分析。计量资料以均数±标准差(±s)表示,采用t检验;计数资料以例数(百分比) [n(%)]表示,采用χ2检验。P<0.05为差异具有统计学意义。
2 结 果
2.1 OPN 病例的病原学结果
24例OPN患者的胰周引流液培养结果包括,肺炎克雷伯菌15例、鲍曼不动杆菌14例、屎肠球菌11例、大肠杆菌6例、嗜麦芽窄食单胞菌5例、铜绿假单胞菌4例、阴沟肠杆菌4例、产酸克雷伯杆菌3例、粪肠球菌3例、医院不动杆菌3例、摩根摩根菌2例、洋葱伯克霍尔德菌1例、中间链球菌 1例、弗枸酸杆菌1例、溶血葡萄球菌1例、奇异变形杆菌1例、木糖氧化产碱杆菌1例、产气肠杆菌 1例、白色念珠菌4例、光滑念珠菌3例、热带念珠菌1例、克柔念珠菌1例。其中19例为多重耐药菌感染,包括耐碳青霉烯肺炎克雷伯杆菌(CRE)11例、耐碳青霉烯类鲍曼不动杆菌(CRAB) 10例、耐万古霉素屎肠球菌(VRE)3例;14例合并血流感染,包括CRE血流感染8例;7例合并真菌感染,其中1例真菌血症[23-25]。
2.2 OPN 患者与微创手术患者的治疗情况与临床结局比较
24例OPN患者中,平均ICU住院时间26.9 d,病死率45.8%(11/24),均明显高于微创手术组(P<0.05);术后平均住院时间24.1 d,较微创手术组明显缩短(P<0.05)。而两组间平均发病至手术时间、总外科干预次数、术后主要并发症(包括出血、肠瘘、胰瘘)等无统计学差异(均P>0.05)(表2)。

表2 OPN 组与微创手术组的治疗相关指标与临床结局 比较Table 2 Comparison of the treatment-related variables and the clinical outcomes between patients undergoing OPN and minimally invasive surgery
2.3 OPN患者的主要死因
OPN 患者术后主要死因包括感染性休克5例(45.5%)和失血性休克6例(54.5%)。5例因脓毒症未得到有效控制继发感染性休克死亡,为IPN最常见的死因。6例患者因术后并发腹腔、腹膜后大出血死亡。其中,2例患者为突发腹腔大出血直接死亡。2例经DSA行经导管动脉栓塞术治疗后,突发第二次大出血死亡。2例为腹腔开放采取临时性腹腔关闭患者,因同时合并MODS,无介入手术条件,采取直接手术,术中见胰床及腹膜后广泛渗血而未找到明显动脉出血点,采用外科纱布、止血材料压迫填塞,术后于床旁突发腹腔大出血死亡(表3)。
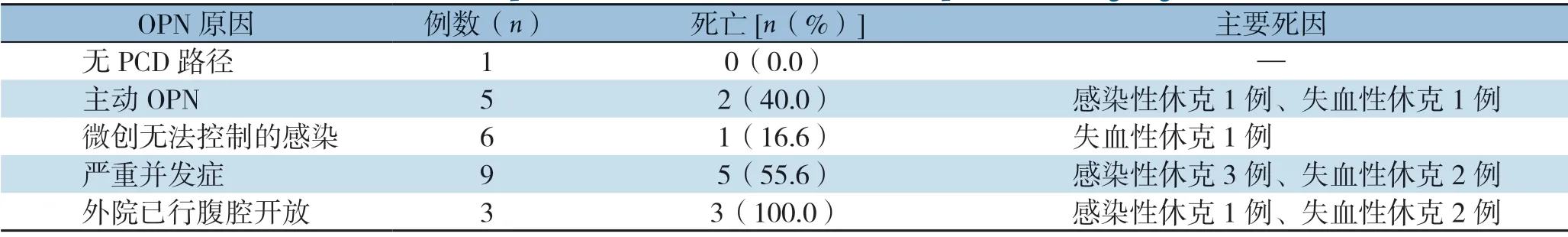
表3 OPN 患者的术后死亡情况与死因Table 3 Postoperative death and causes for death in patients undergoing OPN
3 讨 论
ANP的外科治疗历经百余年的变迁,至今仍然是胰腺外科研究的热点[1,8,14,26]。既往,各类传统的开放胰腺坏死组织清除术一直是治疗ANP的首选术式[13]。但是,随着近年来重症医学的进步、外科治疗理念和治疗手段的更新,微创技术已经成为ANP治疗的重要补充[1,4,7,10,27-28]。2010年 具有里程碑意义的荷兰多中心PANTER随机试验显示,与OPN相比,微创升阶梯治疗模式可显著降低IPN患者病死率和主要并发症发生率的复合终点,减少新发多器官衰竭、切口疝、新发糖尿病的发生率;而PANTER的后续研究亦证实微创“升阶梯”模式组患者具有更优的远期预后[14,29]。因此,目前在大型、专业化的胰腺炎治疗中心,以PCD[4-6]、MARPN[7-9]、超声内镜下胰周积液穿刺引流及胰腺坏死组织清除术[10-12]为代表的各类微创升阶梯技术已经成为治疗ANP的主流手段。可以说,重症胰腺炎治疗的微创时代已经来临。
然而,尽管OPN 所占比例在逐渐下降,但OPN在ANP的治疗中仍然占据着不可替代的地位。在大型、专业化的胰腺炎中心,目前OPN的占比仍约为25%~60%[8,30-31]。诚然,在包括本中心在内的胰腺炎治疗中心,OPN已经不再是ANP外科干预的首选模式。但是,当出现无PCD穿刺路径、虽经积极微创手术仍无法控制的严重感染、合并严重并发症(如大出血或肠瘘等)以及外院已行腹腔开放仍无法控制的感染等情况下,OPN几乎是唯一选择。这些情况下,患者的病情往往极其危重,一旦做出判断,外科医生应当果断决策,毫不犹豫地进行外科干预(OPN),以争取治疗时机,挽救患者生命。本中心140例IPN患者,116例采取微创手术策略,24例采取OPN策略。OPN组术后主要并发症的发生率较微创组无明显增加,而病死率明显高于微创手术组。其原因在于高达80%的OPN患者为通过微创手术无法治愈的危重症患者,病情凶险,病死率极高。本组在恰当的时机采取OPN策略,从一定程度挽救了这类危重症患者生命。
另外,相较于各种微创手术,OPN治疗IPN的优点在于可以迅速控制感染症状、坏死积液清除的效果更快更彻底。郭佐铭等[32]报道了8例腹膜后广泛坏死型胰腺炎患者,因合并MODS恶化、腹腔出血和严重腹膜后感染无法控制而采取OPN策略,手术采用“联合肋缘下、髂腰入路”的方式顺利清除了腹膜后广泛的坏死组织,同时大大降低了并发症发生率和病死率。本中心OPN患者术后中位住院时间为24.1 d,明显短于微创手术组,大大提高了坏死组织的清除效率。因此,对于包裹较为局限的坏死积液病灶,尤其是坏死组织较多、穿刺路径需要经腹腔的,可以施行OPN以求获取更快的效果。
微创时代下,外科医生在施行OPN时应特别把握以下几个突出的特点:(1) 手术时机:目前大多数的指南均推荐延迟手术策略,以求脓腔内液化更完全、坏死组织与存活组织的界限更为清楚,从而减少术后并发症的发生[2-3,20]。延迟手术策略不仅适用于微创手术,同样适用于OPN。本组OPN手术距离起病的平均时间为49.3 d。(2) 手术切口的选择:路径更为精准,目标更为明确。过去经典的开放胰腺坏死组织清除术常常采用上腹部横行大切口或正中切口,力求方便探查整个腹腔和腹膜后区域。但是,目前在CT 等影像学的精准指导之下,手术的目标变得更为明确,坏死积液的范围在术前得以准确的勾勒,因而手术切口的选择也变得更为精准和多样化。切口的选择采取就近原则,只要能路径精准地直达病灶就行。(3) 手术清创的手法更为轻柔,不强求一次性地清除所有坏死组织。手术的目的在于通畅引流和适度清创。残留的坏死组织往往无需再次开腹手术来进行清除,而是可以通过术后MARPN得以有效的清除。正因为有微创手术作为重要的辅助手段,使得OPN手术更为理性,而不是像过去一样往往清创过度而造成致命性的大出血或肠瘘。(4) OPN与微创的结合呈现多元化:不再是单纯的“升阶梯”模式(PCD-MARPN-OPN),而是灵活选用各种组合方式,只要是对患者的治疗有利。正如本文所呈现的,这些组合方式既包括PCDMARPN-OPN这样经典的“升阶梯”策略,也包括OPN-MARPN或OPN-PCD等“降阶梯”策略,还包括PCD-OPN-PCD、PCD-OPN-MARPN等。(5) MDT合作:对于合并严重并发症的重症胰腺炎,单靠某一个学科的力量是很难治愈的。重症胰腺炎的治疗有赖于各个相关的临床学科,尤其是胰腺外科、重症医学科、消化科、影像科、介入科、感染控制科等多个学科的紧密合作。
虽然本组OPN的术后病死率高达45%,但是应该看到,这组患者很多是出现了严重的并发症或者微创治疗无法治愈者,病情往往极为凶险。在这样的危急情况之下,OPN往往是唯一能够挽救患者生命的手段。在微创治疗的新的时代背景之下,合理选择OPN的适应证和手术时机,对于进一步改善重症胰腺炎患者的预后具有极其重要的意义。
