姜黄素对肝癌细胞miR-29 及VEGF 表达的干预作用
2020-10-28陈彩萍赵海菲
陈彩萍 徐 琦 赵海菲
原发性肝细胞癌(hepatocellular carcinoma,HCC)发病率仅次于胃癌和食管癌,肝癌早期诊断率极低,浸润转移是HCC 术后高复发率的主要原因。浸润转移机制的研究对于提高肝癌早期诊断及其生存率具有重要意义[1-3]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是肿瘤新生血管生长重要调控因素,文献报道,VEGF 在肝癌组织和细胞内呈现异常高表达[4-6]。本研究观察姜黄素对肝癌细胞miR-29 及VEGF 表达的干预作用,报道如下。
1 材料与方法
1.1 临床资料 收集2008 年12 月1 日—2018 年12 月1 日期间就诊于杭州市肿瘤医院临床资料较完整的手术切除肝癌标本41 份,含癌组织和癌旁非癌组织,其中病理组织学分级Ⅰ级5 例,Ⅱ级14 例,Ⅲ级17 例,Ⅳ级5 例(由病理科医师根据Edmondson标准[7]分级,Ⅰ~Ⅱ级为高分化,Ⅲ~Ⅳ级为低分化)。同时取10 份患者正常肝组织活检作为对照。41 例肝癌患者中男34 例,女7 例,中位年龄50.1(23~71)岁,所有患者术前均未接受任何抗肿瘤治疗。所有参与本研究者均签署知情同意书,本研究经医院医学伦理委员会审核通过(伦理批号:20170122)。
1.2 细胞株 LO2 人正常肝细胞(ZQ0031)、HepG2人肝癌细胞株购自于上海生化细胞所(H019)。
1.3 药 品 姜黄素购自上海试剂二厂重庆站(分析纯,批号71012660)。姜黄素溶液配制:姜黄素溶液以少量二甲亚砜(DMSO)溶解姜黄素粉剂,配成1mmol/L 溶液(储蓄液),置于-20℃冰箱保存,实验时用倍比稀释配成最终浓度为7.46、14.92、29.84、59.68、119.36μmol/L 五种浓度,将肝癌HepG2 细胞制成5×104/mL 悬液,种植于96 孔培养板内,每孔200μL。实验设试剂对照组(每孔加DMSO 20μL)、肿瘤细胞阴性对照组及五种不同浓度的实验组(每孔加姜黄素20μL),每组平行孔位8 孔,置于37℃、5%CO2培养箱中分别培养24、48、72h 后吸取上清液,加入无血清培养液200μL,MTT 检测细胞增殖情况。
1.4 试剂及仪器 胎牛血清(美国Gibco 公司,批号16000-044),转录试剂盒(MBI Fermantas 公司,批号DP441),RMPI1640(美国HyClone 公司,批号AH 30809.01),TRLzolRNA 抽提试剂盒(TOYOBO 公司,批号410800),实时定量SYBR Green PCR Master Mixture 试剂盒(TianGen 公司,批号FP202-01),逆转录试剂盒(QIANGEN 公司,批号34-405)、鼠抗人单克隆VEGF 一抗(福州迈新公司),生物素标记的第二抗体、SP 试剂盒、DAB 显色剂均购自福州迈新公司;PCR 引物序列(上海吉玛基因):Has-miR-29上游引物:5'-UAGCACCAGCUGUGAAAUCGGUUA-3',下游引物为:5'-CTCAACTGGTCGTGGA-3';U6 上游引物:5'-CTCGCTTCGGCAGCACA-3';U6 下游引物:5'-AACGCTTCACGAATTTGCGT-3';PCR 仪(美国Agilent 公司,型号:ProFlex),高速离心机(美国Thermo Scientific,型号:CL10),核酸定量检测仪(美国Eppendorf 公司,型号:BioPhotometer D30)。
1.5 免疫组化检查 将上述组织标本切片脱蜡脱水后,加入3%双氧水中灭活内源性过氧化物酶,滴加0.01M(pH=6.0)柠檬酸盐缓冲液于微波盒中,微波加热至100℃进行抗原修复,分别滴加一抗(1:50)后以PBS 作为一抗阴性对照,室温孵育60min,然后0.01M PBS 液冲洗5min,重复3 次。滴加生物素标记的二抗后苏木素复染1min,蒸馏水冲洗3min,重复2次,切片经梯度酒精水干燥,纯二甲苯透明,中性树胶封固观测结果。结果判定:VEGF 蛋白阳性信号呈细胞浆或胞膜棕黄色着色,观察5 个具有代表性的高倍视野,计数阳性细胞数与总细胞数比值,其中,+为10%~25%阳性细胞;++为阳性细胞在26%~50%;+++为阳性细胞>50%,阳性细胞数<10%为阴性,阳性细胞数≥10%为阳性[8]。原发性肝癌的分期按国际恶性肿瘤联盟(UICG)TNM 分类标准[7],肿瘤直径≤3cm 为小肝癌,>3cm 者为大肝癌。将有癌栓和/或肝内播散和/或0.5a 内复发的HCC 患者定为低转移复发组。
1.6 细胞培养 LO2 人正常肝细胞、HepG2 人肝癌细胞株均使用含20%胎牛血清的1640 培养基培养,在37℃、5%CO2培养箱中培养48h,镜下观察,细胞生长汇合度接近80%~90%时,使用0.25%的胰蛋白酶消化,进行传代。
1.7 组织标本和细胞总RNA 抽提及RT-PCR 检测在组织或细胞内加入适量TrizoL 后,高速研磨,4℃离心,加入异丙醇后弃上清,加入1mL 75%乙醇涡旋混匀,室温干燥5~10min 后,加入10μL DEPC水溶解,分光光度仪测定RNA 浓度及OD 值,后续参照逆转录试剂盒说明书进行反转录,以U6 作内参基因/核基因,将DNA 样品用DEPC 水稀释至50ng/μL,建立25μL 反应体系见表1。

表1 25 μL 反应体系成分及体积
RT-PCR 循环参数:预变性95℃10min;变性95℃15s,复性60℃1min,延伸72℃1min,共40 个循环;最后72℃延伸10min。每组设定6 个复孔。扩增结束后软件分析计算DNA 相对表达量,使用7500 RT-PCR System 的分析软件,将对照组细胞ND1/U6的比值设定为1,利用Comparative CT 方法计算目标基因相对拷贝数。
1.8 蛋白免疫印迹 细胞经过处理后加入蛋白裂解液裂解蛋白,BCA 法测定蛋白浓度,调整蛋白浓度为1μg/μL,加入溴酚蓝后于100℃金属浴煮10min 使蛋白变性。吸取20μg 蛋白进行SDS-PAGE 蛋白凝胶电泳,经过转膜、5%牛奶封闭后,于4℃过夜孵育对应一抗,次日洗去一抗后室温孵育化学二抗1h,洗去二抗后使用化学发光扫膜仪进行成像分析。
1.9 MTT 细胞增殖实验 细胞经过转染siRNA 24h 后,利用胰酶消化离心,利用完全培养基重悬细胞至5×104/mL。将细胞以1 万/孔铺板于96 孔板中,分别于0、48h 加入10μL MTT。MTT 加入2h 后利用酶标仪检测培养基吸光度值,计算其相对吸光度值。
1.10 细胞迁移检测 细胞转染siRNA 24h 后,利用胰酶消化离心,利用无血清培养基重悬细胞至5×105/mL。取100μL/孔加入到transwell 上室中,下室加入600μL 培养基,于37℃培养箱中培养细胞24h,24h 后取出细胞利用4%多聚甲醛固定,擦去上室未迁移的细胞后,利用结晶紫染色,在光学显微镜下拍照,计算迁移细胞数。
2 结果
2.1 肝癌组织VEGF 表达 免疫组化结果显示,41份肝癌组织标本中,VEGF 表达阳性29 份,阳性率70.73%(29/41),主要表现为细胞浆或细胞膜棕褐色着色,41 份癌旁组织中染色VEGF 表达阳性3 份,阳性率30.00%(3/10),正常肝组织均未见VEGF 阳性表达。肝癌组织VEGF 表达阳性率显著高于癌旁肝组织和正常肝组织,差异有统计学意义(P 均<0.01);肝癌组织VEGF 表达与肿瘤分化程度有关,病理分级Ⅲ~Ⅳ级明显高于Ⅰ~Ⅱ级(P<0.05);还与肝癌侵袭转移性有关,高侵袭转移明显高于低侵袭转移(P<0.05);与血清AFP 水平及HBV 无关(P>0.05)。见表2。
2.2 VEGF 对肝癌细胞HepG2 生物学过程的影响在HepG2 细胞内分别转染VEGF siRNA 或其阴性对照物,MTT 检测其对细胞增殖的调控作用。结果显示,转染VEGF siRNA 抑制VEGF 表达后,细胞增殖受到明显抑制,差异有统计学意义(P<0.05)(见表3)。进一步采用Western blot 检测细胞关键蛋白表达改变情况,结果显示,抑制VEGF 表达后,细胞抗凋亡蛋白Bcl-2 表达显著下调,细胞凋亡蛋白Bax 表达显著上调,差异有统计学意义(P<0.05);Transwell迁移试验结果显示,与阴性对照组比较,抑制VEGF的表达后,HepG2 细胞迁移能力明显降低,差异有统计学意义(P<0.05),见图1。

表2 VEGF 蛋白表达与肝癌临床病理学特征的关系
表3 转染VEGF siRNA 后对细胞增殖的影响(%,)
注:VEGF siRNA(-)为VEGF siRNA 阴性对照物;VEGF siRNA(+)为VEGF siRNA;与本组0h 比较,aP<0.05;与VEGF siRNA(-)48h 比较,bP<0.05
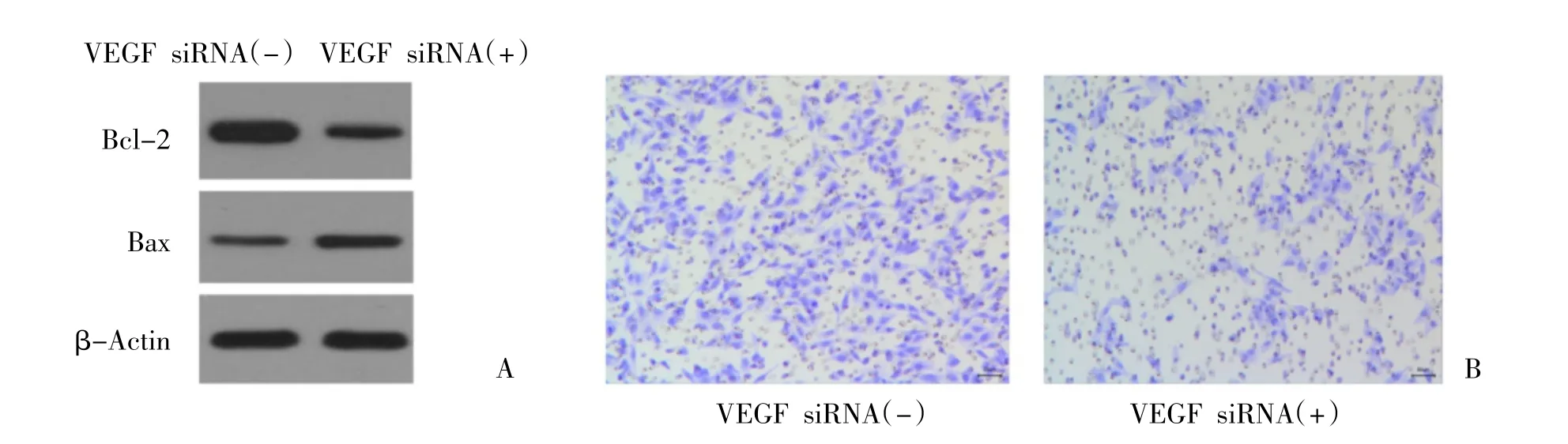
图1 VEGF 对肝癌细胞HepG2 生物学过程的影响(结晶紫染色100×)
2.3 肝癌细胞株miR-29 表达及与VEGF 的关系qRT-PCR 检测结果显示,LO2 正常人肝细胞系miR-29 表达较高,HepG2 人肝癌细胞miR-29 表达异常降低(P<0.05)(见表4);转染miR-29 mimics 促进miR-29 表达后,VEGF mRNA 水平和蛋白质水平均显著降低(P<0.05)(见表5、图2)。

图2 miR-29 在肝癌细胞株表达及与VEGF 的关系
表4 LO2 细胞和HepG2 细胞miR-29 表达比较()

表4 LO2 细胞和HepG2 细胞miR-29 表达比较()
注:miR-29 为微小RNA-29;与正常人肝癌细胞LO2 比较,aP<0.05
2.4 姜黄素对肝癌细胞抑制效应 MTT 检测结果显示,随着药物浓度增加,作用时间延长,姜黄素对HepG2 细胞的抑制率也明显增加,72h 抑制率最好,方差分析结果显示,五种浓度姜黄素对细胞抑制率有显著差异性(F=73.213,P<0.05),当姜黄素浓度为59.68μmol/L 时(接近中效浓度),72h 抑制率达54.93%。根据中效方程式计算出72h 的中效浓度IC50 为49.50μmol/L。见表6。
表5 转染miR-29 后对VEGF mRNA 的影响()

表5 转染miR-29 后对VEGF mRNA 的影响()
注:miR-29 为微小RNA-29;VEGF 为血管内皮生长因子;miR-29 mimics(-)为miR-29 mimics 阴性对照;mimics 为模拟物;与转染miR-29 mimics(-)组比较,aP<0.05
表6 不同浓度姜黄素对HepG2 细胞抑制率比较(%,)
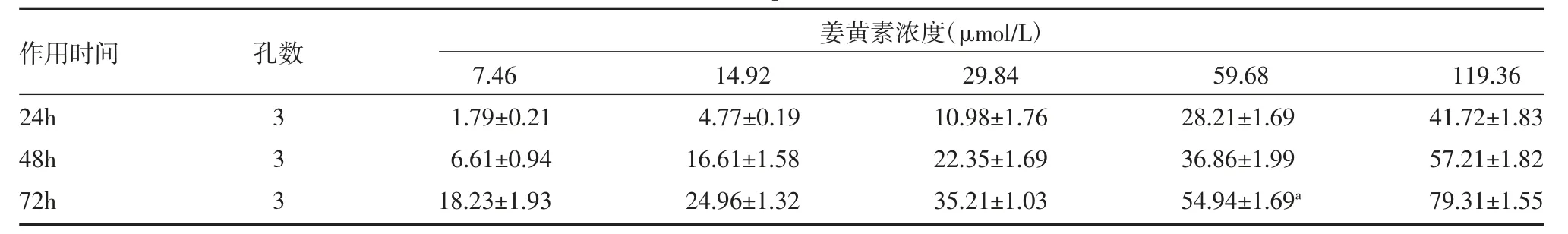
表6 不同浓度姜黄素对HepG2 细胞抑制率比较(%,)
注:与24、48h 比较,aP<0.05
2.5 姜黄素对肝癌HepG2 细胞miR-29 及VEGF mRNA 表达的影响 在肝癌HepG2 细胞内添加姜黄素59.68umol/L 作用72h 后,检测细胞内miR-29 和VEGF 表达情况,与试剂对照组比较,姜黄素组miR-29 表达显著升高,VEGF mRNA 表达下降,差异有统计学意义(P 均<0.05),见表7、图3。
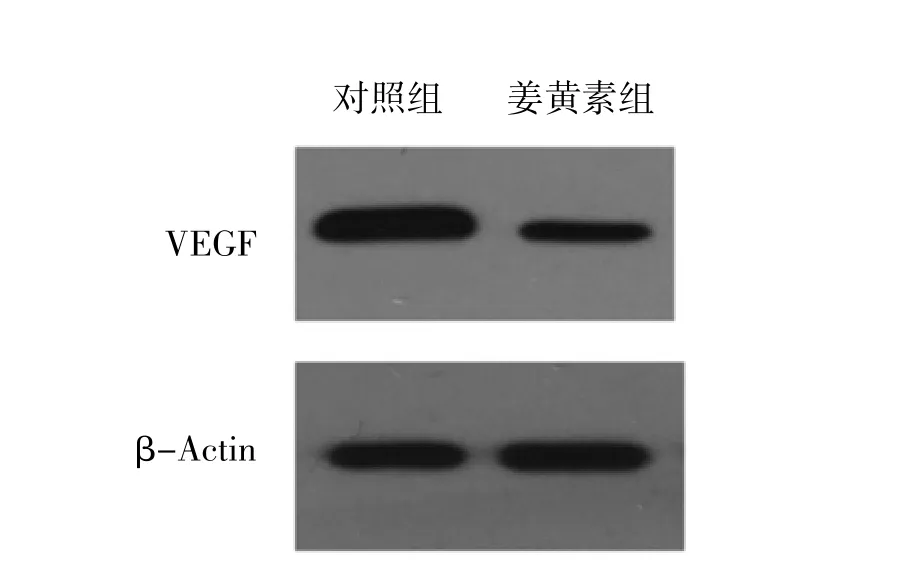
图3 姜黄素对肝癌HepG2 细胞VEGF mRNA 表达的影响
表7 姜黄素对肝癌HepG2 细胞miR-29及VEGF mRNA 表达的影响()

表7 姜黄素对肝癌HepG2 细胞miR-29及VEGF mRNA 表达的影响()
注:miR-29 为微小RNA-29;VEGF 为血管内皮生长因子;与试剂对照组比较,aP<0.05
3 讨论
原发性肝细胞癌(HCC)具有发展快、转移早、预后极差等特点,临床难点主要在于早期诊断率低,术前难以确定有无微小转移等。VEGF 是肿瘤新生血管生成的重要调控因素之一[9-11]。研究显示,肝癌细胞内VEGF 异常表达对于肝癌的发生发展可能存在重要意义,但具体机制仍有待进一步研究[12-14]。
本研究结果显示,与癌旁组织比较,肝癌组织VEGF 阳性率显著增加。进一步研究VEGF 异常表达对肝癌细胞生物学过程的影响,VEGF 异常高表达可以促进肝癌细胞增殖和迁移,抑制细胞凋亡;转染siRNA 抑制VEGF 表达后,细胞增殖降低,迁移减少,凋亡增加。提示异常高表达的VEGF 对肝癌细胞生物学影响显著,而逆转VEGF 表达可能直接影响肝癌细胞生物学过程。
MicroRNAs(miRNAs)是一类小的、进化高度保守的、内源性非编码RNA 分子,可通过转录后调节调控多种基因表达。随着表观遗传学研究的深入,发现其在许多重要的生物学过程包括细胞周期、分化、发育和新陈代谢方面发挥着重要作用[15-17]。文献报道,miR-29 与VEGF 可能存在上下游关系[18-20],提示在肝癌细胞内,VEGF 异常表达可能与miR-29 密切相关。本研究发现,肝癌细胞VEGF 异常高表达,miR-29 表达显著低于正常肝细胞;转染miR-29mimics 促进miR-29 表达后,VEGF 表达显著降低,提示肝癌HepG2 细胞,VEGF 异常表达与miR-29 相关联,miR-29 可能发挥VEGF siRNA 的作用,调控其表达,进而影响细胞生物学过程。miR-29 可能作为逆转肝细胞异常生物学过程的潜在靶基因。
姜黄素(curcumin)是姜黄的主要活性成分之一。多项研究表明,姜黄素抗癌谱广,毒副作用小,是一种具有广泛应用前景的抗癌新药[21-23]。本研究结果显示,当姜黄素浓度为59.68μmol/L 时(接近中效浓度),对肝癌细胞72h 抑制率达54.93%,IC50 为49.50μmol/L。进一步研究发现,肝癌细胞与姜黄素共同培养时,肝癌细胞miR-29 表达显著升高,同时VEGF 表达下降,提示姜黄素可在某种程度上促进肝癌细胞miR-29 表达,进而抑制VEGF 表达,调控肝癌细胞生物学过程。
综上所述,姜黄素可显著促进肝癌HepG2 细胞miR-29 表达,上调VEGF 表达,影响肝癌细胞生物学过程。但是VEGF 调控肝癌细胞的具体机制还需进一步研究。
