林麝肠源和圈舍土源大肠埃希菌的分离鉴定及其耐药基因的检测
2020-10-28李怡瑾田思璐周剑婧曹宇恒程建国
李怡瑾,邱 宇,田思璐,周剑婧,曹宇恒,赵 位,喻 东,杨 威,罗 燕,程建国
(1.四川农业大学 动物医学院,成都 611130;2.四川养麝研究所,四川都江堰 611800)
自1929年青霉素问世,抗生素作为人类对抗感染性疾病的武器而被广泛使用[1]。抗生素这一伟大的发现和应用,使大多数细菌感染性疾病能够被治愈[2]。但随着人们对抗生素的过度依赖,出现了广泛应用甚至滥用抗生素的情况,使得细菌对抗生素的耐药性日益严重[3-4]。林麝(Moschusberezovskii)是名贵中药材麝香的原动物之一[5]。麝香是传统四大名贵药材之一,因其特殊药理和作用及显著疗效被列入国家专控商品[6]。在饲养条件下,化脓感染和肠道疾病是困扰林麝养殖的主要疾病[7],大肠埃希菌病虽不及其他传染病那样来势凶猛。但幼麝感染后死亡率高,在临床上很难治愈[8]。
据报道可知,可移动并传递的遗传载体(如质粒或接合转座子)是大多数耐药基因的存在形式,这些基因可经转化转移表达并稳定传代[9],并在不同菌株甚至不同种属细菌间相互传递[10-11],形成耐药基因的可传播性。在林麝大肠埃希菌耐药性的研究中,大多研究肺源大肠埃希菌耐药表型及其耐药基因型[12-13],对肠源大肠埃希菌研究较少,关于肠源大肠埃希菌与环境中大肠埃希菌耐药性及耐药基因比较鲜有报道。本研究对林麝肠源和圈舍土源大肠埃希菌进行分离鉴定,同时对鉴定出的71株大肠埃希菌进行药敏试验,根据药敏试验结果设计出12对引物,并对其进行耐药性和耐药基因的检测。以期得到二者之间的联系,探究耐药基因是否有可能在两者之间相互转移,从而为林麝养殖过程中大肠杆菌病的防治、用药以及控制大肠杆菌耐药性提供科学依据。
1 材料与方法
1.1 主要试剂
Luria-Bertani(LB)培养基、麦康凯培养基、Mueller-Hinton(MH)培养基、Eosin-Methylene Blue(EMB)培养基、Tryptic Soy Agar(TSA)培养基、细菌微量生化鉴定管以及药敏纸片等均购自杭州微生物试剂有限公司;2×TaqPCR MasterMix Kit、粪便基因组DNA提取试剂盒、细菌基因组DNA提取试剂盒,购自天根生化试剂(北京)有限公司;PCR反应的引物合成以及产物测序,均由杭州有康生物科技有限公司完成。
1.2 粪便和土壤样品采集
采集茂县、都江堰、理县、陕西、泸定、汉源林麝养殖场林麝66份新鲜粪便及养殖场20份土壤样本,送往四川农业大学动物医学院动物检疫试验室进行大肠埃希菌的分离鉴定。
1.3 大肠埃希菌的分离
将采集到的林麝新鲜粪便及养殖场土壤样本划线接种于EMB和TSA培养基,于37 ℃培养箱16~24 h,根据菌落形态特征以及革兰染色结果,挑取单菌落进一步纯化、保存。
1.4 生化试验
依据《伯杰氏细菌鉴定手册》[12]开展试验,生化鉴定具体操作步骤按照说明书进行。
1.5 16S rRNA基因扩增与测序
采用细菌DNA提取试剂盒提取分离菌基因组DNA,作为PCR反应模板。选用16S rRNA基因通用引物27F和1492R进行PCR扩增。反应体系:2×TaqPCR MasterMix 25 μL,27F和1492R引物(10 mmol/L)各2 μL,DNA模板 1 μL,加ddH2O补足50 μL。PCR反应条件:94 ℃预变性5 min;94 ℃变性1 min,55 ℃退火 1 min,72 ℃延伸1 min,30个循环;72 ℃恢复延伸5 min,4 ℃保存。PCR产物电泳后进行测序,并将测序结果进行在线比对分析。
1.6 药敏试验
取保存菌株,接种于LB培养基中,37 ℃下180 r/min震荡培养18~24 h。用0.5麦氏比浊管与LB培养基内的菌液进行对比,将其浓度调至1.5×108CFU/mL。在整个MH培养基表面均匀涂布菌液。采用Kirby-Barer纸片法[14],将12种标准药敏纸片贴在培养基上培养,观察并测量抑菌圈直径大小,重复3次并记录。结果判定参照CLSI鉴定手册(2017版)[15]进行。
1.7 大肠埃希菌耐药基因的检测
分别提取各分离株DNA作为模板进行耐药基因 PCR检测。引物序列及片段长度见表1。将阳性扩增产物进行序列测定,将结果与 GenBank上已发表的16S rRNA基因序列进行对比。

表1 12种耐药基因的PCR引物序列
2 结果与分析
2.1 大肠埃希菌的分离鉴定结果
2.1.1 大肠埃希菌的分离及生化鉴定 从采集的林麝新鲜粪便样品66份,土壤样品20份中分离出林麝肠源大肠埃希菌59株,圈舍土源大肠埃希菌12株。菌株在EMB培养基上呈现有特殊的绿色金属光泽;在TSA培养基上为无色透明大菌落;革兰染色阴性。
经生化鉴定发酵葡萄糖、乳糖、蔗糖、麦芽糖和甘露醇产酸产气,靛基质试验、M.R.试验均为阳性;V-P试验、枸橼酸盐利用试验均为阴性,符合大肠埃希菌的生化特征。
2.1.2 大肠埃希菌的16S rRNA PCR测序鉴定 分离的菌株经PCR扩增后均能见到一条大小约1 600 kp的条带(图1)。将测序结果与GenBank上已发表的16S rRNA基因序列进行对比,与MK506924.1序列的一致性达100%,鉴定结果表明71株菌均为大肠埃希菌。

M.DL 2000 相对分子质量标准;1.阴性对照;2~6.大肠埃希菌16S rRNA扩增产物
2.2 不同来源大肠埃希菌的药敏检测结果
2.2.1 林麝肠源大肠埃希菌和土源大肠埃希菌药敏检测结果 对于林麝肠源大肠埃希菌,仅有亚胺培南1种药物对59例菌株高敏感度达 100.00%,占总药物的8.33%;其次是氧氟沙星、氨曲南、诺氟沙星、头孢他啶、多粘菌素,高敏感度均高于90.00%,占总药物的41.67%;庆大霉素、氯霉素、头孢唑林,高敏感度高于80.00%,占总药物的25.00%;四环素高敏感度为76.27%,链霉素高敏感度为61.02%。但氨苄西林的耐药率为81.36%。
对于圈舍土源大肠埃希菌,仅有亚胺培南1种药物对12种菌株高敏度达100.00%,占总药物的8.33%;其次是头孢他啶、头孢唑林、诺氟沙星、氧氟沙星、多粘菌素、氯霉素,高敏感度均为91.67%,占总药物的50.00%;庆大霉素、氨曲南2种药物,高敏感度为83.33%,占总药物的 16.67%;链霉素、四环素2种药物,高敏感度为 66.67%。但氨苄西林的耐药率为91.67%。不同来源大肠埃希菌的药敏检测结果见表2。

表2 肠源和土源大肠埃希菌分离菌株药敏试验结果
2.2.2 不同林麝场大肠埃希菌耐药检测结果 在检测的6个林麝场中,可见林麝肠源大肠埃希菌耐药的林麝场数明显多于圈舍土壤环境,同一类药物在不同地区对于林麝不同来源大肠埃希菌耐药性的表现基本一致(表3)。在检测的12种药物当中,可见不同林麝场中林麝肠源大肠埃希菌对药物的耐药性由高到低为氨苄西林、链霉素、四环素和氯霉素。
表3 不同林麝场大肠埃希菌菌株药敏试验结果
2.3 不同来源大肠埃希菌耐药基因的检测结果
2.3.1 耐药基因PCR扩增产物的电泳结果 以提取的71株大肠埃希菌基因组DNA为模板,分别对12种耐药基因进行PCR扩增。最终得到的核苷酸片段大小有9种,与预期结果相符。电泳图如图2~图10。
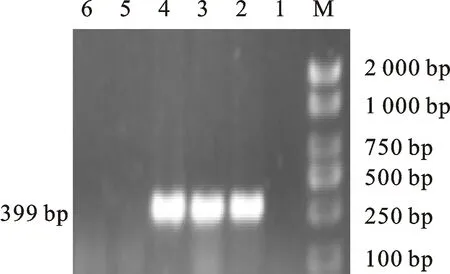
M.DL 2000 marker;1.阴性对照;2~4.携带floR基因的分离株
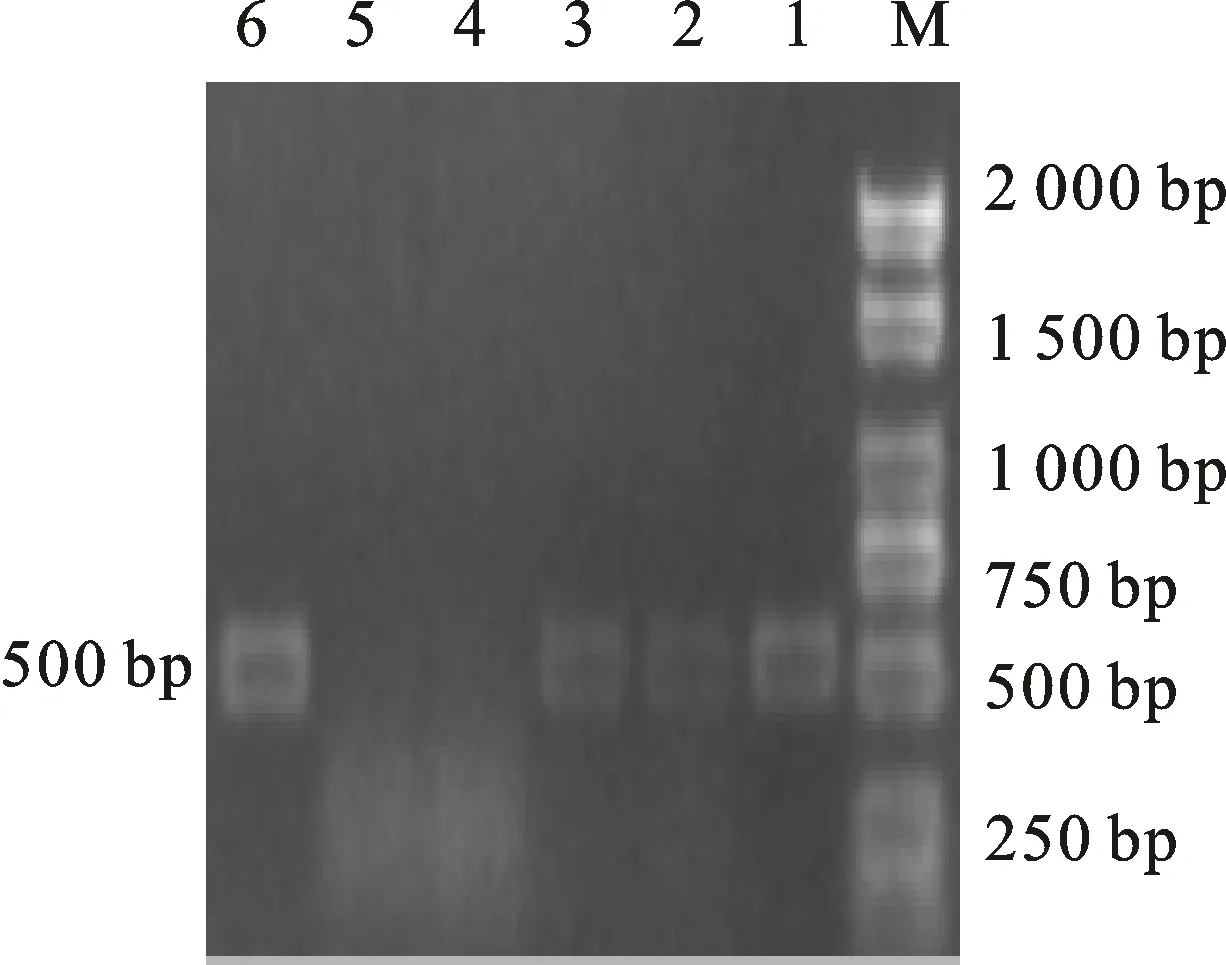
M.DL 2000 marker;1~3,6.携带blaCTX-M基因的分离株;4~5.阴性对照
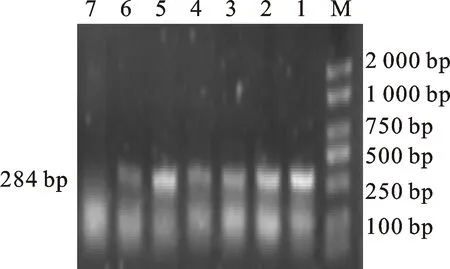
M.DL 2000 marker;7.阴性对照;1~6.携带 ant(3)-la基因的分离株

M.DL 2000 marker; 1~8.携带Cat基因的分离株
M.DL 2000 marker;2.携带 tet(C)基因的分离株;1、3、4.阴性对照
M.DL 2000 marker;1~5,7~9.阴性对照;6,10携带 aac(3)-lia基因的分离株
M.DL 2000 marker;1.阴性对照;2~6.携带 aac(6′)-Ib-cr基因的分离株
M.DL 2000 marker;1、2、5.阴性对照;3、4、6.携带tet(B)基因的分离株
M.DL 2000 marker;2、3、5.阴性对照;1、4.携带blaTEM基因的分离株
2.3.2 耐药基因PCR扩增产物测序及分析 将各阳性扩增产物的序列测定结果与GenBank中的相应序列进行比较(表4),发现各扩增产物与相应的耐药基因有很高的同源性(≥99%)。
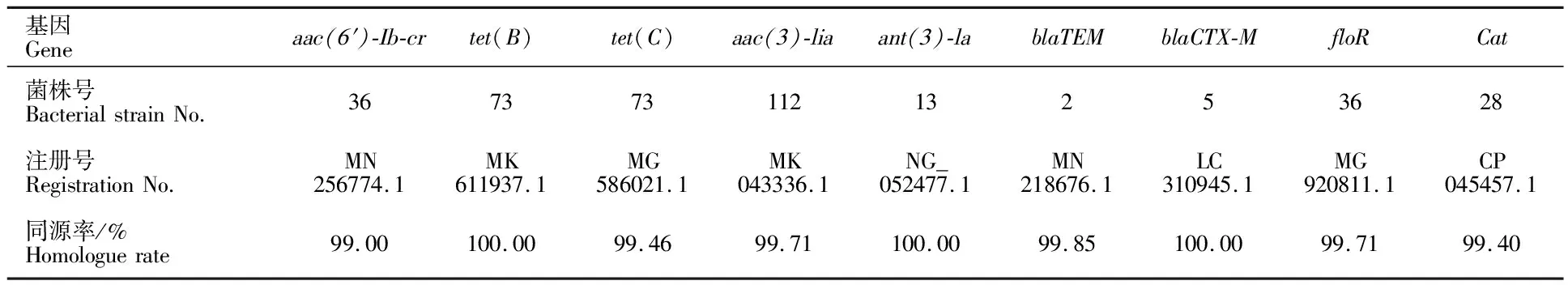
表4 PCR产物与GenBank中耐药基因同源性比较
2.3.3 不同来源大肠埃希菌耐药性表型和基因型的关系 由表5可知,林麝肠源大肠埃希菌中除2株菌(菌株编号为32和46)外,有57株菌至少含有1种耐药基因,占所有菌株的比例为 96.61%,对于林麝肠源大肠埃希菌,大多数氨基糖苷类抗生素、单环内酰胺类抗生素等的耐药性均不同程度低于相应基因的阳性率。而对于圈舍土源大肠埃希菌,氯霉素类检出耐药率为0,但耐药基因阳性率不为0;氨基糖苷类抗生素、氟喹诺酮类抗生素等耐药率高于耐药基因的检出率。
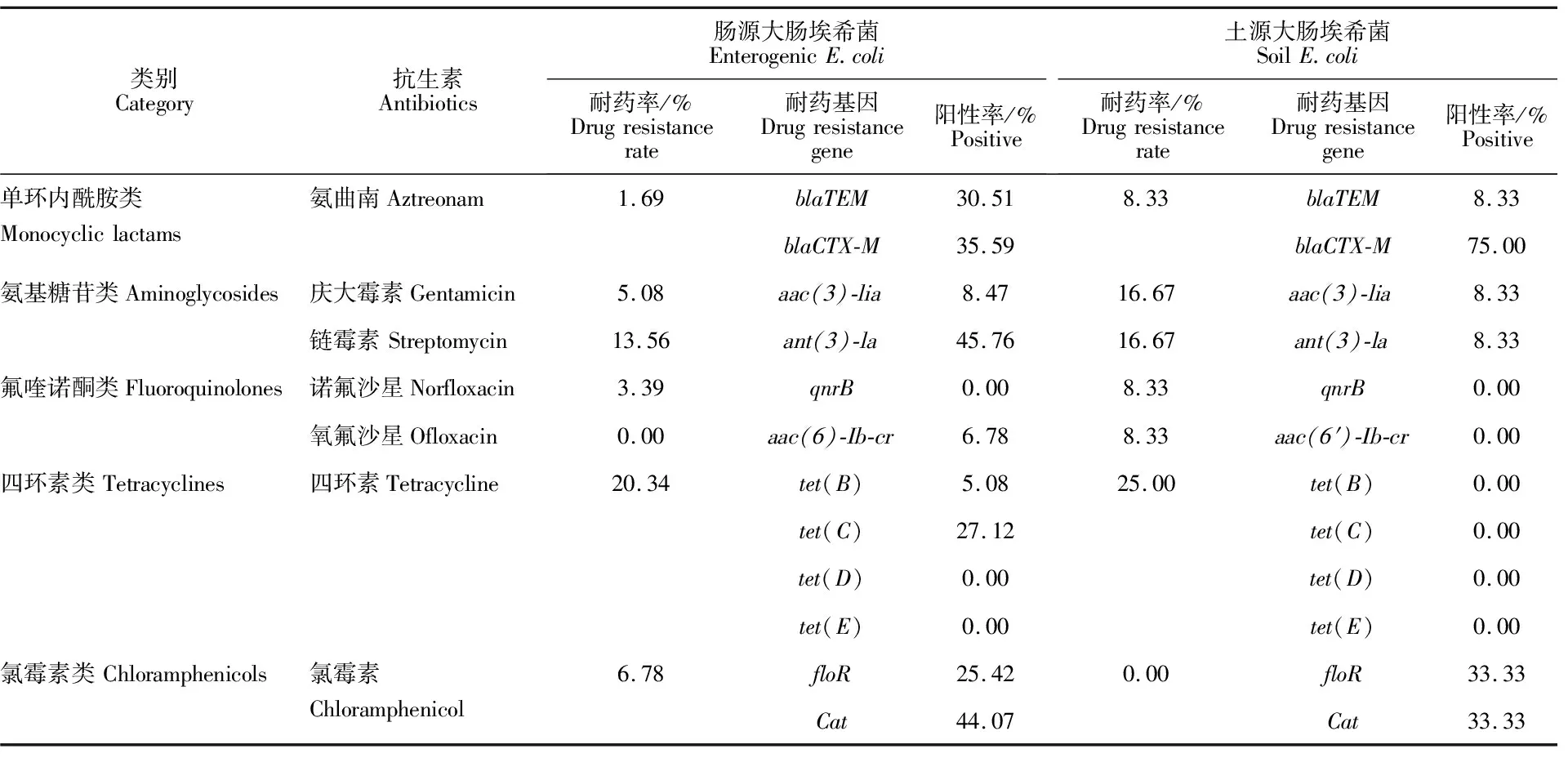
表5 肠源及土源大肠埃希菌耐药性表型和基因型的关系
2.3.4 不同来源大肠埃希菌的多重耐药基因型 由表6可知,在分离出的71株大肠埃希菌中,大多数表现为多重耐药基因携带。肠源性大肠埃希菌中除2株菌(菌株编号32和46)外,有57株菌至少含有一种耐药基因,占所有菌株的比例为96.61%(57/59),而含有两种以上多重耐药基因的菌株比例为72.88%(43/59),大部分菌株含多重耐药基因的数量为2~3种,最多的达到7种(菌株编号112)。同时含有耐药基因ant(3)-la、blaCTX-M、Cat的菌株检出率最高。圈舍土源大肠埃希菌中除1株菌(菌株编号76)外,有11株菌至少含有1种耐药基因,占所有菌株的比例为91.67%(11/12),而含有两种以上多重耐药基因的菌株比例为66.67%(8/12),大部分菌株含多重耐药基因的数量为2种,最多的达到3种(菌株编号65)。同时含有耐药基因blaCTX-M、Cat的菌株检出率最高。
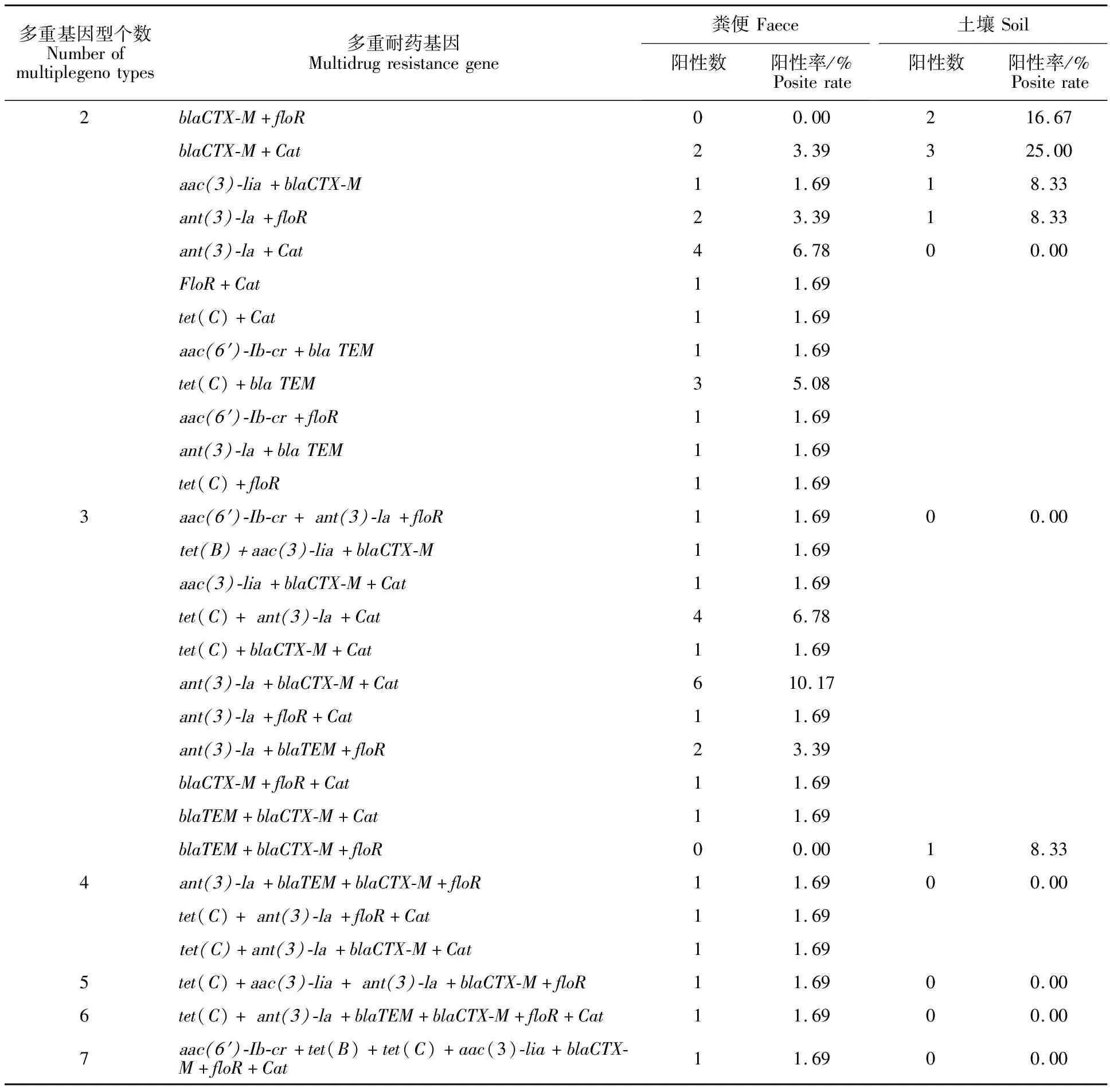
表6 不同来源大肠埃希菌多重耐药基因型统计
3 讨 论
3.1 大肠埃希菌耐药表型及耐药基因分析
从检测的12种耐药基因中,扩增到9种耐药基因。检测结果发现,大肠埃希菌耐药基因的携带情况较为严重。另外,检出率较低的耐药基因有qnrB、tet(D)和tet(E)等,很大可能的原因是各养殖场在选用药物时较少选用喹诺酮类和四环素类药物[25]。
目前,对于大肠埃希菌病的治疗,主要运用的药物即抗菌类药物,包括氨基糖苷类、氟喹诺酮类等[26]。在青霉素类药物中,大肠埃希菌对氨苄西林的耐药性较高[27],与本试验结果相符。也正是由于各类抗菌药物的过度使用甚至滥用,导致大肠埃希菌对于各类药物都产生了不同程度的耐药性[28]。
3.2 耐药表型与耐药基因检测结果的比较
由药敏试验结果,从耐药表型较高的药物种类选取了5类药物的12种耐药基因检测,发现耐药表型和耐药基因的符合率在不同抗生素种类间以及不同来源大肠埃希菌间存在差异。
在林麝肠源大肠埃希菌中,可见四环素、诺氟沙星、链霉素符合率高,分别为63.16%、50.00%、25.81%;庆大霉素、氨曲南符合率较低,为9.68%和2.70%。在圈舍土源大肠埃希菌中,可见庆大霉素和链霉素符合率较高,均为 100.00%,其余药物种类符合率均较低;同时,试验中有检测到细菌耐药,而没有检测到相关耐药基因的情况,在四环素类耐药的大肠埃希菌中,并未检测出耐药基因。这提示除了目前发现的耐药基因之外尚有其他耐药机制的存在,细菌耐药性的存在机制十分复杂[29]。有的细菌虽然检测到耐药基因,但其相关的耐药表型并不表现。这与多种物质对基因在动物体内的表达调控有关[30]。
符合率较低的原因可能与耐药基因存在及其翻译表达的机制[27]有关,或与药物存在的多种耐药机制有关。此外,上述情况存在的原因还可能是细菌存在适应性耐药机制,当细菌长久处于抗菌药物环境时,可产生耐药表型,但本身却不具备该种药物的基因[31]。这些机制主要有:细菌细胞膜的主动外排机制[32];细菌外膜和脂多糖的增厚,使细胞膜流动性降低,增加药物进入细菌的浓度[33];细菌外膜上的转运蛋白结构发生变化[34]等。
3.3 肠源性大肠埃希菌耐药性与圈舍土壤环境大肠埃希菌的关系
对于耐药基因而言,林麝肠源大肠埃希菌与土源大肠埃希菌差异性较大,林麝肠源大肠埃希菌耐药基因检出率普遍多于土源大肠埃希菌。除blaCTX-M、floR外,其余各耐药基因均表现为林麝肠源大肠埃希菌耐药基因检出率大于土源大肠埃希菌。如ant(3)-la林麝肠源大肠埃希菌检出率为45.76%,而土源大肠埃希菌检出率为 8.33%。
但从耐药基因整体结果来看,林麝肠源大肠埃希菌与土源大肠埃希菌又存在一致性,若某种耐药基因在林麝肠源大肠埃希菌中阳性较多,则其在土源大肠埃希菌中的阳性结果相较于其他耐药基因,也是偏多的。如Cat在肠源大肠埃希菌检出率为44.07%,在土源大肠埃希菌检出率为33.33%,它们始终保持着较为一致的变化趋势。另外,从不同地区林麝圈舍的肠源大肠埃希菌和土源大肠埃希菌耐药性分析,其分布特点具有地区特异性,但二者之间亦存在一致性。这从一定程度上表明林麝肠源大肠埃希菌与其生存的周围环境存在着某种相互影响的关系,存在林麝肠源大肠埃希菌的耐药基因与土源大肠埃希菌已有相互转移的可能,凭借其所携带的质粒等遗传载体,除了在菌株与菌株之间,也可能在不同物种、不同动物个体或不同菌种之间相互传递,从而使基因在水平上传递扩散[35]。
