CTRP6在心脏纤维化和内皮向间质转化中的作用研究
2020-10-27向家培雷玉华
向家培 雷玉华
心肌纤维化是心脏在多种刺激因素下的适应性反应[1]。心肌梗死发生后,心肌纤维化过程立即启动,大量死亡的心肌细胞被激活的成纤维细胞替代,胶原瘢痕形成,保证了心脏组织的完整性[2]。心肌梗死早期纤维化瘢痕形成有助于心肌梗死患者渡过危险期,此时若纤维化不足可导致心脏破裂,患者死亡[3]。心肌梗死后期,大量的心肌纤维化会使室壁压力增加,单个心肌细胞所承受的压力增大,室壁僵硬度增加,若此时纤维化持续发生将引起心力衰竭(心衰)[4-5]。在心脏纤维化过程中,除了心脏固有的成纤维细胞发挥作用外,大量其他来源的成纤维细胞也发挥重要作用,其中内皮向间质转化占主导作用。研究阻断纤维化以及内皮向间质转化的药物,对减少心肌梗死后心衰的患病率和病死率有重要意义。
CTRP6是一类与脂联素同源的脂肪因子[6],在心血管疾病中发挥一定作用[7]。研究发现,CTRP6可以保护自发性高血压大鼠的内皮细胞,从而抑制高血压的病理过程[8]。然而CTRP6在心肌纤维化尤其是内皮向间质转化中的作用尚无研究报道。本研究采用人重组CTRP6治疗小鼠心肌梗死后心脏纤维化,以此来探寻治疗心肌纤维化的新方法。
1 材料与方法
1.1 实验动物
将购买于南京医科大学实验室动物中心的雄性C57BL/6J小鼠(8~10周龄,SPF级,体质量24~27 g)采用随机数字表法完全随机分为对照组(n=10)、心肌梗死组(n=20)和治疗组(n=20)。
1.2 心肌梗死模型制备
采用冠状动脉左前降支结扎术建立心肌梗死模型。用3%戊巴比妥钠腹腔注射麻醉小鼠,在胸骨左缘纵行切开皮肤1.5 cm,暴露心脏,在左心耳下缘2~3 mm处用8-0聚丙烯缝线结扎冠状动脉,心电图ST段抬高确定心肌缺血形成。迅速将心脏送回胸腔,缝合胸壁。治疗组在心肌梗死手术后第3天开始给予皮下注射人重组CTRP6(0.2 mg/kg),直至术后第28天。
1.3 超声心动图检测
使用高频率超声系统Vevo 2100(加拿大 VisualSonics 公司)检测小鼠心脏功能。M型短轴二维超声心动图测量左室收缩末期内径(LVESD)、左室舒张末期内径(LVEDD)、左室射血分数(LVEF)、左室短轴缩短率(LVFS)。
1.4 病理染色
小鼠断椎处死,取心脏置于中性福尔马林中固定,脱水石蜡包埋后制作成厚度为3 μm的组织切片,苏木精-伊红(HE)染色后计算心肌梗死面积和细胞横截面积,采用天狼猩红(PSR)染色显示胶原沉积程度。每个心脏选取位置大致相同的心室截面,用ImageJ软件计算心肌梗死面积、细胞横截面积和胶原容积分数。心肌梗死阳性面积百分率=心肌梗死阳性面积/检测视野面积×100%,取各组阳性面积百分率平均值。
1.5 原代小鼠心脏微血管内皮细胞提取
取6~8周小鼠心脏,去除右心室,将心脏剪成1 mm3的小块,采用0.125%的胰酶消化,过滤后取上清,离心细胞悬液,用含10%胎牛血清的DMEM-F12重悬细胞,采用CD31磁珠分选内皮细胞,得到的内皮细胞接种于包埋明胶的培养板中。
1.6 细胞处理
将内皮细胞分为5组:转化生长因子(TGF)-β1刺激组,给予TGF-β1(10 ng/mL,溶于0.1%BSA)处理48 h;治疗组1,TGF-β1处理后的12 h同时给予1 μg/mL CTRP6;治疗组2,TGF-β1处理后的12 h同时给予2 μg/mL CTRP6;治疗组3,TGF-β1处理后的12 h同时给予4 μg/mL CTRP6;对照组,给予等体积的0.1%BSA溶液处理48 h。

1.8 细胞免疫荧光染色
细胞处理后采用4%多聚甲醛进行固定,采用0.02% TritonX-100进行破膜,8%羊血清封闭后,抗CD31抗体和抗平滑肌肌动蛋白α(α-SMA)抗体孵育1 h,采用荧光二抗进行标记,DAPI对细胞核进行染色,荧光显微镜拍照。
1.9 统计学分析
使用SPSS 17.0软件进行统计学分析,计数资料以例数或百分比表示,组间比较采用卡方检验。计量资料数据用均数±标准差表示,正态检验及方差齐性检验后,两组之间的比较用非配对t检验或Mann-Whitney检验,多组之间的比较用单因素方差分析或非参数检验。采用Kaplan-Meier法绘制生存曲线图。P<0.05为差异有统计学意义。
2 结果
2.1 CTRP6降低小鼠心肌梗死死亡率和梗死面积,改善心功能
采用Kaplan-Meier法绘制生存曲线图,可见治疗组小鼠死亡率显著低于心肌梗死组(40%对60%,P<0.05),见图1。病理染色示治疗组小鼠梗死面积明显低于心肌梗死组(P<0.05)。治疗组小鼠心功能明显优于心肌梗死组:LVEF和LVFS明显高于心肌梗死组,LVEDD和LVESD明显低于心肌梗死组(P均<0.05),见表1。

图 1 心肌梗死后28 d两组小鼠的死亡率曲线
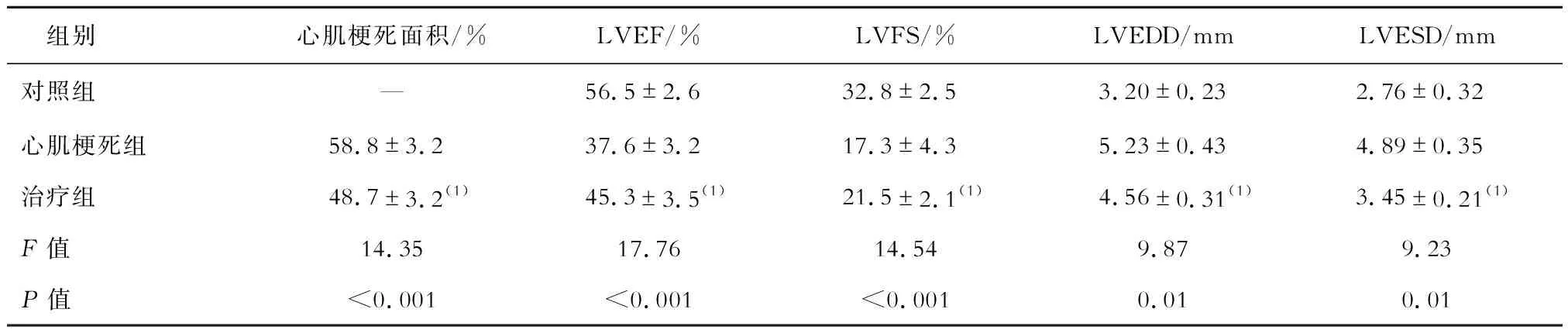
表1 各组小鼠心肌梗死面积和心功能比较
2.2 CTRP6减少心肌纤维化和纤维化相关基因的转录
天狼星红染色提示治疗组小鼠心脏胶原沉积明显低于心肌梗死组(P均<0.05)。实时定量PCR结果显示,治疗组小鼠心脏Ⅰ型胶原、Ⅲ型胶原和TGF-β1的mRNA表达水平低于心肌梗死组(P均<0.05),见表2。

表2 各组小鼠心肌胶原蛋白沉积及心脏纤维化标志物mRNA水平比较
2.3 CTRP6减少内皮向间质转化
CD31和α-SMA免疫荧光双染色结果显示,与对照组相比,心肌梗死组小鼠心脏组织微血管CD31表达减少,而α-SMA表达增多;治疗组小鼠心脏组织微血管CD31表达高于心肌梗死组,而α-SMA表达低于心肌梗死组,见图2。
采用qRT-PCR检测内皮向间质转化标志物snail1、snail2、twist1和twist2的mRNA表达水平,结果显示心肌梗死组小鼠心脏组织snail1、snial2、twist1和twist2的mRNA表达水平均明显高于对照组(P均<0.05);治疗组中小鼠心脏组织snail1、snial2、twist1和twist2的mRNA表达水平均明显低于心肌梗死组(P均<0.05),见表3。
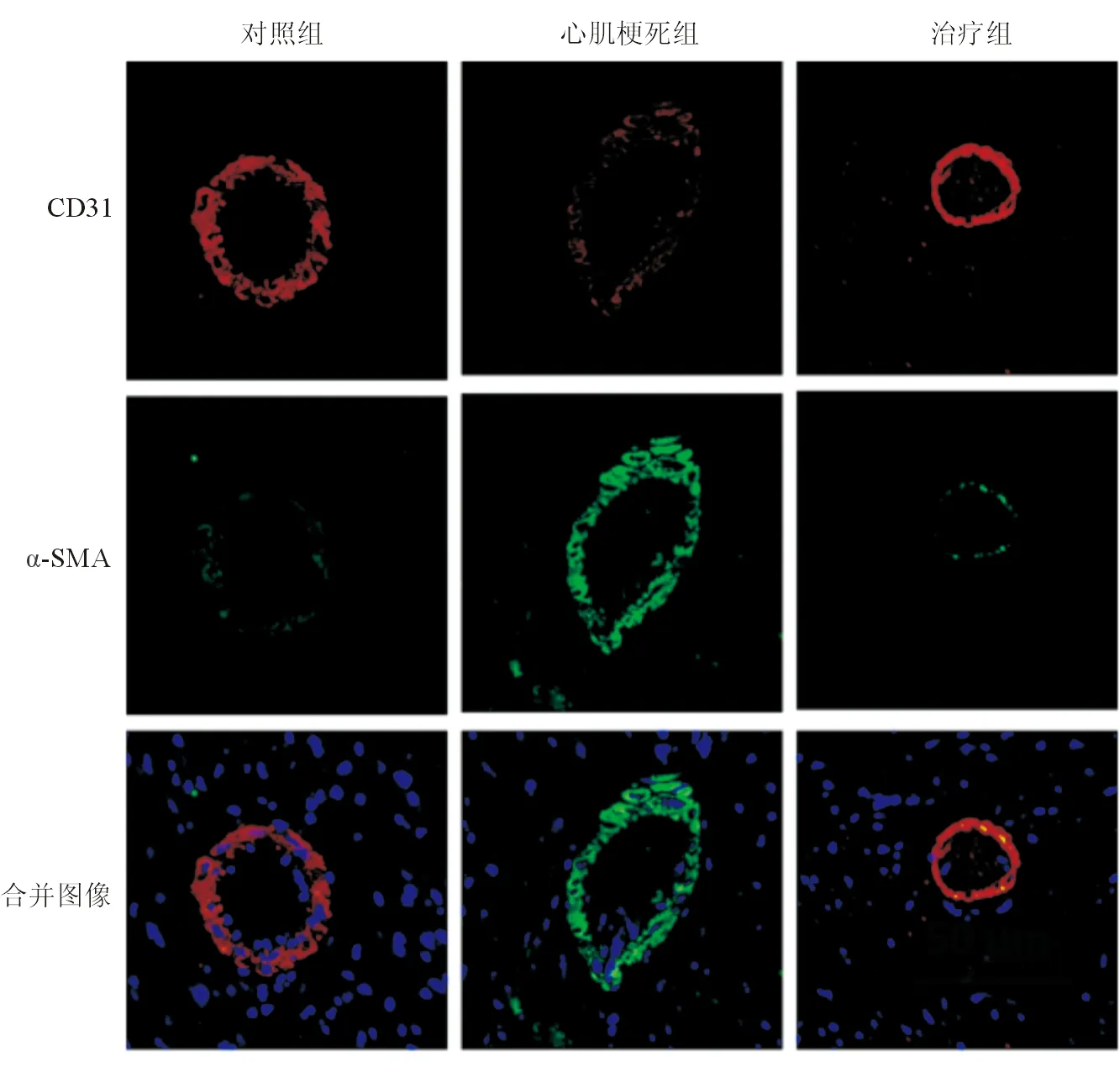
注:红色表示CD31,绿色表示α-SMA,蓝色表示细胞核

表3 各组小鼠心脏组织内皮间质转化标志物mRNA水平比较
2.4 CTRP6对微血管内皮细胞的影响
CD31和α-SMA免疫荧光双染色结果显示,TGF-β1刺激组细胞CD31的表达低于对照组,α-SMA的表达高于对照组。治疗组1、治疗组2和治疗组3细胞CD31的表达均明显高于TGF-β1刺激组,α-SMA的表达均低于TGF-β1刺激组,见图3。
采用RT-PCR检测内皮向间质转化标志物的mRNA表达水平,可见TGF-β1刺激组细胞snail1、snial2、twist1和twist2的mRNA表达水平均明显高于对照组,治疗组1、治疗组2和治疗组3细胞snail1、snial2、twist1和twist2的mRNA表达水平均明显低于TGF-β1刺激组(P均<0.05),见表4。
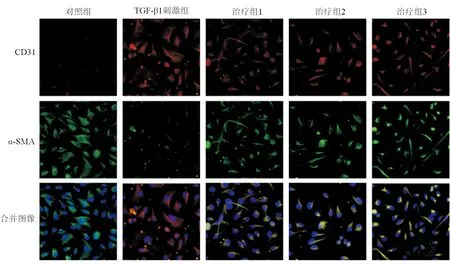
注:红色表示CD31,绿色表示α-SMA,蓝色表示细胞核

表4 各处理组心脏微血管内皮细胞内皮间质转化标志物mRNA水平比较
3 讨论
心衰是多种心血管疾病的终末病理状态,以间质纤维化、心室壁顺应性降低、心室重构为主要特征。急性心肌梗死后存活的患者多会发展为心衰。在心肌梗死发展为心衰的病理过程中,心脏成纤维细胞大量激活,促进细胞外基质沉积,降低心脏组织顺应性,加速心衰的发生[4- 5]。多种细胞参与心肌纤维化的发生发展,包括心脏成纤维细胞、内皮细胞、造血干细胞等,其中内皮细胞向间质细胞转化在心肌纤维化中发挥重要作用[9-10]。多项研究发现抑制内皮间质转化可以抑制心肌纤维化的发展[11-13]。本研究发现,人重组脂肪因子CTRP6能够减小心肌梗死面积,减少心肌梗死后的心肌纤维化水平,从而改善心肌梗死后心功能。我们发现CTRP6通过减少内皮间质转化抑制心肌梗死后心肌纤维的发展,离体实验进一步发现CTRP6直接作用于内皮细胞,抑制TGF-β1诱导的内皮间质转化。
内皮细胞失去内皮标志物(如CD31、CD34),获得间充质或肌纤维母细胞表型,表达间质细胞产物(如α-SMA和Ⅰ型胶原),获得浸润性生长以及迁徙能力,这一过程称为内皮间质转化[14]。内皮间质转化参与多种疾病的发生,如肿瘤的侵袭转移、肿瘤恶变以及心肌纤维化[11]。研究发现在压力负荷诱导的心肌重构中,有27%~33%的成纤维细胞来源于发生内皮间质转化的内皮细胞,这促进了心肌纤维化的发生发展[15]。抑制内皮间质转化可以缓解多种疾病状态下的心肌纤维化和心脏重构[11-13]。Liu等[12]发现柴胡皂甙A通过抑制内皮间质转化减轻压力超负荷诱导的心肌纤维化。Wang等[11]发现微小RNA(miRNA)-222通过抑制内皮间质转化减轻糖尿病心肌病的心肌纤维化。Zhang等[16]发现色素上皮衍生因子通过抑制内皮间质转化减轻急性心肌梗死大鼠心肌纤维化。因此抑制内皮间质转化可能是治疗心血管疾病心肌纤维化的靶点。CTRP6主要来源于脂肪细胞和内皮细胞[6],可以抑制多种刺激因素引起的高血压病理进程[8]。CTRP6缺失可导致小鼠胰岛素抵抗和炎性反应[17]。本研究发现,CTRP6能够减少心肌梗死面积,减轻梗死后的心肌纤维化,改善心功能,而CTRP6是通过减少内皮间质转化发挥抗纤维化作用的。
心肌梗死后,损伤的心肌细胞通过分泌损伤相关分子促进多种炎性因子和促纤维化因子大量释放,其中TGF-β1是最强的致纤维化因子之一[18]。TGF-β1可以直接激活纤维化相关基因的转录,包括Ⅰ型胶原、Ⅲ型胶原、纤维连接蛋白、结缔组织生长因子等,直接参与纤维化过程[18]。此外,TGF-β1可以结合内皮细胞表面的TGF-β1受体,通过Smad和非Smad通路促进内皮间质转化基因snial1、snail1、twist1和twist2 的转录,这些基因可促进内皮细胞高表达间质标志物α-SMA和波形蛋白,同时减少内皮标志物CD31的表达[19]。本研究发现,在心肌梗死后心肌纤维化的过程中,内皮间质转化明显增加;人重组CTRP6可以通过直接作用于内皮细胞,抑制TGF-β1诱导的内皮向间质转化,减少心肌纤维化的发展,这提示CTRP6通过抑制TGF-β1诱导的内皮向间质转化,发挥心脏保护作用。
