黄秋葵发酵酒渣中果胶多糖的提取及理化性质分析
2020-10-23吴光斌周彦强陈发河
吴光斌,周彦强,陈发河
(集美大学食品与生物工程学院,福建厦门 361000)
黄秋葵(Okra,AbelmoschusesculentusL.Moench),也称秋葵、羊角菜、羊角豆,起源于非洲,目前在我国南北方均有种植,资源丰富[1-2]。黄秋葵嫩荚中含有大量的粘性多糖物质,其主要成分包括果胶多糖、阿拉伯聚糖、半乳聚糖及少量糖蛋白[3]。黄秋葵果实的利用方式主要是嫩荚用作烹饪,成熟后的种子留作种用。近年来随着黄秋葵资源利用的不断创新,通过改变利用方式以提高其附加值。已有学者研究了黄秋葵酒的发酵工艺[17-18],亦有企业利用黄秋葵研发出黄秋葵酒,投放市场数年获得消费者广泛认可,但黄秋葵酒发酵过程中产生的大量酒渣尚未得到充分利用。
果胶的分子结构通常有三类:半乳糖醛酸聚糖(Homogalacturonan,HG)、鼠李半乳糖醛酸聚糖I(Rhamnogalacturonan I,RG I)和鼠李半乳糖醛酸聚糖Ⅱ(Rhamngalacturonan Ⅱ,RG Ⅱ)[9],黄秋葵果胶多糖分子除了上述的结构外,部分研究证明其糖链中还包含有其它的结构[10-12]。研究表明,黄秋葵荚果中含有的果胶多糖物质具有抗疲劳[13-14]、增强免疫力[15]、降低血脂[16]等功能。果胶具有的增稠、稳定、凝胶和杀菌止血等特性,被广泛用于食品、纺织、化妆品和制药等领域,黄秋葵果胶的开发利用市场前景广阔。关于黄秋葵果胶的提取工艺已有文献报道[2,19-20],刘晓霞[21]研究了黄秋葵花果胶类多糖的提取工艺及其性质,但利用黄秋葵发酵酒渣制备果胶多糖的工艺技术及果胶多糖性质鲜有报道。
本文以黄秋葵发酵酒渣为研究对象,采用酶法提取黄秋葵发酵酒渣中的果胶多糖,通过单因素实验和响应面法优化提取工艺;采用PMP柱前衍生HPLC法测定黄秋葵酒渣果胶多糖的单糖组分,分析了果胶多糖的部分理化特性,以期为黄秋葵发酵酒渣的综合利用技术开发提供借鉴。
1 材料与方法
1.1 材料与仪器
黄秋葵发酵酒渣 厦门市如意情有限公司提供,将发酵后的酒渣晒干,然后粉碎过40目筛得到黄秋葵发酵酒渣粉,冰箱保存备用;黄秋葵 厦门市如意情有限公司提供,将黄秋葵荚果晒干,然后粉碎过40目筛得到黄秋葵粉,冰箱保存备用;葡萄糖、半乳糖、甘露糖、阿拉伯糖、纤维素酶(均为分析纯) 国药集团;鼠李糖、葡萄糖醛酸(均为色谱纯) 索莱宝公司;半乳糖醛酸(色谱纯) 麦克林公司;1-苯基-3-甲基-5-吡唑啉酮(PMP)(纯度≥99.9%)、乙腈(色谱纯) Sigma公司;纤维素酶(酶活15000 U/g)、半纤维素酶(酶活12000 U/g) 南宁宏博生物工程有限公司;木瓜蛋白酶(酶活50000 U/g) 索莱宝公司;咔唑、无水乙醇、浓硫酸、氢氧化钠、盐酸、磷酸氢二钠、磷酸二氢钠(均为分析纯) 国药集团。
Waters 2695高效液相色谱配Waters 2489紫外检测器 美国Waters公司;高速冷冻离心机 德国Eppendorf;Cary50紫外可见分光光度计 美国Varian;RIOS 8超纯水系统 美国Millipore;PE20K型pH计 瑞士Mettler Toledo;WB-14恒温水浴锅 德国Memmert;LE204E电子天平 瑞士Mettler Toledo;ULT1386-80 ℃超低温冰箱 美国Thermo Fisher;MA35快速水分测定仪 赛多利斯;FD-1D-50冷冻干燥机 北京博医康。
1.2 实验方法
1.2.1 样品的前处理 将黄秋葵发酵酒渣粉和黄秋葵粉,分别用20倍70%的乙醇浸提两次(室温,1 h),然后使用5倍氯仿和甲醇的混合溶剂(1∶1,v/v)提取1 h除去色素等杂质,最后使用丙酮洗涤后60 ℃烘干至恒重,分别得到醇不溶固形物AIS(Alcohol-insoluble solid)备用。
1.2.2 黄秋葵发酵酒渣果胶多糖和黄秋葵果胶多糖的提取 分别称取一定量的上述AIS,按比例加入提取溶剂超纯水和酶,使用盐酸和氢氧化钠溶液调节pH;在一定温度下水浴振荡提取一定时间后,8000 r/min离心10 min收集滤液;滤液于45 ℃下旋蒸浓缩;冷却后加入三倍体积的95%乙醇,4 ℃放置过夜,4000 r/min下离心10 min。最后得到的沉淀分别用75%乙醇和无水乙醇洗涤,复水溶解后在-40 ℃、真空度低于60 Pa条件下冷冻干燥,分别得到黄秋葵发酵酒渣果胶多糖和黄秋葵果胶多糖产品,用于后续的分析测试与比较。
1.2.3 单因素实验
1.2.3.1 酶的类型对黄秋葵发酵酒渣果胶多糖提取率的影响 固定料液比1∶35,提取时间8 h,加酶量1.5%,使用盐酸和NaOH溶液调整pH,分别使用纤维素酶(pH=4.5,温度45 ℃),半纤维素酶(pH=5.0,温度50 ℃)和木瓜蛋白酶(pH=5.0,温度55 ℃)进行提取,平行测定三次取平均值。
1.2.3.2 酶的添加量对黄秋葵发酵酒渣果胶多糖提取率的影响 使用水作为提取溶剂,固定料液比1∶35,提取时间8 h,温度45 ℃,使用盐酸和NaOH溶液调整pH为4.5,分别添加纤维素酶0.5%、1.0%、1.5%、2.0%、2.5%、3.0%、3.5%进行提取,平行测定三次取平均值。
1.2.3.3 料液比对黄秋葵发酵酒渣果胶多糖提取率的影响 使用水作为提取溶剂,提取时间8 h,纤维素酶添加量1.0%,温度45 ℃,使用盐酸和NaOH溶液调整pH为4.5,分别使用料液比1∶15、1∶25、1∶35、1∶45、1∶55、1∶65进行提取,平行测定三次取平均值。
1.2.3.4 pH对黄秋葵发酵酒渣果胶多糖提取率的影响 使用水作为提取溶剂,固定料液比1∶35,提取时间8 h,温度45 ℃,纤维素酶添加量1.0%,选择提取液的pH分别为2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0下进行提取,平行测定三次取平均值。
1.2.3.5 提取时间对黄秋葵发酵酒渣果胶多糖提取率的影响 使用水作为提取溶剂,固定料液比1∶35,提取时间8 h,温度45 ℃,纤维素酶添加量1.0%,使用盐酸和NaOH溶液调整pH为4.5,选择提取时间分别为4、6、8、10、12、14 h下进行提取,平行测定三次取平均值。
1.2.3.6 提取温度对黄秋葵发酵酒渣果胶多糖提取率的影响 使用水作为提取溶剂,固定料液比1∶35,提取时间8 h,纤维素酶添加量1.0%,使用盐酸和NaOH溶液调整pH为4.5,选择提取温度分别为35、37.5、40.0、42.5、45、50、55 ℃下进行提取,平行测定三次取平均值。
1.2.3.7 提取次数对黄秋葵发酵酒渣果胶多糖提取率的影响 使用水作为提取溶剂,固定料液比1∶35,提取时间8 h,温度45 ℃,纤维素酶添加量1.0%,使用盐酸和NaOH溶液调整pH为4.5,选择提取次数分别为1、2、3、4进行提取,平行测定三次取平均值。
1.2.4 响应面优化黄秋葵发酵酒渣果胶多糖的提取工艺 采用响应面法来优化黄秋葵酒渣中果胶多糖的提取工艺。根据单因素实验的结果,以果胶多糖的提取率为响应值,选择提取pH、提取温度、提取料液比这三个对黄秋葵酒渣果胶多糖提取率影响较大的因素,使用Design-Expert 8.0.6,利用Box-Benhnken的设计原理,进行三因素三水平的响应面分析,对黄秋葵酒渣果胶多糖的提取工艺进行优化。响应面设计因素与水平见表1。

表1 Box-Benhnken试验设计因素和水平
1.2.5 黄秋葵发酵酒渣果胶多糖及其理化性质指标的测定
1.2.5.1 水分含量的测定 采用快速水分测定仪测定黄秋葵酒渣果胶多糖的水分含量。
1.2.5.2 pH的测定 参照QB 2484-2000《食品添加剂 果胶》中的方法,用pH计测定黄秋葵酒渣果胶的pH。
1.2.5.3 果胶多糖含量的测定 对复水溶解后的果胶多糖溶液,使用苯酚硫酸比色法[23]测定果胶多糖的含量。标准曲线的制作方法:配制0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08 mg/mL的8个浓度的半乳糖溶液,各取1 mL加入具塞玻璃试管中,再加入1 mL 6%的苯酚溶液,混匀后加入5 mL浓硫酸,沸水浴20 min。使用蒸馏水做对照,测定490 nm的吸光度。
果胶多糖得率(%)=(溶液的体积×多糖浓度)/酒渣的质量×100。
1.2.5.4 半乳糖醛酸含量的测定 采用咔唑硫酸法测定其半乳糖醛酸的含量[23]。
标准曲线的制作:称取咔唑0.150 g定容至100 mL乙醇溶液中,得到1.5 g/L的咔唑溶液。配制10、20、30、40、50、60、70 μg/mL半乳糖醛酸溶液,各取1 mL于试管中,然后各加入浓硫酸6 mL,混合均匀;沸水浴15 min,冷却至室温后加入1.5 g/L咔唑溶液1 mL,混合均匀,室温下避光放置1 h;以超纯水为空白测定526 nm波长下的吸光度(A)。以测得的吸光度(A)为纵坐标,半乳糖醛酸的含量为横坐标,绘制标准曲线,得到标准曲线回归方程为:Y=0.0051X-0.0110(R2=0.9955)。
1.2.5.5 蛋白质含量的测定 采用福林酚法[24-25]略作修改测定果胶多糖中的蛋白质含量。
溶液的配制A液:1 g Na2CO3溶于50 mL 0.1 mol/L NaOH溶液中;B液:0.5 g CuSO4·5H2O溶于100 mL 1%(w/v)的酒石酸钾钠中。甲液:取50 mL A液与1 mL B液混合。乙液:索莱宝福林酚溶液。
标准曲线的制作使用牛血清白蛋白作为标准品。配制浓度为50、100、150、200、250 μg/mL的牛血清白蛋白。取1 mL标准溶液或待测溶液,加入甲液5 mL,振荡均匀后静止10 min;再加入0.5 mL乙液,准确静止30 min。以超纯水为空白测定其650 nm下的吸光度。以吸光度(A)为纵坐标,标准溶液中牛血清白蛋白的浓度为横坐标,制作标准曲线。
样品的测定配制一定浓度的果胶多糖溶液,取1 mL进行测定。其操作方法与标准曲线的制作方法相同。根据样品的吸光度值结合标准曲线即可得出蛋白质含量。
1.2.5.6 酯化度的测定 参照国标GB/25533-2010等方法[26-28]测定,并稍作修改。称取2 g果胶多糖于烧杯中,加入50 mL盐酸-乙醇溶液(浓盐酸:75%乙醇=1∶100,v/v),搅拌10 min;过滤,真空抽吸滤干后用盐酸-乙醇溶液洗涤6次,每次用10 mL,再用乙醇溶液数次冲洗直至滤出物不含氯离子,最后用20 mL无水乙醇冲洗滤干,在105 ℃下干燥2 h,冷却后称重。
称取0.5 g干燥后的果胶样品于250 mL具塞锥形瓶,滴加少量无水乙醇润湿。加入100 mL超纯水振荡至完全溶解。以酚酞为指示剂,用0.1 mol/L氢氧化钠溶液滴定,记录下所消耗的氢氧化钠标准滴定溶液的体积V1。加入20.0 mL 0.5 mol/L氢氧化钠溶液,振摇后静置15 min,加入20.0 mL 0.5 mol/L盐酸标准滴定溶液进行中和,振摇至粉红色消失。最后使用0.1 mol/L氢氧化钠溶液滴定,记录下此步骤所消耗的0.1 mol/L氢氧化钠标准滴定溶液的体积为V2。酯化度按照以下公式(1)计算:
酯化度(%)=V2/(V1+V2)×100
式(1)
1.2.5.7 色差分析 黄秋葵酒渣果胶多糖的色差,使用指标L*、a*、b*和ΔE表示,在Brookfield SC-80C型自动色差仪上进行测定,一式三份,结果取平均值。其中L*代表明度;a*代表红绿色度,a*>0代表红色,a*<0表示绿色;b*代表黄蓝色度,b*>0表示黄色,b*<0表示蓝色;ΔE表示色差。
1.2.5.8 单糖组成的分析 采用1-苯基-3-甲基-5-吡唑啉酮(PMP)柱前衍生化HPLC法测定黄秋葵果胶多糖的单糖组成[29]。采用1-苯基-3-甲基-5-吡唑啉酮为柱前衍生化试剂,结合反相高效液相色谱法,建立同时测定黄秋葵多糖中8 种单糖组分的方法。采用Infinity Lab Poroahell C18色谱柱为固定相,流动相为磷酸盐缓冲液(0.1 mol/L,pH6.85)-乙腈(82∶18,V/V),流速为1.0 mL/min,柱温25 ℃,紫外检测器,波长250 nm。
2 结果与分析
2.1 苯酚硫酸比色测定果胶多糖的标准曲线
使用苯酚硫酸比色测定果胶多糖的含量,实验得到的标准曲线其线性关系良好,R2为0.9989(图1),此方法可用于黄秋葵果胶多糖含量的测定。

图1 苯酚-硫酸法标准曲线
2.2 单因素实验
2.2.1 酶的类型对果胶多糖得率的影响 黄秋葵的细胞壁主要由纤维素、半纤维素、果胶和糖蛋白等物质构成,所以分别考察提取体系中酶的类型对果胶多糖得率的影响,并将不同酶的类型与未加酶的提取结果进行比较,结果如图2所示。
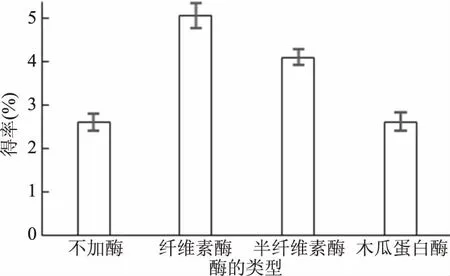
图2 不同类型的酶对果胶多糖得率的影响
由图2可知,纤维素酶和半纤维素酶都显著地提高了果胶多糖得率(P<0.05),木瓜蛋白酶对果胶多糖得率的影响不显著。其中纤维素酶提取果胶多糖的得率最高,为5.05%,是未加酶的1.7倍。这可能是因为果胶多糖常与纤维素和半纤维素通过共价键或者离子键连接在一起,而纤维素酶中的内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶能够有效地破坏细胞壁的纤维素结构,松散的细胞壁可以促进果胶多糖物质的溶出,从而使果胶多糖的提取率显著提高[30]。因此,后续的实验选择纤维素酶作为实验用酶。
2.2.2 纤维素酶的添加量对果胶多糖得率的影响 酶的添加量对果胶多糖得率有一定的影响,由图3可以看出,得率随着加酶量的增大而增大。当加酶量小于1.0%时,果胶多糖得率随着酶添加量的增加而迅速增加;但当加酶量大于1.0%时,果胶多糖得率的增加趋势减缓。可能原因是酶浓度的增大可使酶与底物原料更多的接触,使得纤维素更多的分解,从而释放出来更多的果胶多糖;但加酶量大于1.0%时,在相同的酶解时间内,果胶多糖得率的提高趋势减缓,可能是由于在该底物浓度下,酶浓度已经趋于饱和,细胞内果胶多糖已大部分溶出,继续增加纤维素酶用量还会使其水解产物较大程度地水解为小分子物质,在水溶液中与果胶多糖竞争,最终使果胶多糖溶解变得更慢。同时,过高的酶添加量也会显著增加成本。综合考虑,选择1.0%为该酶的最佳添加量。

图3 不同的酶添加量对果胶多糖得率的影响
2.2.3 料液比对果胶多糖得率的影响 由图4可知,随着料液比增大,当料液增加为1∶35时,达到最大值5.13%,料液比继续再增大时,果胶多糖得率略有下降。在较低的料液比时,酶浓度较大,虽然酶分子与底物可充分接触,但因其果胶多糖浓度过高,固液相的浓度差过小,果胶多糖受该温度下溶解度的限制,其提取率并不高[31]。而料液比较大时,酶浓度较低,短时间内果胶多糖不能被充分提取;料液比过大不但增加了溶剂的使用,而且增加了后续浓缩和干燥过程的时间和成本。综合考虑,选择1∶35作为最佳料液比进行提取。

图4 料液比对黄秋葵果胶多糖得率的影响
2.2.4 pH对果胶多糖得率的影响 由图5可知,pH为5.0时,果胶多糖得率最高。pH高于或低于5.0时果胶多糖得率均有所下降。不同来源的纤维素酶的最适pH可能会有一定的差异,其最适pH大多在4.5~5.0之间。pH的改变会使得酶的构象发生变化[32],酶分子的空间结构会随着溶液pH的不同而变化,在最佳pH下,酶分子上活性基团的构象最适于与底物结合。实验结果表明,pH5.0时果胶多糖得率最高。
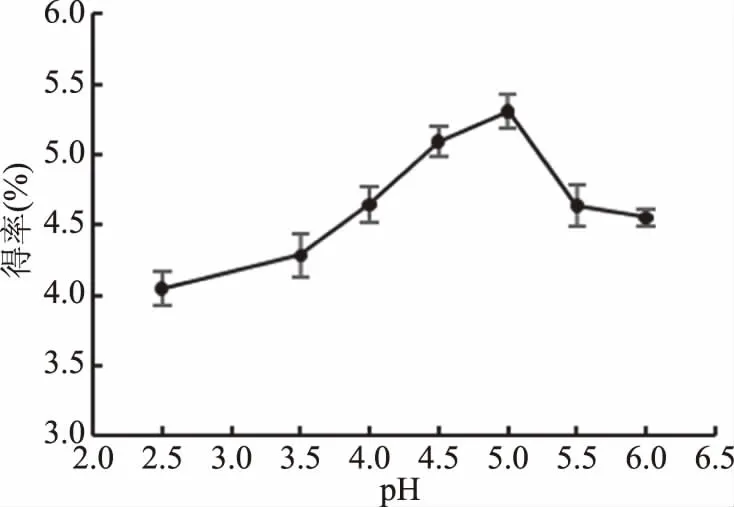
图5 不同pH对果胶多糖得率的影响
2.2.5 提取时间对果胶多糖得率的影响 图6可知,黄秋葵酒渣果胶多糖得取率随着酶解时间的增加不断提高,但当提取时间大于10 h后,果胶多糖得率增加趋于平缓。这说明增加酶解时间可以使纤维素酶对细胞壁中的纤维素物质充分酶解,从而提高果胶多糖的提取率,但酶解时间的继续增加并没有显著提升果胶多糖的提取率。其原因可能是过长的提取时间使得酶的催化活性降低,进而在提取后期对果胶多糖得率影响不大;并且过长的提取时间使大量的酒渣内杂质溶解进入提取液,同时产生大量的酶解产物与果胶多糖分子竞争,从而影响果胶多糖的提取[21]。所以,综合考虑后选择10 h作为提取时间较为合适。

图6 不同提取时间对果胶多糖得率的影响
2.2.6 提取温度对果胶多糖得率的影响 由图7知,随着温度从35 ℃增加到40 ℃,果胶多糖得率增加到了最大值。之后再升高温度,果胶多糖得率逐渐降低。温度对果胶多糖得率的影响主要有两个方面:一是温度影响溶质的扩散系数、大分子溶液的粘度以及某些物质的溶解度,较高的提取液温度可以使整个体系黏度降低,传质速率加快,果胶多糖的溶解度变高,致使果胶多糖得率提高;二是温度可以影响酶的活性,高于或者低于酶的最适温度都会使酶的活性不能充分发挥。因此,40 ℃是该提取体系的最适温度。

图7 不同提取温度对果胶多糖得率的影响
2.2.7 提取次数对果胶多糖得率的影响 从图8中可以看出,随着提取次数的增加,黄秋葵酒渣果胶多糖得率也随之增加。但是提取次数超过2次过后,其累计得率的增加幅度变小。提取次数的增加会使得后续的浓缩和醇沉更为复杂,增加成本和时间。所以,提取次数应选择2次为宜。
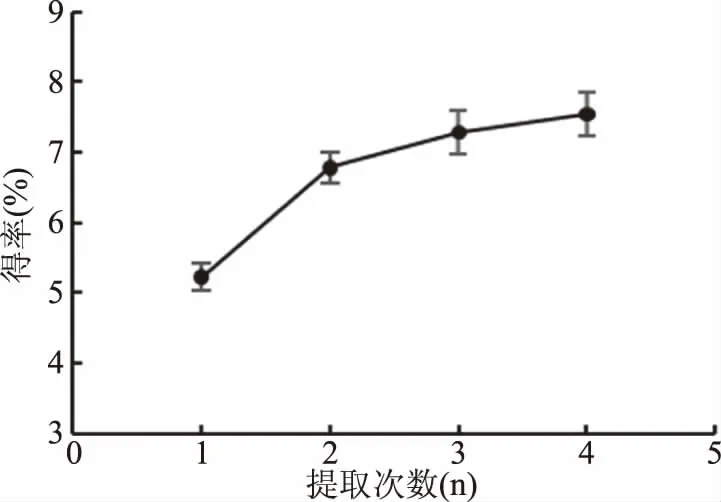
图8 提取次数对果胶多糖得率的影响
2.3 响应面优化黄秋葵酒渣果胶多糖的提取工艺
2.3.1 响应面试验结果及方差分析 响应面分析试验结果见表2和表3。
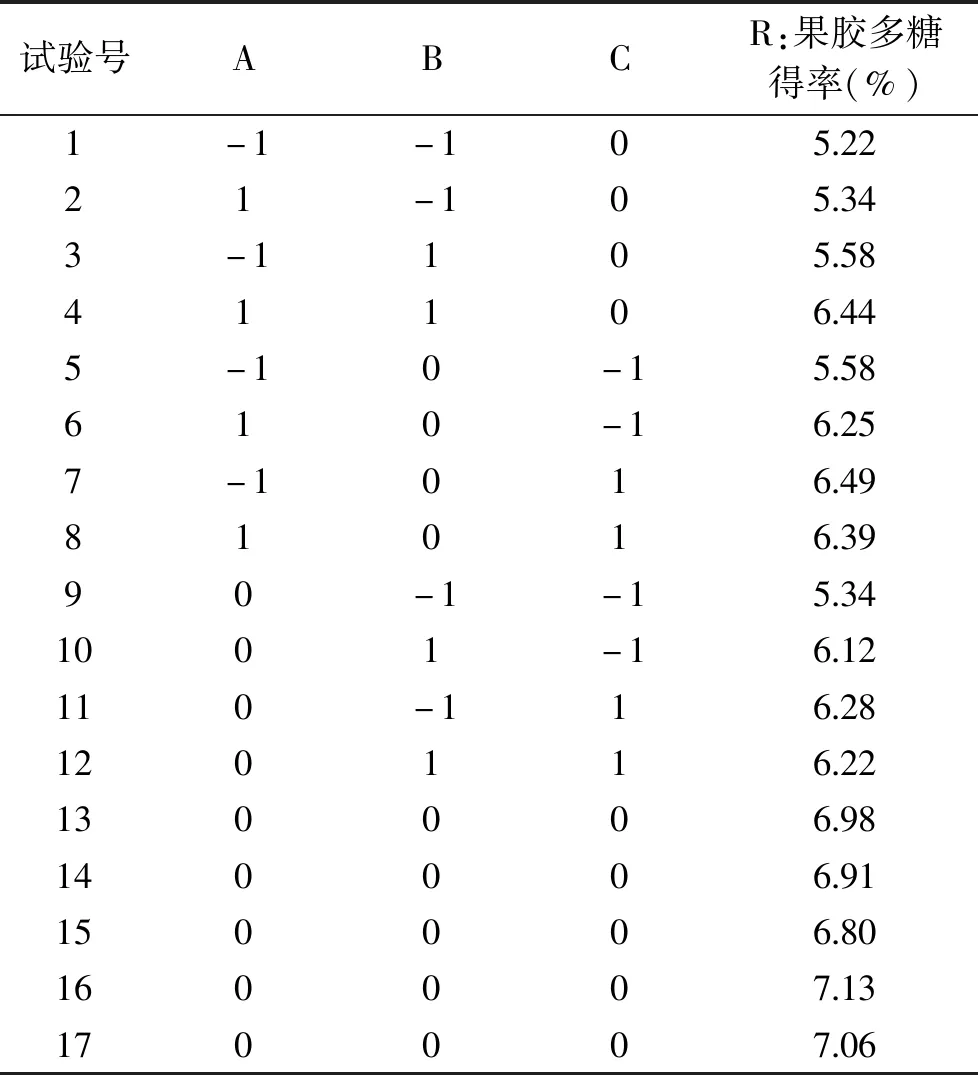
表2 响应面试验设计及结果

表3 响应面方差分析表
根据表2和表3的试验结果,使用Design Expert 8.0.6软件进行数据分析,并将试验数据回归拟合二次多项方程模型,得到黄秋葵发酵酒渣果胶多糖得率R对提取温度(A)、提取pH(B)、液料比(C)的二次多项回归模型为:
R=+6.97+0.19A+0.27B+0.26C+0.18AB-0.19AC-0.21BC-0.57A2-0.76B2-0.23C2

2.3.2 试验因素交互作用对响应值影响的3D分析 如图9所示,温度(A)和pH(B)对黄秋葵发酵酒渣果胶多糖得率的交互影响显著(P<0.05)。当pH一定时,黄秋葵果胶多糖得率随提取温度的升高先增大后减小,果胶多糖得率在40 ℃左右达到最大值。而当固定提取温度时,提取率随着pH的增大先升高后降低,在pH为5.1达到最大值。这是由于pH和温度都会显著影响酶的活性,大于或小于最佳温度和pH都会使得酶活性降低,从而使得率随之降低。

图9 提取温度和pH交互作用对果胶多糖得率的影响
如图10所示,提取温度(A)和提取料液比(C)之间也有显著的交互作用(P<0.05)。当提取温度不变时,增加料液比,果胶多糖得率先逐渐增加,而后增速渐缓,超过最高点后略有下降;而提取料液比不变时,果胶多糖得率随提取温度的增大先升高后下降,在40 ℃左右提取率达到最大值。
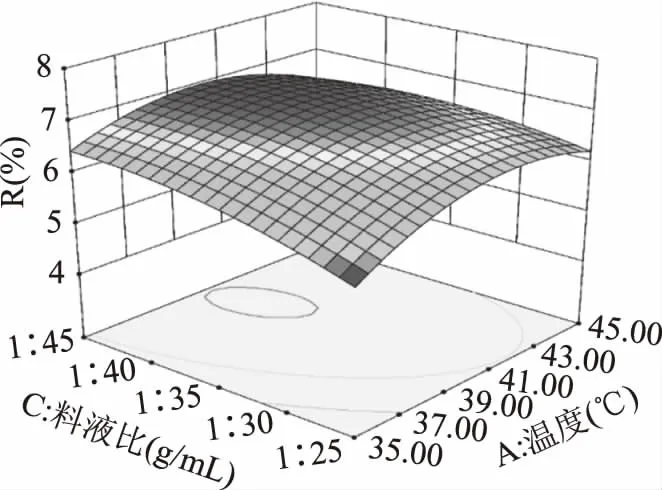
图10 提取温度和料液比交互作用对果胶多糖得率的影响
提取液pH和料液比的交互作用对得率的影响显著(P<0.05)。图11显示了在提取料液比1∶35、pH为5(中心点值)条件下,料液比和提取液pH对得率的影响。在不同pH下,料液比对黄秋葵果胶多糖提取的影响不同,pH较低时,料液比的变化对黄秋葵果胶多糖得率的影响更为明显,料液比的增大使得率先增大后减小;当pH在5.0附近时,得率不再明显变化。而当料液比不变时,pH的增大会使提取率先增大后减小。
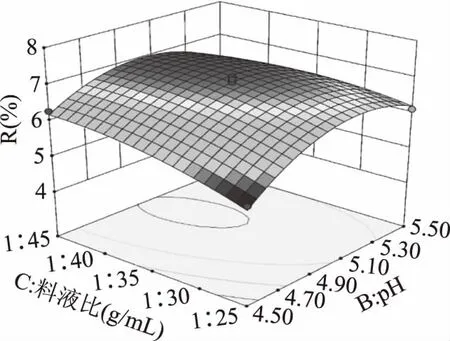
图11 提取液pH和料液比交互作用对果胶多糖得率的影响
2.3.3 最佳提取工艺及验证实验 利用Design-Expert 8.0.6软件求解回归方程,得到黄秋葵酒渣中果胶多糖的最佳提取工艺条件为:提取温度44.5 ℃、pH=5.14、液料比1∶35.7、提取时间10 h、提取2次,果胶多糖的理论得率达6.74%;按照调整后的工艺条件:提取温度45 ℃、pH=5.5、液料比1∶36、提取时间10 h、提取2次;经过3次验证实验,实际得率为6.85%±0.21%,与理论预测值的相对误差为1.6%,说明用响应面对黄秋葵发酵酒渣果胶多糖的提取进行工艺优化具有实际意义。
2.4 黄秋葵酒渣果胶多糖主要理化性质分析
酶法提取的黄秋葵酒渣果胶多糖的主要理化性质如表4所示。与从黄秋葵中提取得到的果胶多糖比较从黄秋葵酒渣中提取得到果胶多糖的蛋白质含量较低,灰分和半乳糖醛酸含量较高,具有较高的酯化度。原料经过了发酵、蒸馏等加工,可能导致部分半乳糖醛酸的损失、酯化度的改变、灰分的增加和其它性质的变化;半乳糖酸酸含量较低可能是由于黄秋葵果胶多糖本身特性决定的。

表4 黄秋葵酒渣果胶多糖的主要理化性质
色差分析的结果如表5。色泽是评价果胶多糖的一个指标。其色差指标中的L*、a*、b*、ΔE分别代表明度、红绿色调、黄蓝色调和色差。结果表明,从黄秋葵发酵酒渣中提取的果胶多糖明度相对偏低,介于黄色和绿色之间,其色差值远低于白板的色差值;直接从黄秋葵中提取的果胶多糖具有较高的明度,其色差值与白板的色差值接近。其原因可能是发酵过程中混入了其他杂质,导致灰分和色素含量过高,使其色差偏大。
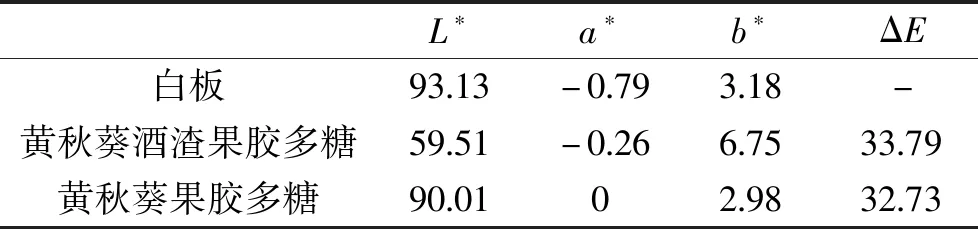
表5 黄秋葵酒渣果胶多糖和黄秋葵果胶多糖的色差分析
2.5 黄秋葵果胶多糖的单糖组成
采用PMP柱前衍生HPLC法检测黄秋葵酒渣果胶多糖和黄秋葵果胶多糖的单糖组成,7种单糖组分的含量如表6所示。实验结果显示,两种原料提取的黄秋葵果胶多糖和黄秋葵发酵酒渣果胶多糖均含有甘露糖、葡萄糖、鼠李糖、半乳糖醛酸、葡萄糖醛酸、半乳糖和阿拉伯糖,这表明这两种果胶多糖均属于酸性杂多糖,7种单糖组分分别占这两种来源的果胶多糖的54.7%和52.3%。
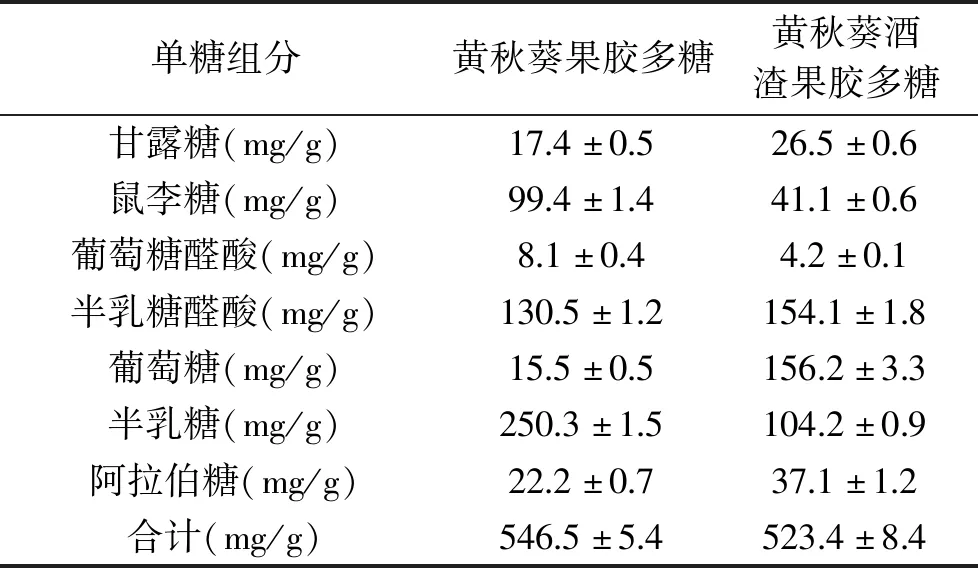
表6 黄秋葵果胶多糖和黄秋葵酒渣果胶多糖的单糖组成(n=3)
黄秋葵果胶多糖和黄秋葵酒渣果胶多糖的单糖组分的摩尔比例如图12。可以看到发酵后黄秋葵酒渣果胶多糖的单糖组分发生了部分变化。其中变化较为明显的有鼠李糖的含量由20.0%减少到8.8%,半乳糖醛酸由22.3%增加到25.6%,葡萄糖由2.7%增加到30.6%,半乳糖醛酸由46.2%减少到20.4%,阿拉伯糖由4.8%增加到8.7%。在果胶多糖的结构中,葡萄糖是不常见到的[9,33]。细胞壁中的葡萄糖通常以纤维素的形式存在,而纤维素结构较为稳定且不溶于水。发酵后的酒渣果胶多糖中葡萄糖比例的大幅度增加可能与发酵过程中葡萄糖类的多糖(如淀粉或白砂糖)的大量添加有关。鼠李糖、半乳糖醛酸、半乳糖、葡萄糖醛酸和半乳糖醛酸含量的变化可能与黄秋葵的成熟度以及不同的品种有关,而阿拉伯糖的增加可能与纤维素酶对细胞壁的破坏有关。
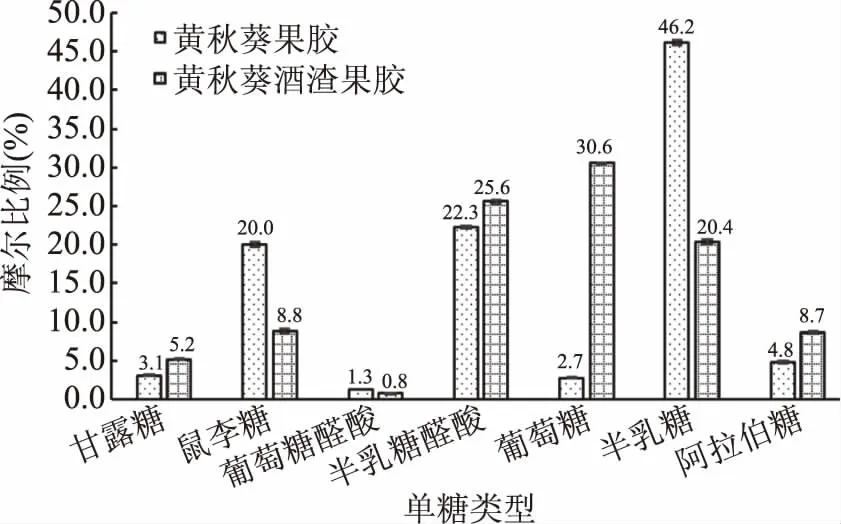
图12 黄秋葵果胶多糖和黄秋葵酒渣果胶多糖的单糖摩尔比例(n=3)
3 结论
本文以黄秋葵发酵酒渣为原料,通过单因素实验和响应面分析试验对黄秋葵酒渣中果胶多糖的提取工艺进行了优化,优化后的条件为:提取温度45 ℃、pH=5.5、液料比1∶36、提取时间10 h、提取2次,果胶多糖的理论得率达6.74%,经过验证实际得率为6.85%±0.21%。
黄秋葵酒渣果胶多糖的主要理化性质研究表明:酯化度为74.45%、半乳糖醛酸含量为20.07%、灰分含量为8.52%、蛋白质含量为2.24%、干燥失重率为18.06%、pH为6.47。采用PMP柱前衍生HPLC法测定黄秋葵酒渣果胶多糖的单糖组分表明,从黄秋葵酒渣中提取的果胶多糖属于酸性杂多糖,其单糖摩尔比例为甘露糖∶鼠李糖∶葡萄糖醛酸∶半乳糖醛酸∶葡萄糖∶半乳糖∶阿拉伯糖为5.2∶8.8∶0.8∶25.6∶30.6∶20.4∶8.7。
