降解柠檬苦素菌株的筛选鉴定及其发酵条件的优化
2020-10-23朱平平夏金兰聂珍媛
朱平平,单 杨,2,3,4,*,夏金兰,聂珍媛
(1.湖南大学研究生院隆平分院,湖南长沙 410125;2.湖南省农业科学院,湖南长沙 410125;3.湖南省农产品加工研究所,湖南长沙 410125;4.果蔬贮藏加工与质量安全湖南省重点实验室,湖南长沙 410125;5.中南大学资源加工与生物工程学院,湖南长沙 410083)
我国是世界上柑橘第一生产大国,2017年全国柑橘总产量高达 3.8×107t,并且呈逐年递增趋势[1-2],柑橘工业涉及到全国19个省(市、区)100多个柑橘大县[3]。柑橘类水果果肉甘醇多汁,糖类、有机酸、维生素、蛋白质等成分含量较为丰富[4-5]。有机酸具有抗菌活性,柠檬酸有助于人体对钙和磷的吸收,柑橘含有的氨基酸种类比较齐全,并可以调节身体各项指标的非蛋白质氨基酸[6-9]。柑橘不仅具有美容养颜的功效,还具有改善睡眠、抗过敏、预防肿瘤等医用价值[10-11],受到广大消费者的青睐。全球柑橘贸易以加工制品为主,加工量占年产量的42%以上,基本为柑橘果汁。我国柑橘主要以初级产品在国内鲜销,柑橘果汁发展相对滞后,橙汁消费量的80%以上依赖进口,占我国进口果汁总量及总额的70%以上[12]。柑橘属水果副产品生产过程中,产生的苦味导致口感不佳,对产品购买率产生了极大的负面影响,严重制约着我国柑橘加工业的发展。
柑橘类水果副产品产生苦味主要由两大类化合物造成,一类是类黄酮化合物,以柚皮苷为主;一类是三萜类化合物的衍生物,主要是柠檬苦素类似物。柠檬苦素是主要存在于柑橘属水果种子里的一类三萜类化合物[13-14],在1841年,首次从柑橘中分离提取出来[15-18]。柠檬苦素的苦味阈值在水溶液中为1.0 mg/L,在果汁中为3.4 mg/L,近似于柚皮苷苦味阈值20倍,虽然柠檬苦素与柚皮苷相比含量相对较少,但苦味较浓[19]。
目前,国内外学者针对柠檬苦素的脱苦方法进行了大量的研究,主要的方法有膜分离脱苦、超临界CO2脱苦、自然脱苦、酶法脱苦等[20]。虽然现行的脱苦方法有很多,生物脱苦法却是当前改善问题的首选方法,其中酶法脱苦具有针对性强、成效好、对风味和营养成分无损坏等优点,所以酶法脱苦是目前最有应用前景的方法。但酶法脱苦相关研究工作较少,存在高效菌株缺乏、成本高、效率低等问题。本实验将通过传统的筛选方法选育出高效降解柠檬苦素的菌株,用响应面法优化菌株的发酵条件,丰富酶法脱苦的研究,解决柑橘果汁的脱苦问题,为柑橘产业发展提供条件。
1 材料与方法
1.1 材料与仪器
多年生的橘园泥土 取自湖南省张家界市永顺县和湖南省郴州市宜章县;2种醋醅 山西陈醋厂的熏醅发酵时期和酒精发酵时期;柠檬苦素标准品(纯度≥98%) 北京索莱宝生物科技有限公司;柠檬苦素(纯度≥98%) 上海源叶生物有限公司;浓硫酸(纯度≥98%) 国家集团化学试剂有限公司;细菌基因组DNA试剂盒 天根生化科技(长沙)有限公司。
CBV-1500A型超净工作台 上海瑞仰净化装备有限公司;HZ-9612K型高温培养摇床 常州百翔实验仪器厂;ZHWY-1112B型恒温培养摇床 上海智诚仪器公司;FA2004电子天平 上海舜宇恒平科学仪器有限公司;PHS-3C pH计 仪电科学仪器;5804R型台式离心机 艾本德中国有限公司;Ultra-670型紫外可见光分光光度计 上海翱艺仪器有限公司;S1000 PCR仪 美国Bio-rad公司;RE-52AA型旋转蒸发仪 上海亚荣生化仪器厂;SHZ-Ⅲ型循环水真空泵 上海知信实验仪器技术有限公司;DYY-12型稳压恒流水平电泳仪 北京市六一仪器厂;GelDocXR+凝胶成像系统 美国Bio-rad公司;9050隔水式恒温培养箱 上海一恒科学仪器有限公司。
1.2 实验方法
1.2.1 培养基的种类
1.2.1.1 驯化液体培养基 NH4NO315 g、K2HPO410 g、Na2SO41 g、KCl 5 g、NaCl 1 g、酵母粉1 g、柠檬苦素100 mg、蒸馏水1 L(柠檬苦素含量100 mg/L)[21]。
1.2.1.2 选择性液体培养基 NH4NO315 g、K2HPO410 g、Na2SO41 g、KCl 5 g、NaCl 1 g、柠檬苦素100 mg、蒸馏水1 L(柠檬苦素含量100 mg/L)[21]。
1.2.1.3 选择性固体培养基 NH4NO315 g、K2HPO410 g、Na2SO41 g、KCl 5 g、NaCl 1 g、柠檬苦素100 mg、琼脂20 g、蒸馏水1 L(柠檬苦素含量100 mg/L)[21]。
1.2.1.4 LB液体培养 基酵母粉提取物5 g、胰蛋白胨10 g、NaCl 10 g、蒸馏水1 L[21]。
1.2.2 柠檬苦素降解菌的分离 在超净工作台下,将拿到的土壤样品和醋醅样品1000 r/min离心5 min,去泥土和杂质,收集上清菌液,8000 r/min离心10 min收集菌斑,接种于250 mL锥形瓶中(含有100 mL驯化液体培养基),浓度为2×109CFU/mL,在35 ℃、170 r/min摇床培养36 h后,重新接种于新的驯化培养基,浓度为2×109CFU/mL,继续在35 ℃、170 r/min摇床培养36 h。将驯化得到的菌液于4 ℃、8000 r/min离心10 min,再接种到250 mL锥形瓶中(含有100 mL选择性液体培养基),在35 ℃、170 r/min摇床培养12 h,取0.1 mL上清液涂布于选择性固体培养基表面,继续放在35 ℃的恒温培养箱中,培养36 h后,观察培养皿上长出的不同菌落,再用平板划线法分离进行纯化培养,直到获得纯菌种,4 ℃斜面保存。
1.2.3 柠檬苦素含量的测定
1.2.3.1 柠檬苦素标准曲线绘制 显色试剂A液:将浓硫酸65 mL、无水乙醇35 mL混合作为贮备酸液用,将125 mg DMAB溶解100 mL贮备酸液即得到DMAB指示剂,现配现用。显色试剂B液:精确称取氯化铁0.9 g,溶解于蒸馏水中并定容至100 mL。使用时,往A液中加入0.5 mL B液并混匀,即配即用。
精确称量13 mg柠檬苦素标准品,用无水乙醇溶解并定容至100 mL,作为标准溶液备用。准确吸取0、0.25、0.5、0.75、1.0、1.25、1.5、2.0 mL标准溶液于试管中,分别加无水乙醇至2.0 mL,再分别快速加入5.0 mL混合A液和B液的显色剂,室温下放置30 min。于500 nm处测定吸光度,以吸光度为纵坐标,以柠檬苦素标准液的质量浓度(mg/mL)为横坐标,绘制标准曲线,并求得回归方程为:y=7.2446x-0.0002,R2=0.999。
1.2.3.2 柠檬苦素降解率的测定 参考文献[22],将接种后的发酵液3900 r/min,离心10 min,使菌体与上清分离,收集上清液。称取50 mL上清液于125 mL分液漏斗中,以15 mL×2次石油醚脱脂后,分离除去石油醚层,加1 g MgSO4,然后以15 mL氯仿萃取3次,静置分层,合并3次氯仿萃取液,将氯仿萃取液真空减压浓缩。将浓缩物用无水乙醇定容到25 mL,待测。根据下式取其中1 mL样品测降解率。
式(1)
式(1)中:m1为对照中的柠檬苦素含量,mg;m2为降解后的样品中剩余柠檬苦素含量,mg。
1.2.3.3 酶活力测定 参考文献[23],柠檬苦素酶活力定义:以酶反应条件下每毫升酶液每分钟所降解的柠檬苦素的微克数为单位酶活力(U)。参考方法1.2.2,收集培养36 h的发酵液,于8000 r/min离心10 min,取粗酶液待用。
样品对照:取1 mL的0.13 mg/mL的柠檬苦素标准液于标记的10 mL比色管中,加入粗酶液0.1 mL,于100 ℃反应10 min使酶失活,冷却后先加0.9 mL的无水乙醇,再加5 mL配好的显色剂终止反应。样品反应液于室温下反应10 min,其他方法与样品对照的方法相同。每个菌株设置三个平行实验,在波长为500 nm测定吸光度,根据标准曲线方程,按照式(2)计算测定菌株所对应的酶活力。
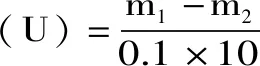
式(2)
式(2)中,m1为对照样品液中柠檬苦素质量/μg;m2为反应液中的柠檬苦素质量/μg。
1.2.3.4 高效降解柠檬苦素的菌株筛 选用接种环轻轻刮取初筛得到的菌株的菌苔,接入30 mL的LB液体培养基中,35 ℃、170 r/min摇床培养10 h后,无菌水调节OD值为0.8制得种子液。将种子液按1%的接种量接种到50 mL的选择性培养基中,35 ℃、170 r/min恒温振荡培养24 h,每个实验重复3次。测定培养试验前后培养基中柠檬苦素的含量,以不接菌的液体培养基为空白对照,计算各菌株的柠檬苦素降解率。
1.2.4 柠檬苦素高效降解菌的分类鉴定
1.2.4.1 形态学特征 将纯化后的菌株接种于LB固体平板培养基上,35 ℃培养12 h后观察其菌落生长情况和形态,参考文献[24]进行革兰氏染色。挑取单菌落制成玻片,置于光学显微镜下观察各菌株的显微形态。收集对数期的菌样品拍SEM观察[25]。
1.2.4.2 分子生物学鉴定 细菌基因组DNA试剂盒提取以上3株菌的总基因组DNA,采用细菌16S rDNA通用引物(27F:5′-AGAGTTTGATCCTGGCT CAG-3′,1492R:5′-GGYTACCTTGTTACGACTT-3 ′)进行PCR扩增。所述的PCR反应体系:DNA模板(基因组DNA20-50 ng/μL)0.5 μL,27 F和1492 R引物各0.5 μL,2×PCR-mix 12.5 μL,ddH2O 11 μL,总体系为25 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸90 s,33个循环;72 ℃ 修复延伸 10 min;最后4 ℃终止反应。所得产物送至擎科(长沙)生物公司进行测序,测序所得的16S rDNA序列,提交到NCBI数据库进行Blast在线比对,进行同源性序列搜索,利用MEGA 5软件分析,采用Neighbor-Joining构建系统发育树,Bootstrap 500次进行稳定性验证。
1.2.5 单因素实验
1.2.5.1 培养初始pH对柠檬苦素降解率的影响 由于柑橘果汁都是酸性的,pH在4.0左右,在酸性条件下,柠檬苦素脱苦酶活力会得到抑制[26],因此,pH是菌株产柠檬苦素酶的重要因素。本实验设定初始pH梯度为2.5、3.5、4.5、5.5、6.5、7.5。在氮源为硝酸铵、菌接种量为1×108CFU/mL、碳源柠檬苦素含量100 mg/L条件下,于35 ℃,170 r/min条件下培养96 h,每个梯度设置3个平行,以研究菌株产柠檬苦素酶的最适pH。
1.2.5.2 培养温度对柠檬苦素降解率的影响 本实验设定培养温度在25、30、35、40、45 ℃下,在最适的pH、氮源为硝酸铵、菌接种量1×108CFU/mL、碳源柠檬苦素含量100 mg/L条件下,170 r/min培养12 h,每个样品做三个平行实验,以研究最适培养温度。
1.2.5.3 氮源对柠檬苦素降解率的影响 将未加氮源的发酵培养基平均分成5份,按照培养基的体积,分别加入15 g/L的蛋白胨、硫酸铵、硝酸铵、硝酸钠、氯化铵和尿素,在最适pH、最适温度、菌接种量1×108CFU/mL、碳源柠檬苦素含量100 mg/L条件下,170 r/min培养12 h,每个样品做三个平行,以研究最适培养氮源。
1.2.5.4 菌接种量对柠檬苦素降解率的影响 本实验以1×108CFU/mL为单位,在不同浓度梯度1、2、4、6、8下,在最适pH、最适温度、最适氮源、碳源柠檬苦素含量100 mg/L条件下,170 r/mim培养12 h,每个样品做三个平行,以研究菌株产柠檬苦素酶的最适培养菌接种量。
1.2.6 Box-behnken试验设计 采用Design-Expert 8.0软件,用Box-behnken试验设计[27-28],因JJ-3菌株降解能力相对较高,本实验分别选取影响JJ-3菌株产柠檬苦素降解酶的4个因素,包括pH(A)、温度(B)、氮源(C)、菌接种量(D),每个因素选取三个水平,即高、中、低水平,每组实验重复3次。表1表示实验因素对应变量水平的对应值。以柠檬苦素的降解率作为响应值,用4因素3水平的响应曲面进行实验设计,分别进行二次多项方程拟合及优化分析。设计结果如表1所示。

表1 Box-Behnken试验因素与水平设计
1.3 数据处理
实验数据的处理分别采用Microsoft Excel(office 2016)、Design Expert 8.0、Origin2016等软件进行分析及绘制图形。
2 结果及分析
2.1 柠檬苦素降解菌的分离筛选
在选择性液体培养基中,柠檬苦素是唯一碳源,驯化培养一段时间后,划线纯化培养,最终纯化出8株菌,如表2所示,分别为编号XP、JJ-2、JJ-3、C-2-1、C-1-2-2、C-1-5、E-3-1、S-15-2。测定以上8株菌的柠檬苦素降解率,结果如表2所示。表2表明,从醋醅和多年生橘园的土壤中纯化出的8株降解柠檬苦素的菌株,其中柠檬苦素降解率在25%以上的有3株(C-1-5、C-1-2-2、JJ-3),柠檬苦素降解率分别为27%、36%、38%,以这三株表现出较强降解优势的菌株,作为本研究的优势柠檬苦素降解菌,用于后续的试验。
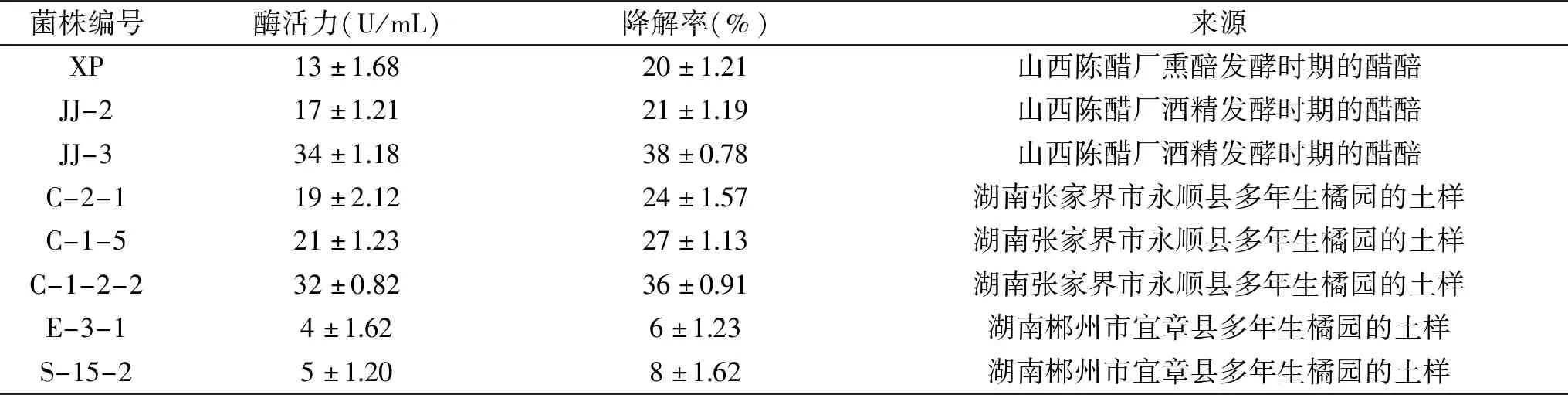
表2 筛选得到的降解菌株降解能力及来源
2.2 优势柠檬苦素降解菌的分类鉴定
2.2.1 菌落形态学观察 对3株菌进行菌落形态及显微特征的观察,对应的菌落特征和显微特征结果见表3,3株菌均属于细菌,电子显微镜下观察革兰氏染色后个体形态图,如图1 所示,C-1-5、C-1-2-2、JJ-3均为革兰氏阴性菌G-,扫描电镜下,如图2所示,3种菌均为短杆状。C-1-5菌的细胞个体较C-1-2-2和JJ-3菌大一些。

表3 菌株的菌落形态及显微特征
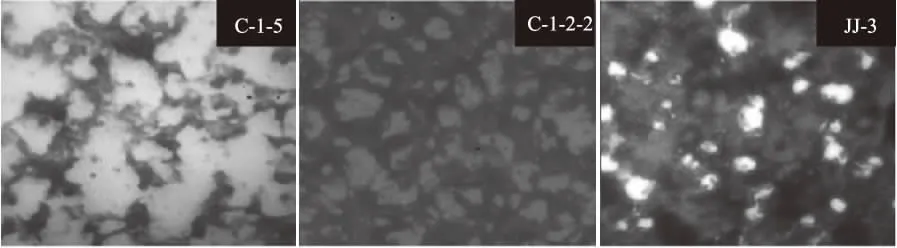
图1 菌株C-1-5、C-1-2-2、JJ-3号革兰氏染色观察
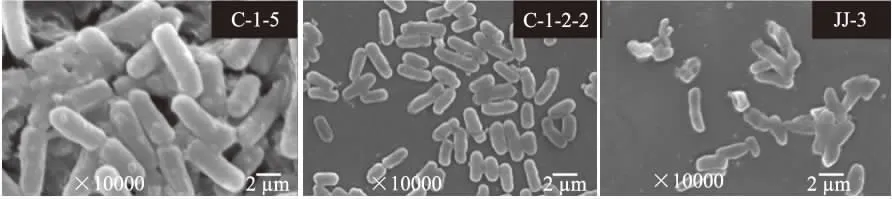
图2 菌株C-1-5、C-1-2-2、JJ-3的SEM观察
2.2.2 分子生物学鉴定 菌株C-1-5、C-1-2-2、JJ-3经过DNA提取、PCR扩增,结果见图3,得到3条分别为1322、1383、1354 bp的扩增产物,将上述扩增产物测序后得到的结果提交到NCBI数据库中,采用BLAST程序进行同源性比对,并获取登录号分别为MN701037、MN701062、MN700650,结果显示C-1-5与纤维菌属(Cellulomonassp.)序列同源性较高,C-1-2-2和JJ-3与苍白杆菌属(Ochrobactrumsp.)序列同源性较高。因此,C-1-5为纤维菌属(Cellulomonassp.),C-1-2-2和JJ-3为苍白杆菌属(Ochrobactrumsp.)。
图3 菌株C-1-5、C-1-2-2、JJ-3的16S rDNA PCR扩增结果
选取与C-1-5、C-1-2-2、JJ-3三种菌株相似度较高(>95%)的菌株的16S rDNA基因序列,分别进行ClustalW比对后,用MEGA 5构建系统发育树如图4、图5、图6所示,菌株C-1-5与纤维菌属(Cellulomonassp.)亲缘关系较近,菌株C-1-2-2和JJ-3与苍白杆菌属(Ochrobactrum sp.)亲缘关系较近。根据以上形态学特征、显微镜观察以及16S rDNA序列分析结果,将菌株C-1-5鉴定为纤维菌属(Cellulomonassp.),菌株C-1-2-2和JJ-3鉴定为苍白杆菌属(Ochrobactrumsp.)。

图4 菌株C-1-5的16S rDNA系统发育树
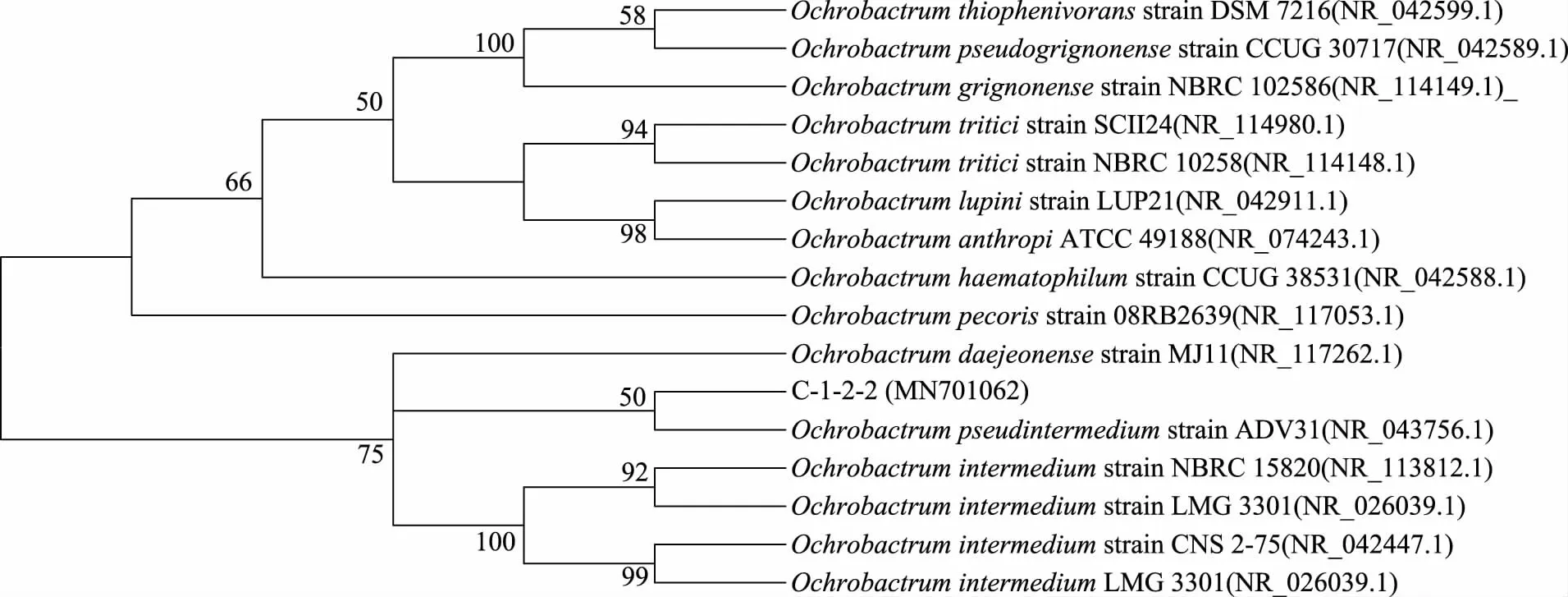
图5 菌株C-1-2-2的16S rDNA 系统发育树

图6 菌株JJ-3的16S rDNA 系统发育树
2.3 单因素实验结果
2.3.1 初始pH对柠檬苦素降解率的影响 初始的pH对柠檬苦素降解率的影响结果如图7所示,随着pH的增加三株菌的柠檬苦素降解率均出现了先上升后降低的趋势,C-1-5菌株在pH为5.5时,柠檬苦素降解率达到最大47.06%,选择最适pH为5.5;C-1-2-2菌株在pH为4.5时,柠檬苦素降解率达到最大43.17%,选择最适pH为4.5;JJ-3菌株在pH为3.5时,柠檬苦素降解率达到最大55.83%,选择最适pH为3.5。
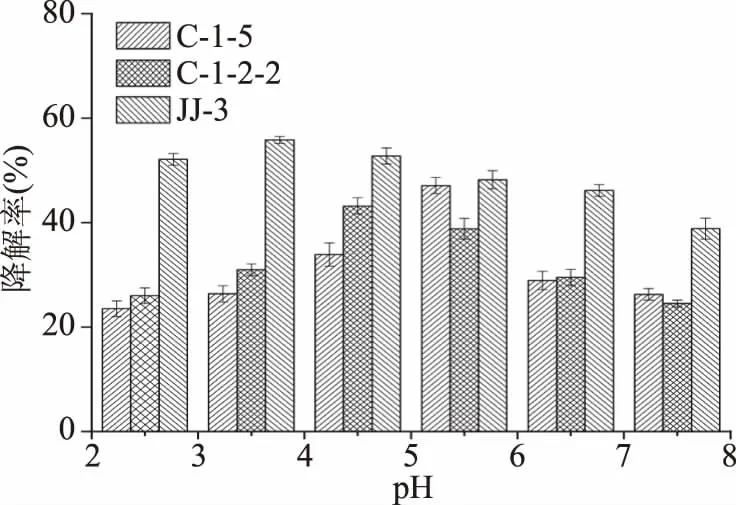
图7 pH对柠檬苦素降解率的影响
2.3.2 温度对柠檬苦素降解率的影响 温度对柠檬苦素降解率的影响如图8所示,随着温度的升高,三株菌的柠檬苦素降解率均出现了先上升后降低的趋势,C-1-5菌株在温度为40 ℃时,柠檬苦素降解率达到最大50.14%,选择最适温度为40 ℃;C-1-2-2菌株在温度为40 ℃时,柠檬苦素降解率达到最大52.04%,选择最适温度为40 ℃;JJ-3菌株在温度为30 ℃时,柠檬苦素降解率达到最大59.16%,选择最适温度为30 ℃。
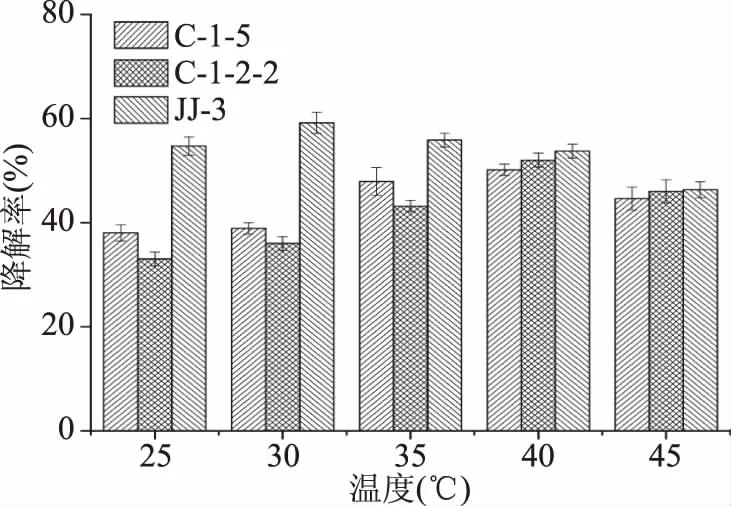
图8 温度对柠檬苦素降解率的影响
2.3.3 氮源对柠檬苦素降解率的影响 不同氮源对柠檬苦素降解率的影响,结果如图9所示,不同的氮源,三株菌的柠檬苦素降解率没有相应规律性,其中C-1-5、C-1-2-2菌株均在氮源为氯化铵时,柠檬苦素降解率达到最大分别为63%、58%,选择最适氮源为氯化铵;JJ-3菌株在氮源为硝酸铵时,柠檬苦素降解率达到最大为59.15%,选择最适氮源为硝酸铵。
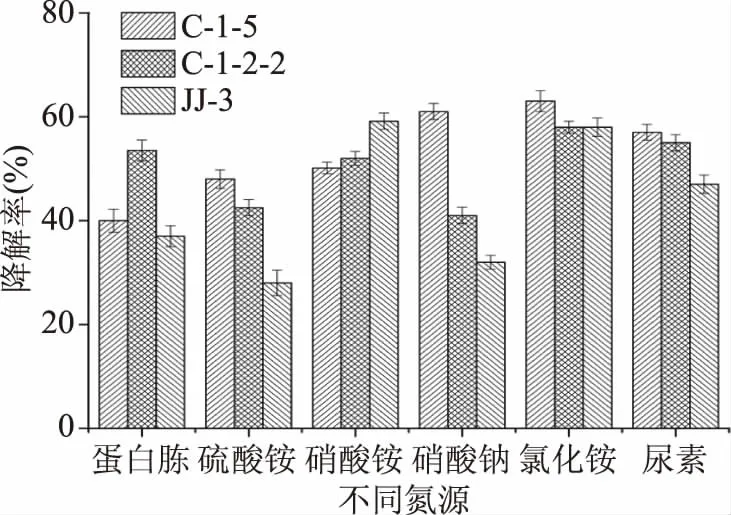
图9 氮源对柠檬苦素降解率的影响
2.3.4 菌接种量对柠檬苦素降解率的影响 最适的接种量可以缩短菌株的生长周期,因为不同浓度的接种量影响着菌株在降解过程中的生长速度。接种量过大时会产生过多的代谢物,影响菌株的生长速度;接种量过小时会延长菌株的生长周期,缓慢达到对数期,降低生长速率。菌的接种量对柠檬苦素降解率的影响如图10所示,三株菌C-1-5、C-1-2-2、JJ-3的最适菌浓均在2×108CFU/mL时,柠檬苦素降解率达到最大分别为65.90%、72.79%、74.66%,最适接种的菌浓度为2×108CFU/mL。综合考虑,选择三菌株的最适接种量为1×108~4×108CFU/mL。

图10 菌接种量对柠檬苦素降解率的影响
2.4 响应面试验结果与分析
2.4.1 回归模型得建立与显著性分析 按照1.2.6方法设计实验,以单因素实验结果为基础,设计响应面试验优化柠檬苦素降解率结果见表4。
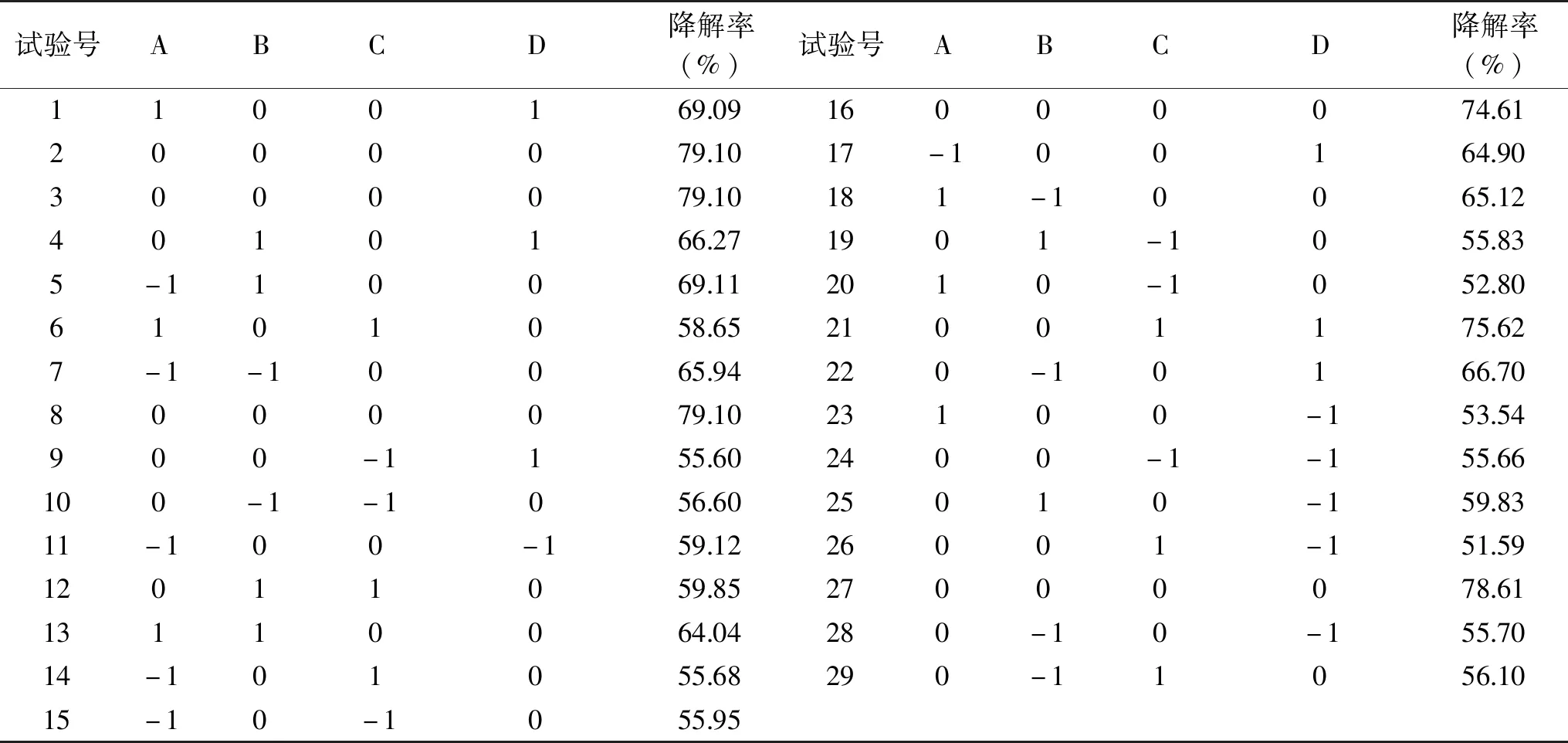
表4 柠檬苦素降解率响应面试验设计及结果
采用Design Expert 8.0软件,用软件进行非线性回归的二次多相似拟合,得到预测模型如下:
Y=78.10-0.62A+0.73B+2.09C+5.23D-1.06AB+1.53AC+2.44AD+1.13BC-1.14BD+6.02CD-7.70A2-6.8B2-13.2C2-7.74D2
回归模型的方差分析如表5所示,回归方程的模型P<0.0001,F=17.33,说明模型差异性显著;模型失拟项P=0.1734>0.05,说明失拟不显著,这代表不确定因素对实验干扰较小;R2=0.9454,说明该模型能解释94.54%的响应值变化,即变化来源于所取得四个因素,回归模型理想,拟合度高,可使用该模型对柠檬苦素降解率进行预测和分析。
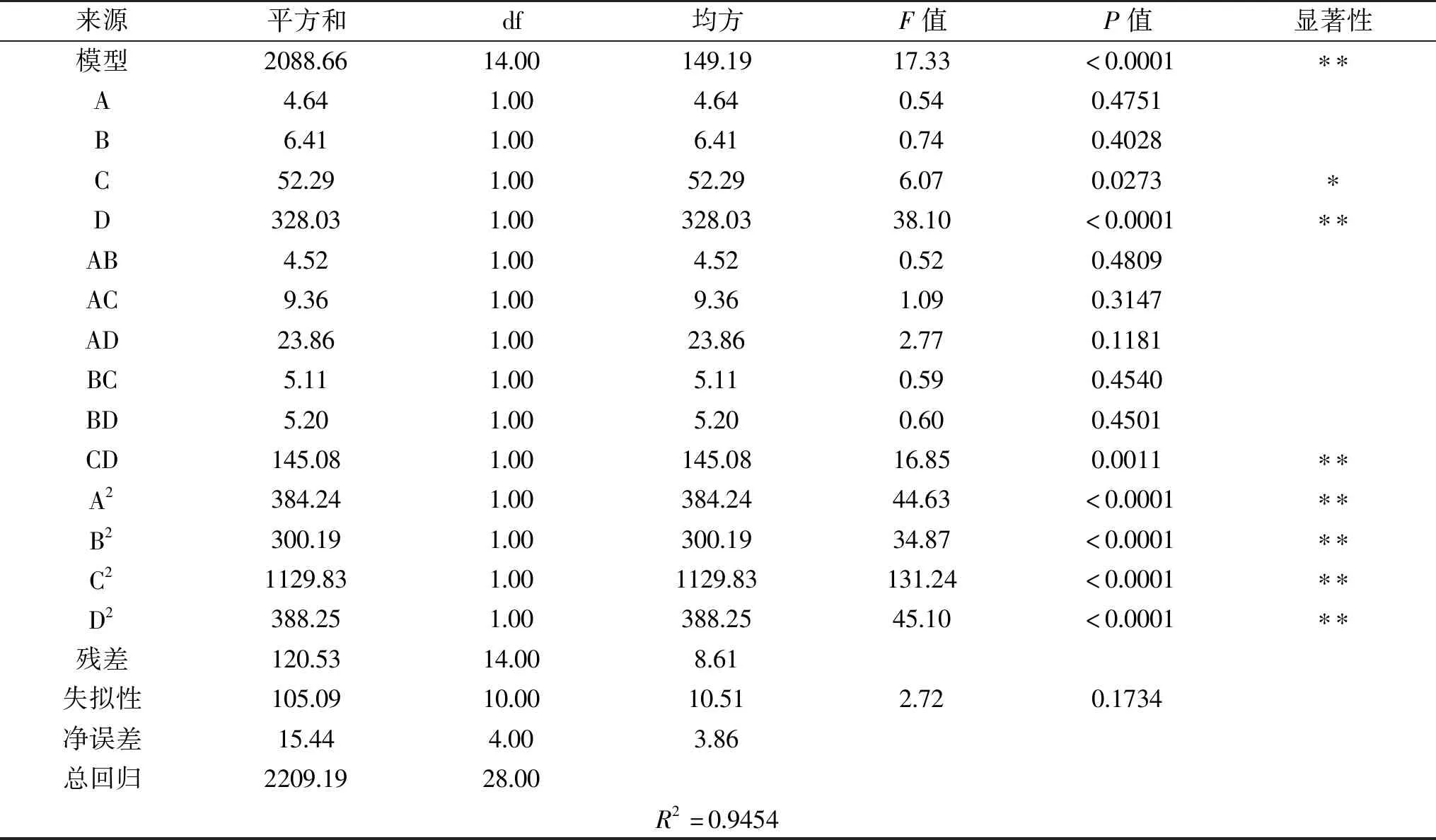
表5 柠檬苦素降解率的响应面方差分析结果
根据F值大小可以判断A、B、C、D四个因素对柠檬苦素降解率得影响,由大到小得顺序依次为:D(菌接种量)>C(氮源)>B(温度)>A(pH);次项D(菌接种量)对柠檬苦素降解率有极显著影响(P<0.01),一次项C(氮源)对柠檬苦素降解率影响显著(P<0.05),二次项A2、B2、C2、D2影响极显著(P<0.01),交互项CD影响极显著(P<0.01)。
2.4.2 响应面图分析 为进一步分析各因素对响应值的影响,做出各因素之间的响应面图和等高线图如图11所示。从上至下,交互影响因素依次为AB、AC、AD、BC、BD、CD,响应面越陡并且等高线呈椭圆形,说明相互作用显著。
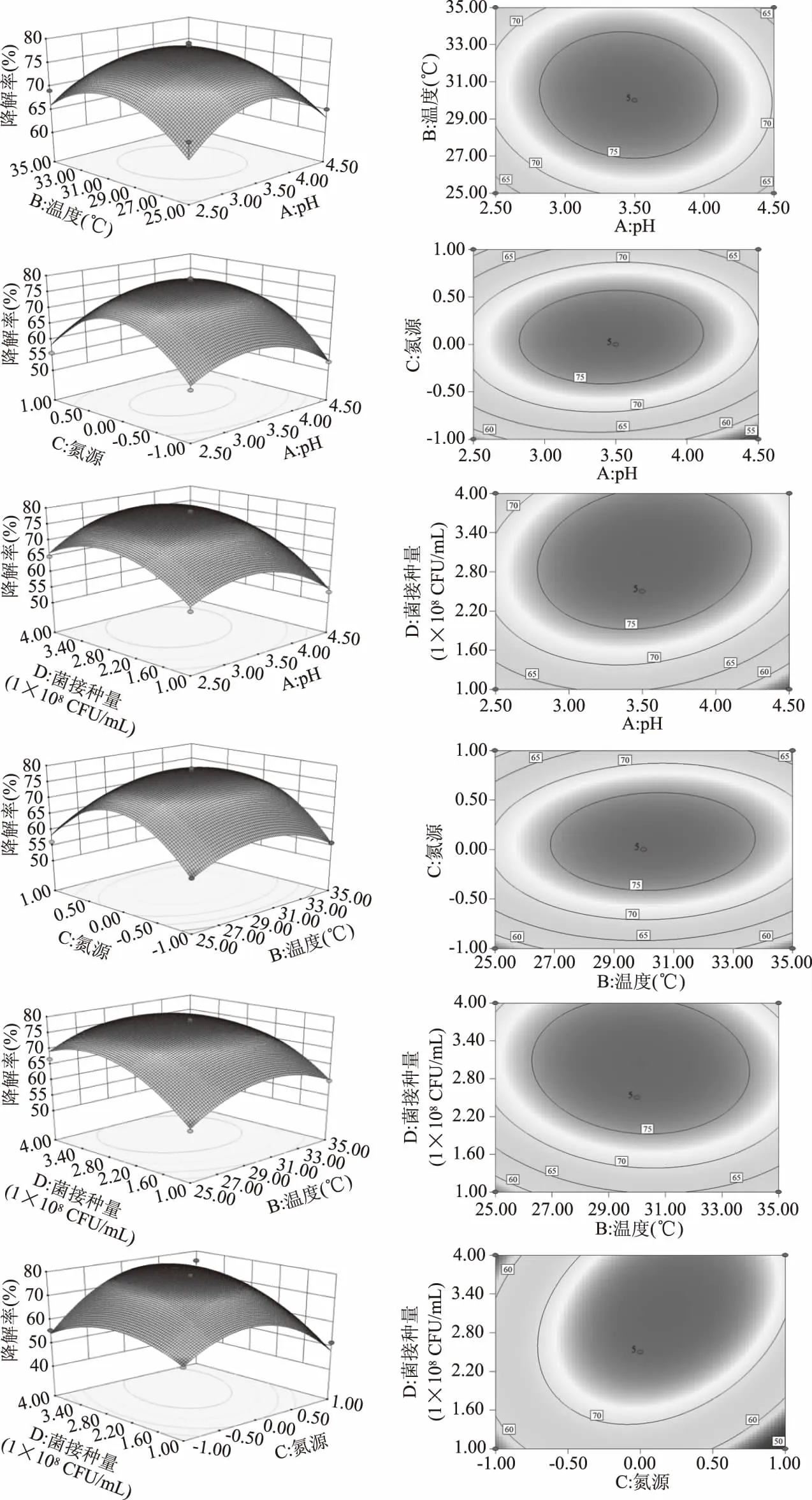
图11 各因素之间交互作用的响应面和等高线图
2.4.3 验证实验 对回归模型设计数据结果进行分析,得到柠檬苦素降解的最佳条件为:pH为3.54,温度为30.16 ℃,氮源水平为0.18,菌接种量为3.12×108CFU/mL。为了验证该方法的可靠性,并且考虑实际的操作情况,将柠檬苦素降解的最佳条件调整为:pH为3.5,温度为30 ℃,氮源水平为0(硝酸铵),菌接种量为3×108CFU/mL。测得柠檬苦素降解率为78.90%,与理论预测值79.36%相差0.46%,说明此模型拟合良好可靠。
3 结论与讨论
本研究从多年生长的橘园的土壤和新鲜醋醅中筛选得到8株菌株,其中C-1-5、C-1-2-2、JJ-3菌株的柠檬苦素降解率达到27%、36%、38%,在最适pH、温度、氮源和接种量的情况下,C-1-5、C-1-2-2、JJ-3菌株的柠檬苦素降解率提高至65.90%、72.79%、74.66%。形态学鉴定和16S rDNA序列分析结果表明,C-1-5为纤维菌属,C-1-2-2和JJ-3为苍白杆菌属,新发现纤维菌属和苍白杆菌属可降解柠檬苦素,丰富了已有报道的柠檬苦素降解菌株的类型。
通过响应面法优化试验,JJ-3菌株的柠檬苦素降解率的最佳工艺为:pH为3.5,温度为30 ℃,氮源为硝酸铵,菌接种量为3×108CFU/mL。最佳工艺下柠檬苦素降解率为78.90%。试验表明JJ-3菌株在pH3.5的柑橘果汁中具有良好的降解性,可为实际应用提供参考。
