产单宁酶乳酸菌发酵红豆、扁豆酸面团的生化特性及其对馒头体外消化的影响
2020-10-23马子琳曹伟超张宾乐郑建仙黄卫宁FilipArnaut
马子琳,曹伟超,张宾乐,武 盟,罗 昆,郑建仙,黄卫宁,*,李 宁,Filip Arnaut
(1.江南大学食品科学与技术国家重点实验室,江苏无锡 214122;2.华南理工大学食品科学与工程学院,广东广州 510641;3.广州焙乐道食品有限公司,广东广州 511400)
豆类是一种重要的膳食蛋白质来源,并且能够提供碳水化合物、膳食纤维、维生素和人体健康所需的矿物质,具有很高的营养价值[1-2]。馒头是中国传统的主食之一,具有鲜明的民族特色[3],将豆类应用在馒头体系中可以增强馒头的营养,增加馒头种类,拓宽消费市场。然而,豆类属于不含有面筋的无麸质体系,制作出的面团无法形成持气的网络[4],导致制作出的馒头比容变小,硬度增加,适口性下降[5],同时豆类中含有较多的抗营养因子[6],包含单宁、植酸、寡糖等,会不同程度影响人体对营养物质的消化吸收[7],如单宁可以与蛋白质、糖、消化酶等结合,形成难以被消化吸收复合物[8],这些方面限制了豆类在馒头体系中的应用。
酸面团是由谷物、水和活性酵母菌或乳酸菌相互作用形成的一种面团[9],在食品中具有悠久的应用历史。通过酸面团发酵技术可以改善面团的流变特性、增强风味、改善馒头比容、质构及货架期[10-11]。此外,一些乳酸菌在酸面团发酵过程中还会产生能够降解抗营养因子的酶类[12],如单宁酰基水解酶、植酸酶、α-半乳糖苷酶等,可以有效降低豆类中的抗营养因子[13],从而减弱其对营养物质消化吸收的不良影响。而已有研究发现存在乳酸菌具有降解单宁的能力,如Osawa等[14]就从日本传统发酵食品等原料中成功分离出了若干株单宁酶阳性的植物乳杆菌与戊糖片球菌,Vaquero等[15]从葡萄汁和葡萄酒中分离出了多株具有单宁酶活性的植物乳杆菌,Apinun等[16]则对来自泰国传统发酵茶叶的戊糖乳杆菌所产的单宁酶进行了研究。应用这类产酶乳酸菌进行酸面团发酵或能减弱豆类单宁带来的不利影响。
本课题组前期已从自然发酵的豆粉中分离筛选出一株高产单宁酶乳酸菌D23,经鉴定为发酵乳杆菌(Lactobacillusfermentum)。本研究以红豆、扁豆为研究基质,利用该株高产单宁酶乳酸菌进行酸面团发酵制备两种豆类馒头,旨在研究该株降解单宁乳酸菌对红豆、扁豆酸面团生化特性以及馒头产品体外消化的影响,为开发以乳酸菌作为天然发酵剂的豆类馒头提供一定理论参考。
1 材料与方法
1.1 材料与仪器
红豆粉、扁豆粉 市售;发酵乳杆菌D23 分离自自然发酵豆粉;美玫牌低筋小麦粉 香港面粉厂有限公司;即发活性干酵母 乐斯福有限公司;MRS肉汤培养基 杭州百思生物技术有限公司;儿茶素、齐墩果酸 上海源叶生物科技有限公司;α-淀粉酶、淀粉葡萄糖苷酶、胃蛋白酶、胰蛋白酶、茚三酮、高氯酸、三氟乙酸、乙腈等 国药集团化学试剂有限公司;BCA蛋白浓度测定试剂盒(增强型) 碧云天生物技术有限公司。
洁净工作台 山东博科科学仪器有限公司;APX-150C型恒温恒湿培养箱 上海博迅集团有限公司;LPZX-50KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;JYD-900L超声波细胞粉碎仪 上海之信仪器有限公司;Scientz-10ND冷冻干燥机 宁波新芝生物科技股份有限公司;FE-20 pH计 梅特勒-托利多国际贸易(上海)有限公司;TU-1810紫外可见分光光度计 京普析通用仪器有限责任公司;SM-25搅拌机、起酥机、SPC-40SP醒发箱 新麦机械(无锡)公司;MZ-SYH26-CB美的中式电蒸锅 广东美的生活电器制造有限公司;1525高效液相色谱仪(high performance liquid chromatography,HPLC) 美国Waters公司。
1.2 实验方法
1.2.1 红豆、扁豆酸面团的制备及发酵特性
1.2.1.1 酸面团的制备 将发酵乳杆菌D23活化两代培养至对数期,将菌液以10000 r/min离心5 min,用无菌生理盐水洗涤2次后得获得菌泥。用称量好的无菌水溶解菌泥后分别与红豆、扁豆粉混合搅拌均匀(使酸面团初始接种量达到107CFU/g),酸面团DY值红豆为250,扁豆为300。制作好的酸面团于30 ℃的恒温培养箱中培养24 h。DY值指制作酸面团时粉与水的质量比,其计算公式如下:DY值=[m(粉)+m(水)/m(粉)]×100。
1.2.1.2 酸面团的pH、总可滴定酸度(TTA)以及菌落数(CFU)的测定 分别取10 g不同发酵时间(0、4、8、12、16、20、24 h)的酸面团放入锥形瓶中,加入90 mL去离子水,磁力搅拌30 min,静置10 min,测定pH。用0.1 mol/L的NaOH滴定至pH达到8.6,消耗的NaOH的毫升数即为总可滴定酸度。同时取10 g不同发酵时间的酸面团,加入90 mL无菌生理盐水混合均匀,在无菌操作台将混合悬液进行10倍梯度稀释,然后选取10-5~10-8的稀释梯度,取100 μL涂布于MRS固体平板上,37 ℃培养48 h进行菌落计数[3]。
1.2.1.3 酸面团冻干样品的制备 分别取不同发酵时间(0、4、8、12、16、20、24 h)的酸面团样品于塑封袋中,置于-80 ℃冰箱中冷冻后,放入冷冻干燥机中冻干3~4 d,取出冻干样品研磨成粉,用于后续实验。
1.2.2 酸面团发酵前后抗营养因子含量的变化
1.2.2.1 缩合单宁含量的测定 准确称取1.0 g酸面团冻干样品,用10 mL盐酸∶甲醇(1∶100)在室温下振荡提取2.5 h,并以4000 r/min离心20 min,取上清液。采用香草醛法[17]对样品中缩合单宁的含量进行测定。使用儿茶素来制作标准曲线,测定结果以儿茶素当量表示。标准曲线方程:y=0.968x-0.0266,R2=0.9973。
1.2.2.2 植酸含量的测定 准确称取0.5~1.0 g酸面团冻干样品于离心管中,加入20 mL HCl溶液(0.5 mol/L)在室温下以150 r/min振荡提取植酸3 h,6000 r/min离心20 min取上清作为提取液。取1 mL提取液,加入2 mL NH4Fe(SO4)2溶液(0.02%),沸水浴反应30 min后用冰水冷却,再次6000 r/min离心15 min。取上清液2.0 mL于试管中,加入3.0 mL双吡啶溶液(1%),摇匀,在10 min内于519 nm处测定吸光度[18],用HCl溶液溶解植酸标准品作为标准溶液绘制标准曲线,根据标准曲线计算样品中的植酸含量。标准曲线方程:y=-4.2057x+0.9582,R2=0.9983。
1.2.2.3 皂苷含量的测定 准确称取1.0 g酸面团冻干样品于离心管中,加入20 mL 75%乙醇,以250 W功率超声处理20 min,加热振荡1 h,6000 r/min离心20 min取上清液,低温挥干乙醇后用甲醇溶解定容,作为待测液。根据娄在祥等[19]的方法对样品中皂苷的含量进行测定,吸取待测样品液50 μL于试管中,在70 ℃水浴下挥干甲醇,加入0.2 mL 5%香草醛-冰乙酸溶液以及0.8 mL高氯酸,摇匀后于56 ℃水浴下保温20 min,取出立即冰水冷却,再加入5 mL冰乙酸,摇匀,于波长547 nm处测定吸光度值,用甲醇溶解齐敦果酸标准品作为标准溶液绘制标准曲线,并计算样品中的皂苷含量。标准曲线方程:y=0.0072x-0.0144,R2=0.9962。
1.2.2.4 棉子糖含量的测定 准确称取5.0 g酸面团冻干样品,加入23.75 mL超纯水,混匀后以300 W功率超声20 min,加入50%(w/v)三氯乙酸(TCA)溶液1.25 mL,置于4 ℃冰箱中静置30 min,再于4 ℃、12000 r/min冷冻离心20 min,取上清液过0.22 μm微孔滤膜后,利用高效液相色谱仪测定样品中棉子糖的含量。HPLC条件[20]:XBridge BEH Amide柱(4.6 mm×250 mm,5 μm,美国沃特世);示差检测器;流动相为70%(v/v)乙腈,流速:1.0 mL/min;进样量:20 μL;柱温:30 ℃。使用棉子糖标准品配制标准溶液,根据标准溶液的浓度和样品测得的峰面积计算样品中的棉子糖含量。
1.2.3 酸面团发酵过程中α-淀粉酶酶活与α-氨基态氮含量的变化
1.2.3.1 酸面团中α-淀粉酶活力的测定 根据Wang等[21]的方法进行一些修改,使用DNS法测定酸面团中α-淀粉酶活力。称取1.0 g酸面团冻干样品,与20 mL去离子水振荡混匀,1000 r/min离心取上清液进行测定。酶活力定义为:在37 ℃下,淀粉酶每分钟水解淀粉产生1 mg葡萄糖所需要的酶量定义为1个酶活力单位。根据测得的葡萄糖含量计算出酸面团中的α-淀粉酶活力。
1.2.3.2 酸面团中α-氨基态氮的测定 使用改进的茚三酮法测定酸面团中α-氨基态氮含量,来表征酸面团中的蛋白酶活力情况。将1.0 g酸面团冻干样品与4 mL的7%高氯酸混合,并在4 ℃下保存1 h。8000 r/min离心10 min,取0.8 mL上清液,加入0.6 mL 0.43 mol/L KOH溶液以沉淀高氯酸,同样条件再次离心,上清液即为测定液。配制试剂I(1 L H2O,50 g Na2HPO4·2H2O,60 g KH2PO4,0.5 g茚三酮,3 g果糖,pH6.7)以及试剂Ⅱ(600 mL H2O,400 mL 96%乙醇,2 g KIO3)。取200 μL测定液,加入500 μL试剂I、950 μL去离子水,将混合物在100 ℃下水浴加热16 min,反应结束后冰浴冷却,再加入2.5 mL试剂Ⅱ,并在570 nm下测量样品的吸光度[22]。使用甘氨酸作为标准品绘制标准曲线。标准曲线方程:y=0.3134x+0.0177,R2=1。
1.2.4 酸面团发酵前后多肽分子量变化 准确称取1.0 g酸面团冻干样品,用乙腈∶水∶三氟乙酸=40∶60∶0.1 (v∶v∶v)充分溶解定容到50 mL,6000 r/min离心15 min取上清液过0.22 μm滤膜至液相进样瓶中。使用Waters 1525 EF高效液相色谱仪进行分析,HPLC条件[23]:体积排阻色谱柱TSKgel 2000SWXL(300 mm×7.8 mm,5 μm,日本东曹);流动相:乙腈∶水∶三氟乙酸=40∶60∶0.1 (v∶v∶v);紫外检测器:220 nm;流速:0.5 mL/min;柱温:30 ℃。
1.2.5 酸面团发酵过程中游离总酚及游离氨基酸含量的变化
1.2.5.1 酸面团发酵过程中游离总酚的测定 准确称取1.0 g酸面团冻干样品于离心管中,加入在70 ℃预热好的70%甲醇5 mL,充分混匀,放入70 ℃水浴锅中浸提20 min,每5 min摇匀一次,之后冷却至室温,6000 r/min下离心20 min,取上清液至10 mL容量瓶中,残渣再用5 mL 70%甲醇提取一次,重复操作,合并提取液定容至10 mL容量瓶中,摇匀待测,采用福林酚法[24],对提取液中的游离总酚含量进行测定。使用没食子酸绘制标准曲线,游离总酚含量以没食子酸当量计算。标准曲线方程:y=0.0053x+0.0115,R2=0.9987。
1.2.5.2 酸面团发酵过程中游离氨基酸的测定 准确称取1.0 g酸面团冻干样品于25 mL容量瓶中,用5%(w/v)三氯乙酸(TCA)定容,混匀后超声波超声1 h,双层滤纸过滤,滤液10000 r/min离心30 min,取上清液过0.22 μm水膜至色谱进样瓶中。使用Agilent 1100液相色谱仪进行分析。HPLC条件[25]:ODS Hypersil色谱柱(250 mm×4.6 mm,5 μm);流动相:醋酸钠∶甲醇∶乙腈=1∶2∶2 (v∶v∶v),流速1.0 mL/min,柱温:40 ℃;紫外检测器:338 nm。
1.2.6 红豆、扁豆酸面团馒头的制备以及淀粉、蛋白质体外消化率
1.2.6.1 馒头的制备 各组馒头的配方如表1所示。

表1 各组豆粉馒头配方
将原料小麦粉、豆粉/酸面团、水、糖以及酵母倒入搅拌刚中慢速搅拌4 min使面粉与水充分混合(提前将糖溶于水,酸面团组则提前溶于水和酸面团),加入起酥油再慢速搅拌1 min,之后快速搅打4 min至面团表面光滑,将面团揉圆后覆膜松弛5 min,用起酥机反复压片20~25次。切分面团40 g/个,整形搓圆后于38 ℃,85% RH醒发箱中醒发60 min,醒发好后大火蒸制15 min,关火后静置5 min,取出馒头室温下静置1 h,将馒头样品装在塑封袋中用1.2.1.3中所述的方法冻干后干燥保存,用于后续测定。
1.2.6.2 馒头中淀粉的体外消化率 准确称取馒头冻干样品1.0 g于锥形瓶中,加入15 mL pH5.2的磷酸盐缓冲液和7颗玻璃珠,模拟胃肠道的蠕动环境,在37 ℃水浴5 min。加入配制并预热好的混合酶液(α-淀粉酶和淀粉葡萄糖苷酶)5 mL,分别在加入酶液后的0、2、5、10、20、30、60、120、180 min取0.5 mL样品,加入4 mL 80%乙醇进行灭酶处理,然后8000 r/min离心10 min,用DNS法测定上清液中的葡萄糖含量,计算出淀粉的体外消化率[26]。
1.2.6.3 馒头中蛋白质的体外消化率 准确称取馒头冻干样品1.0 g于锥形瓶中,加入7颗玻璃珠,再加入配制好的胃蛋白酶溶液15 mL,于37 ℃下振荡摇匀进行酶解,取消化时间0、15、30、60、90、120 min的消化液0.5 mL。到120 min后,用0.5 mol/L NaOH将待测液pH调为7.0以钝化胃蛋白酶活性,然后加入胰蛋白酶溶液10 mL继续消化,同样在第0、30、60、90、120 min取消化液样品0.5 mL,取出的样品加入4 mL 10% TCA以灭酶并沉淀未被降解的大分子蛋白质,8000 r/min离心10 min取上清[27]。用BCA蛋白测定试剂盒测定上清液及完全酶解样品中的蛋白质浓度,并计算蛋白质的体外消化率,体外消化率(%)=上清液中的蛋白质浓度/样品中总蛋白质浓度×100。
1.3 数据处理
每次测试重复三次,采用Origin 9.0、Microsoft Office Excel 2013和SPSS 25.0对数据进行统计分析,利用方差分析法(ANOVA)对数据进行显著性分析,显著性差异水平取P<0.05。
2 结果与分析
2.1 酸面团的pH、总可滴定酸度(TTA)以及菌落数(CFU)
图1显示了乳酸菌D23在三种豆类基质的发酵过程中酸度以及菌落数的变化情况。由于乳酸菌在生长的过程中会释放大量乳酸、乙酸等有机酸[28],所以在发酵的过程中酸面团的pH逐渐降低,TTA逐渐升高(图1a),至发酵24 h时,红豆、扁豆酸面团的最终pH分别达到了4.34、4.16,最终TTA分别达到了21.0、23.8 mL,这与Curiel等研究者[13]在扁豆、鹰嘴豆、豌豆等豆类基质中的研究结果类似,其测定的豆类酸面团发酵24 h后pH为4.0~4.4,TTA范围为20.4~27.0 mL。由图1b可知,在发酵的过程中,菌株D23在红豆、扁豆酸面团中前0~4 h为对数生长期,4 h后进入了稳定生长期,在生长至24 h时菌落数分别增长到了7.83、7.88 lg CFU/g,保持稳定的生长状态。

图1 菌株D23分别在红豆、扁豆酸面团中的pH、TTA(a)与CFU(b)
2.2 酸面团发酵前后抗营养因子含量的变化
由表2可知,在两种豆类酸面团发酵后,缩合单宁、植酸、棉子糖、皂苷四种抗营养因子的含量都显示了不同程度的下降,其中红豆、扁豆的缩合单宁含量分别显著(P<0.05)下降了57.87%、53.54%,红豆酸面团中的降解程度更高,并且扁豆酸面团的降解效果优于Curiel等[13]使用植物乳杆菌和短乳杆菌发酵扁豆酸面团的研究结果。这可能与D23菌株能够在含有单宁的基质中产生单宁酶有关,其产生的单宁酰基水解酶可以将单宁类物质降解为小分子酚酸与多元醇,相比普通乳酸菌的发酵作用具有更显著的降解效果。其他三种抗营养因子的含量也都发生了显著(P<0.05)的下降,在红豆酸面团中,发酵前后植酸、棉子糖、皂苷的含量分别下降了8.04%、30.43%、11.91%,在扁豆酸面团中则分别下降了38.52%、35.14%、15.29%,这可能是由于酸面团的酸化作用,激活了豆类原料所携带的内原酶,如植酸酶、α-半乳糖苷酶等,并且酸面团中微生物代谢过程中也会在环境的诱导下产生这些酶类,在一定程度上降解了对应的抗营养因子[12]。总体上经过D23菌株的酸面团的发酵作用,红豆、扁豆这两类豆类基质中的抗营养因子水平,尤其是缩合单宁含量,出现了大幅的下降。
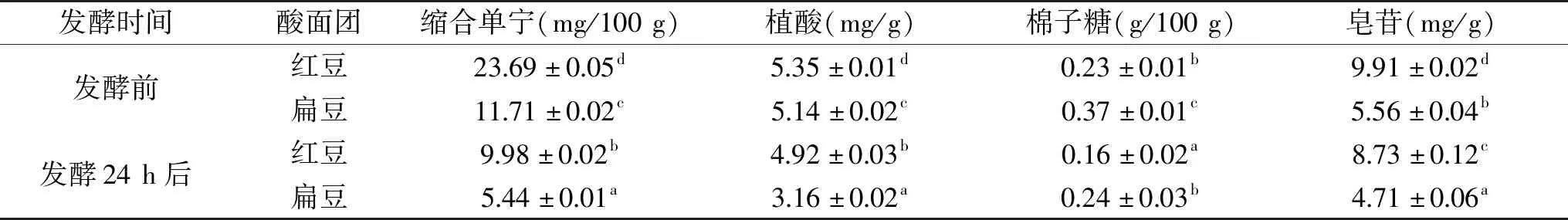
表2 酸面团发酵前后抗营养因子含量的变化
2.3 酸面团发酵过程中α-淀粉酶酶活与α-氨基态氮含量的变化
图2表示了酸面团发酵过程中α-淀粉酶活图2a与α-氨基态氮含量图2b的变化情况,从图2a中可以看出,在酸面团发酵过程中,两种豆类基质中的α-淀粉酶活力都呈现出了先增加后降低的趋势,在前4 h内,红豆和扁豆酸面团中的α-淀粉酶活力缓慢增加,与菌株的生长特性保持一致,4 h后开始快速增加,分别在16和12 h达到最高值,为2.25和1.22 U/g,随后逐渐降低。这是由于乳酸菌在生长的过程中产生的大量乳酸、乙酸等有机酸会激活豆类内源性α-淀粉酶活力[29],而缩合单宁等抗营养因子的降解也有助于α-淀粉酶活力的增加[7,13],使淀粉酶作用于淀粉分子生成低分子糊精、麦芽糖以及葡萄糖,同时菌株自身也会分泌淀粉酶,使整体的淀粉酶活力呈现增加的趋势,而随着发酵时间的延长,有机酸过多的积累反而会对α-淀粉酶的活力产生抑制的作用,所以在发酵后期酶活力逐渐降低。

图2 酸面团发酵过程中α-淀粉酶活(a)与α-氨基态氮含量(b)的变化
在图2b中,α-氨基态氮的含量变化可以反映酸面团中蛋白质的降解情况以及蛋白酶活力的变化,随着发酵时间的延长,红豆、扁豆酸面团中的α-氨基态氮含量都逐渐增加,分别从0 h的1.98、5.27 μmol/mL增加到24 h的5.29、11.51 μmol/mL。表明在整个发酵过程中,由低pH环境所激活的内源性蛋白酶[30]以及菌株自身分泌的蛋白酶一直在作用于酸面团中的蛋白质,将蛋白质降解为小分子多肽以及氨基酸,所以α-氨基态氮的含量不断上升。可以看出,由于红豆中的蛋白质含量较低,被水解的蛋白质较少,所以α-氨基态氮含量整体上低于扁豆酸面团。扁豆酸面团在发酵后期α-氨基态氮含量增加较快,说明此时其中的蛋白酶活力较高。
2.4 酸面团发酵前后多肽分子量分布
图3为红豆(a)、扁豆(b)酸面团发酵前后多肽分子量分布色谱图,其中保留时间最短、最先出峰的是分子量在20000 Da以上的大分子肽,肽分子量越小,保留时间越长,出峰也越晚,可以看出,两种豆类酸面团经发酵后,大分子量的肽含量都降低了,其中分子量在20000 Da以上的大分子肽含量在红豆、扁豆酸面团中分别从40.53%、31.37%降低到了30.75%、27.84%(表3),并且同时保留时间靠后的小分子肽含量也明显增加,如分子量小于300 Da的小分子肽含量在红豆酸面团中从52.31%增加到了59.45%,但扁豆酸面团中分子量300 Da以下的小肽含量却有略微降低,这可能是因为这些小分子肽在蛋白酶的作用下被进一步水解成了游离氨基酸。这与α-氨基态氮的测定结果相一致,即在豆类酸面团的发酵过程中,蛋白酶水解了部分蛋白质及大分子肽生成了更多小分子多肽,同时缩合单宁等可与蛋白酶结合的抗营养因子的降解也在一定程度上解除了其对蛋白酶活性的抑制[7],从而使蛋白酶能更好地作用于大分子蛋白质与多肽,将其降解为分子量较低的小肽以及游离氨基酸,有利于人体对这些营养物质的消化与吸收。

图3 红豆(a)、扁豆(b)酸面团发酵前后多肽分子量分布色谱图
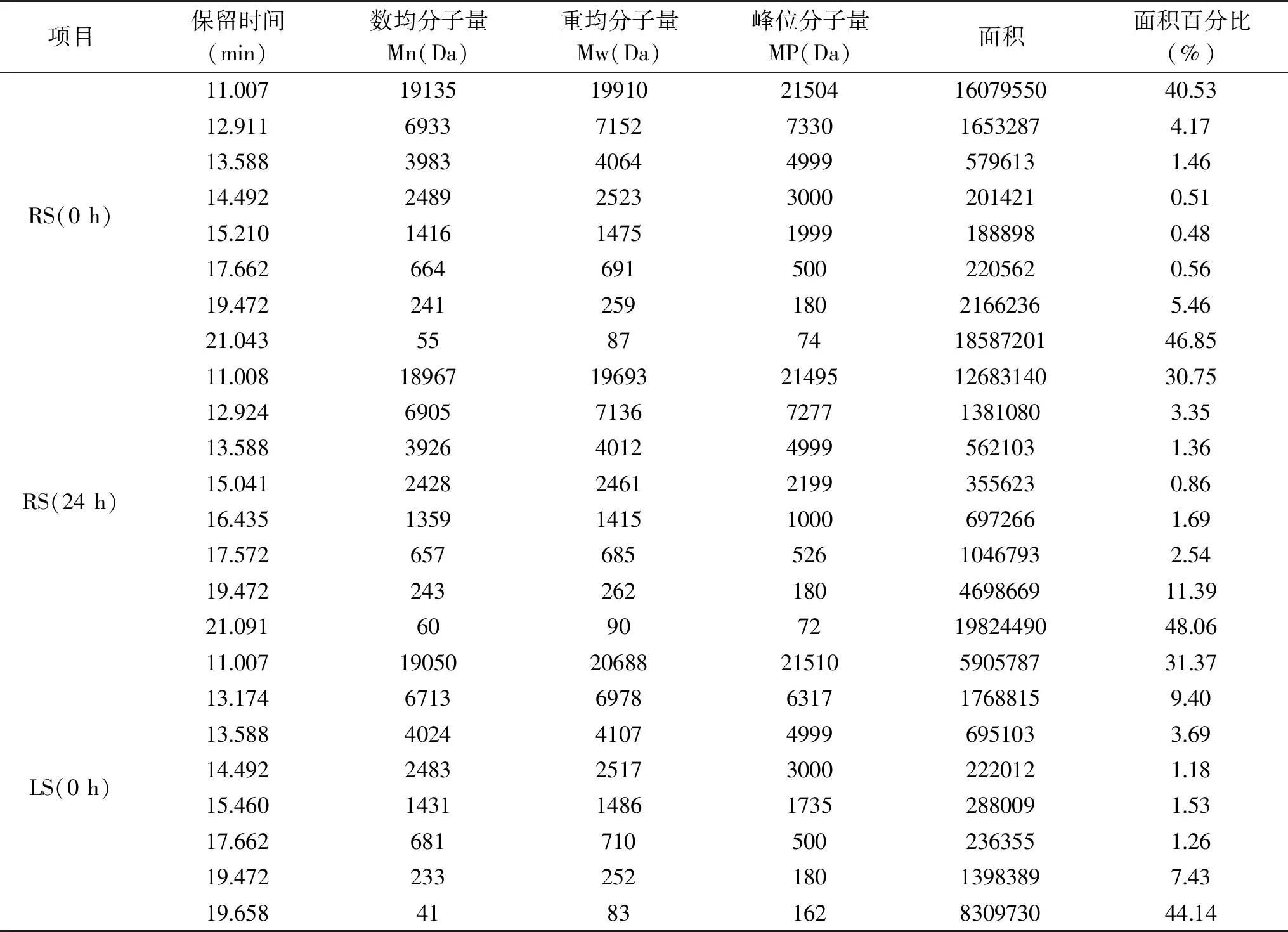
表3 红豆、扁豆酸面团发酵前后多肽分子量分布

续表
2.5 酸面团发酵过程中游离总酚及游离氨基酸含量
2.5.1 游离总酚含量 由图4可知,红豆中的游离总酚含量最高,其次是扁豆,并且两种酸面团中的游离总酚含量均随着发酵时间的延长逐渐增加,这与Coda等[31]研究人员的研究结果一致,发酵0 h,红豆与扁豆酸面团中的游离总酚含量分别为26.91、8.92 mg/g,发酵24 h时分别为47.28、14.81 mg/g,相比发酵前分别显著(P<0.05)增加了75.74%、65.94%,这可能与发酵过程中的酸性环境使得多酚类物质从结合的状态转变为游离的状态有关,并且单宁也属于一种酚类物质,在被单宁酶降解后可能会生成一些聚合度较低的小分子酚类物质,由聚合态转变为游离态[32],这也从侧面证明了单宁类物质的降解。此外,发酵过程也会破坏作物细胞膜的通透性,使酚类物质更容易游离出来[33]。
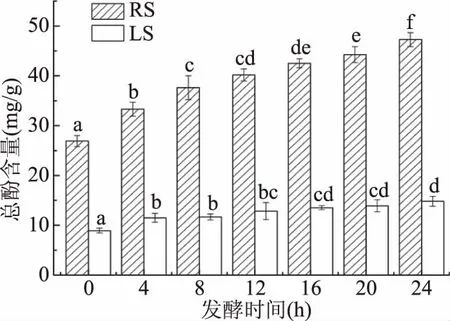
图4 酸面团发酵过程中游离总酚含量
2.5.2 游离氨基酸含量 在酸面团发酵的过程中,游离氨基酸作为微生物在谷物等基质中生长作用的一种代谢产物,对最终产品的风味、营养与感官品质都具有重要影响。从表4中可以看出,红豆、扁豆酸面团在发酵后,几乎所有的游离氨基酸的含量都发生了明显增加,总游离氨基酸含量分别从发酵前0 h的278.62、355.79 mg/100 g增加至24 h的691.92、788.21 mg/100 g,即分别增加为原来的2.48、2.22倍,其中7种必需氨基酸含量分别增加了429.31%、358.20%,在红豆酸面团中增加的比例更大。这表明通过D23菌株的发酵,都能够大幅增加这两种豆类的总游离氨基酸含量,提升必需氨基酸比例,使其营养更加丰富,有利于人体吸收。两种酸面团中氨基酸含量的差异可能与基质本身以及菌株在这两种基质中的代谢状况不同有关。此外,谷氨酸、甘氨酸、脯氨酸等氨基酸作为风味物质前体,其含量的增加会为最终馒头产品的风味带来积极影响,如脯氨酸在馒头蒸制过程中会与糖类发生美拉德反应带来焦糖味或奶甜味[34]。

表4 两种豆类酸面团发酵前后游离氨基酸含量
2.6 红豆、扁豆酸面团馒头的淀粉、蛋白质体外消化率
2.6.1 馒头的淀粉体外消化率 以测得整个消化过程中消化液还原糖含量的变化来表示淀粉的体外消化率,还原糖含量越多,代表淀粉消化率也就越高。从图5中可以看出,在消化初期(0~30 min)各馒头组别表现出一致的消化趋势,即淀粉迅速被消化液中的α-淀粉酶与淀粉葡萄糖苷酶水解,产生大量还原糖,淀粉的消化率呈现上升的趋势,但酸面团组具有更高的水解速率,其中红豆酸面团组的水解速率最高。并且从图5中可以看出,随着消化时间的延长,淀粉的消化速率逐渐放慢,趋于平缓,在180 min到达消化终点时,红豆、扁豆酸面团馒头消化液中的还原糖含量分别为6.00、6.09 mg/mL,相较于普通红豆、扁豆馒头的5.81、5.77 mg/mL,分别显著(P<0.05)增加了3.27%、5.55%,即获得了更高的最终淀粉体外消化率。这说明经酸面团发酵可以提高豆类馒头的淀粉体外消化率,使其更易被消化酶分解,有利于人体的消化与吸收。这可能是由于酸面团组经过了乳酸菌发酵作用,其中所含有的部分淀粉分子已经被酸面团中的内源性淀粉酶或者乳酸菌产生的α-淀粉酶作用过,由长链结构变成较短的分子结构[35],所以在经历体外消化时能够更快地被分解为葡萄糖等还原糖,提高其消化速率。此外,还可能是由于在不含酸面团的组别中,豆类中的单宁等抗营养因子,如缩合单宁,会与淀粉酶等消化酶结合[36],使其水解活力降低,进而降低消化率。而酸面团组的缩合单宁含量更低,故可以在一定程度上减小其对淀粉酶活力的影响,从而提高淀粉的体外消化率。
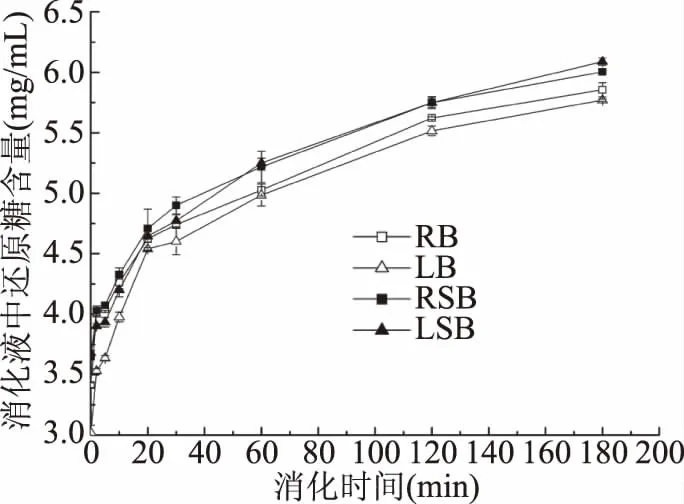
图5 不同组馒头的淀粉体外消化率曲线
2.6.2 馒头的蛋白质体外消化率 图6为通过两步酶解法测得的馒头的蛋白质体外消化率曲线,从图6中可以看出,四组馒头样品在消化的过程中整体上表现出一致的变化趋势,即在前120 min内,先由在酸性环境中具有活性的胃蛋白酶作用于样品中的蛋白质,切断肽链之间的肽键,将大分子的蛋白质降解为小分子的多肽[37],所以在0~30 min内蛋白质消化率迅速上升,随着时间的延长,水解产物逐渐增多,消化速度逐渐变缓,消化率达到约35%~45%,而120~240 min,则由加入的胰蛋白酶发挥蛋白水解作用,进一步将蛋白质降解为小肽以及氨基酸,蛋白质消化率又呈现出上升的趋势,最终达到65%~80%。从图6中可以看出,消化速率最快的为扁豆酸面团组,红豆酸面团组与扁豆空白团组的变化较为接近。扁豆酸面团组在两个消化阶段都表现出了较快的水解速率,而红豆酸面团组在胃蛋白酶消化阶段水解较快,在胰蛋白酶消化阶段则较为缓慢。整体上观察,相比于不添加酸面团制作的豆类馒头,酸面团馒头组都具有对应更快的蛋白质消化速度,并且最终体外消化率显著(P<0.05)增加(红豆、扁豆组分别为67.68%、70.21%,对应酸面团组分别为73.21%、76.97%)。这一方面可能与酸面团组中抗营养因子缩合单宁等的降解有关,已有研究表明,单宁可以降低豆类、谷物等作物中蛋白质的体外消化率,如Charlene等[38]发现绿豆中的缩合单宁会降低绿豆种子的蛋白质体外消化率,Kristen等[39]的研究也表明高粱缩合单宁与小麦谷蛋白会发生明显的相互作用,导致最终产品蛋白质消化率降低。Marisela等[40]也将发酵豆类蛋白质消化率的提升主要归因于单宁的微生物降解。另一方面,则是在酸面团发酵的过程中已将部分蛋白质降解为多肽及氨基酸,从而提高了在消化过程中的蛋白水解速率,对最终的消化率产生积极影响。
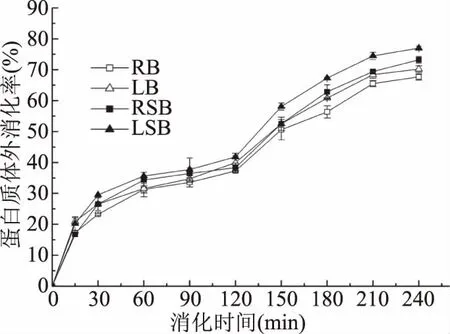
图6 不同组馒头的蛋白质体外消化率曲线
3 结论
本研究利用一株高产单宁酶的发酵乳杆菌对D23分别发酵红豆、扁豆酸面团并制备馒头,通过该株菌的发酵作用,两种豆类酸面团中缩合单宁含量显著下降(P<0.05),在红豆、扁豆酸面团中分别降低了57.87%、53.54%;大分子量多肽在蛋白酶的作用下被降解为更易吸收利用的小分子量多肽;同时游离总酚含量分别升高了75.74%、65.94%;必需氨基酸含量增加了429.31%、358.20%;并且酸面团发酵的红豆、扁豆馒头最终消化液中还原糖含量分别增加了3.27%、5.55%,淀粉的体外消化率得到了提升,同时蛋白质的最终体外消化率也分别由67.68%、70.21%增加为73.21%、76.97%。因此,该株具有单宁酶活力的乳酸菌可以通过酸面团的发酵作用有效降低豆类酸面团中缩合单宁等抗营养因子带来的不利影响,提升包括必需氨基酸在内的游离氨基酸含量,并且对最终产品的淀粉与蛋白质体外消化率带来有利影响,提升其营养价值,可以作为一种天然的功能配料应用于豆类产品的制作。
