芋头水溶性多糖的分离纯化及其对巨噬细胞免疫活性功能的影响
2020-10-23苏颖杰蓝伟杰马二兰
康 庆,林 莹,苏颖杰,蓝伟杰,黄 婷,马二兰
(广西大学轻工与食品工程学院,广西南宁 530004)
芋头(ColocasiaesculentaL. Schott,Taro)是芋头属天南星科多年生草本植物,古名蹲鸱,又称芋艿、毛芋[1]。芋头是良好的碳水化合物来源,营养物质丰富,膳食纤维含量高[2-4],不仅可以食用还可以药用,自古就以其疗效而闻名,具有宽肠胃、补脾胃、腹中癖块、消痨散结等作用[5]。有研究认为,芋头的生物功效与其含有的花青素、血凝素、水溶性多糖、蛋白质、凝集素等活性成分有关[6]。多糖是由10个以上单糖单位通过糖苷键连接的天然高分子化合物,广泛存在于自然界,具有多种生物活性,研究较多的包括免疫调节、抗氧化、降血糖以及对肠道菌群的调节作用[7]。
提取水溶性的多糖一般以水提醇沉为主,有时为了提高多糖得率会辅以物理、化学或生物方法,如超声、微波和酶法辅助。这些辅助手段或多或少地改变多糖的理化性质和功能性质[8],为尽可能避免芋头水溶性多糖的天然性质发生改变,本文选用传统的提取方法——水提醇沉。目前已有研究证明,芋头水溶性多糖具有抗氧化、降脂和免疫调节的功效[9-11],但对芋头水溶性多糖系统地分析,研究芋头水溶性多糖各组分的免疫活性高低以及在发挥生物学活性时作用方式的差别还不足。
本实验通过热水浸提的方式得到芋头水溶性多糖,利用DEAE-52离子纤维素柱层析和sephadexG-200凝胶柱层析对芋头水溶性粗多糖进行分离纯化,并对其组成和结构进行初步分析,研究其对巨噬细胞RAW264.7的免疫调节作用,通过比较不同组分芋头水溶性多糖在结构以及免疫活性的差异,初步判定不同的芋头水溶性多糖在免疫活性调节中的活性高低和主要作用方式,为提高芋头资源的食用及商业价值及其产品的开发提供理论依据。
1 材料与方法
1.1 材料与仪器
芋头 南宁百货超市;半乳糖醛酸标品 上海麦克林生化科技有限公司;以上试剂均为分析纯级;脂多糖(LPS,来自大肠杆菌055:B5)、0.1%中性红染色液、NO含量检测试剂盒 北京索莱宝科技有限公司;RAW264.7 中国科学院典型培养物保藏委员会细胞库;高糖DMEM(含丙酮酸钠)培养基 比利时BI公司;胎牛血清(FBS) 浙江天杭生物科技股份有限公司;CCK-8试剂盒 新赛美生物科技有限公司;TNF-α及IL-1βELISA试剂盒 南京翼飞雪生物科技有限公司。
InfiniteM200pro酶标仪 奥地利TECAN公司;层析柱(1.6 cm×70 cm) 上海沪西分析仪器厂有限公司;TENSOR Ⅱ傅里叶红外光谱仪 德国BRUKER公司;二氧化碳细胞培养箱 德国BINDER公司;CKX41SF倒置显微镜 日本OLYMPUS公司。
1.2 芋头水溶性多糖的提取和成分测定
1.2.1 芋头水溶性粗多糖的提取 参照姜绍通等[12]的方法略有改动。以芋头冻干粉为原料,按30∶1 (mL∶g)料液比沸水浴2 h后取上清液,45 ℃旋转蒸发浓缩之后利用Sevage法除蛋白(重复两次),后80%乙醇浓度沉降得芋头粗多糖,冻干得粉末状粗多糖。其得率按下式计算:
芋头水溶性多糖得率(%)=芋头水溶性多糖冻干粉质量(mg)/芋头冻干粉质量(mg)×100
1.2.2 芋头水溶性粗多糖的成分测定
1.2.2.1 水分的测定 根据GB 5009.3-2016测定芋头水溶性粗多糖中的水分含量。
1.2.2.2 多糖含量的测定 参考姜琼等[13]优化后的苯酚-硫酸法略有改动。绘制葡萄糖标准曲线:取洁净具塞试管7支,并编号1~7。依次加入0、0.2、0.4、0.6、0.8、1.0、1.2 mL葡萄糖标准溶液(0.1 mg/mL),再加入蒸馏水至2 mL。于每支试管中加入1 mL 5%苯酚溶液并摇匀,然后加入5 mL浓硫酸,沸水浴5 min,冷却至室温后在490 nm下测吸光度值。以葡萄糖浓度为横坐标,吸光度值为纵坐标绘制葡萄糖标准曲线。
准确称取芋头粗多糖粉末10 mg,溶于10 mL蒸馏水,过0.45 μm滤膜后取1 mL加入具塞试管,补充蒸馏水至2 mL,再加入1 mL 5%苯酚溶液,摇匀后加入5 mL浓硫酸,沸水浴5 min后冷却至室温测定490 nm处吸光度值。以蒸馏水做空白对照。
1.2.2.3 蛋白质含量的测定 采用考马斯亮蓝法,测定芋头粗多糖中蛋白质含量。绘制牛血清蛋白标准曲线:取洁净试管7支,并编号1~7。依次加入0、0.1、0.2、0.3、0.4、0.5、0.6 mL牛血清蛋白标准溶液后加蒸馏水补充至1 mL,加入5 mL考马斯亮蓝溶液,显色5 min后在595 nm处测其吸光度。以牛血清蛋白浓度为横坐标,吸光度值为纵坐标绘制牛血清蛋白标准曲线。
准确称取芋头粗多糖粉末10 mg,溶于10 mL蒸馏水,过0.45 μm滤膜后取1 mL加入试管中,然后加入5 mL考马斯亮蓝溶液,静置显色5 min于595 nm处测吸光度值。以蒸馏水做空白对照。
1.2.2.4 糖醛酸含量的测定 采用间羟基联苯法[14],测定芋头粗多糖中糖醛酸含量。绘制半乳糖醛酸标准曲线:取洁净具塞试管6支,并编号1~6。依次加入0、0.1、0.2、0.3、0.4、0.5 mL半乳糖醛酸标准溶液(80 μg/mL),补充蒸馏水至0.5 mL。冰浴条件下,于每管中加入5 mL硼砂-浓硫酸溶液(4.77 mg/mL),摇匀后于沸水浴中加热5 min。加热结束后继续冰浴至室温,加入0.1 mL间羟基联苯氢氧化钠溶液(0.15 g间羟基联苯溶于100 mL 0.5%氢氧化钠溶液)显色后,520 nm处测吸光值。以半乳糖醛酸浓度为横坐标,吸光度值为纵坐标绘制半乳糖醛酸标准曲线。
准确称取芋头粗多糖粉末10 mg,溶于10 mL蒸馏水,过0.45 μm滤膜后取0.5 mL加入试管中,冰浴条件下加入5 mL硼砂-浓硫酸溶液,摇匀后沸水浴5 min。冰浴下冷却至室温加入间羟基联苯氢氧化钠溶液显色,于520 nm处测得吸光度值。以蒸馏水做空白对照。
1.3 芋头水溶性多糖的分离纯化与鉴定
1.3.1 芋头水溶性粗多糖的DEAE-52阴离子交换柱层析 准确称取200 mg芋头水溶性粗多糖,溶于10 mL超纯水中,经0.45 μm滤膜和超声脱气处理后取10 mL样品溶液上柱(1.6 cm×70 cm)。经前期预实验确定洗脱条件为:洗脱速度为0.6 mL/min,每5 min收集1管。依次以超纯水和0.1、0.2、0.3、0.4 mol/L的NaCl溶液进行洗脱,期间用苯酚-硫酸法测定各管总糖含量,以管数为横坐标,490 nm处测得的吸光度值为纵坐标作图。根据洗脱峰的强度,收集主要组分。然后45 ℃条件下旋转浓缩,将浓缩液置于截留分子量为3.5 kDa的透析袋中透析36 h,期间定时更换蒸馏水,最后经冷冻干燥后得芋头多糖组分粉末。
1.3.2 Sephadex G-200凝胶柱层析 分别称取50 mg在1.3.1中的主要多糖组分,溶于0.02 mol/L NaCl溶液。经0.45 μm滤膜和超声脱气处理后取5 mL样品溶液上柱(1.6 cm×70 cm)。洗脱条件:洗脱液选用0.02 mol/L NaCl溶液,流速为0.2 mL/min,每30 min收集1管。用苯酚-硫酸法测定各管总糖含量,以管数为横坐标,490 nm处测得的吸光度值为纵坐标作图。
1.3.3 SDS-聚丙烯酰胺凝胶电泳 将1.3.1得到的芋头水溶性多糖组分配制成1 mg/mL的溶液,采用SDS-PAGE不连续缓冲系统进行电泳。电泳条件:浓缩胶中电流40 mA、电压80 V;分离胶中电流80 mA、电压120 V。电泳完成后,凝胶采用考马斯亮蓝法染色,染色后于快速脱色液中脱色20 min,转入常规脱色液中脱色,最后利用Scion Image软件拍照分析。
1.3.4 傅里叶红外光谱测定 利用常规方法,准确称取1.3.1得到的芋头水溶性多糖组分各5 mg,分别与500 mg溴化钾混合均匀,并研磨成细小颗粒,做压片处理后在红外4000~400 cm-1波段内进行扫描。
1.4 芋头水溶性多糖对巨噬细胞RAW264.7的免疫调节作用
1.4.1 芋头水溶性多糖对RAW264.7增殖作用的影响 将RAW264.7调整浓度为5×104个/mL,接种到96孔板中,37 ℃、5% CO2条件下常规培养4 h后,用100 μL不同浓度(25、50、100、200、400 μg/mL)芋头水溶性多糖组分处理RAW264.7,同时设定空白对照组和阳性对照组,每组设6个复孔。目前,在免疫细胞实验中多以脂多糖(LPS)[15]作阳性对照,本实验以相同体积的细胞培养液为空白对照。另,由于1 μg/mL脂多糖不仅对巨噬细胞活性无影响[16],且对细胞因子和NO的分泌综合效果较好[17],决定以1 μg/mL LPS为阳性对照。参考Chen等[18]的方法,稍作改进。培养2 h后向每孔加入10 μL CCK-8试剂,培养箱中继续反应2 h后利用酶标仪测定450 nm处的吸光度值。用细胞存活率衡量增殖作用,计算公式如下:

式中,AS为处理组和阳性对照组吸光度值;AO为空白对照组吸光度值。
1.4.2 芋头水溶性多糖对RAW264.7吞噬作用的影响 利用RAW264.7吞噬中性红的能力衡量其吞噬能力。按1.4.1的方法进行培养和分组。参考Tang等[19]的方法,加入不同浓度(25、50、100、200、400 μg/mL)芋头水溶性多糖组分继续培养12 h后用100 μL 0.1%中性红试剂替换,作用4 h后完全去除,加入细胞裂解液(乙醇∶冰乙酸(v/v)=1∶1)在室温下作用30 min后利用酶标仪测定540 nm处的吸光度值。吞噬活性用吞噬指数(PI)表示,计算公式如下:
式中,AS为添加芋头水溶性多糖和脂多糖组的吸光度值;AO为空白对照组吸光度值。
1.4.3 芋头水溶性多糖对RAW264.7的NO分泌量的影响 按1.4.1的方法进行培养和分组后继续培养12 h,取细胞培养上清液,1000 r/min离心5 min去掉不溶物后按试剂盒操作说明,加入等体积的Griess试剂Ⅰ和Griess试剂Ⅱ,室温静置反应15 min,于96孔板测定550 nm处的吸光度值。
1.4.4 芋头水溶性多糖对RAW264.7的TNF-α和IL-1β分泌量的影响 按1.4.3的方法获得各组细胞上清液后,按TNF-α及IL-1βELISA试剂盒的操作说明进行。
1.5 数据处理
每个实验设6个平行,采用SPSS 22.0软件进行数据处理及分析,Origin 9.0绘图。
2 结果与分析
2.1 芋头水溶性粗多糖的组分测定
按1.2.1的方法得到芋头水溶性粗多糖,得率为3.19%。Li等[6]在热水浸提的基础上,辅以微波处理后得到芋头粗多糖的得率为4.12%,虽提高了多糖得率,但Li所获得的芋头多糖分子量均在10 kDa左右,远远低于Park等[11]通过水提法得到的分子量为200 kDa的芋头多糖,这可能是由于微波处理使多糖分子降解。为尽可能保持芋头水溶性多糖本来的结构,保留其天然性质,本文选择以相对温和常规水提法进行实验。按照1.2.2方法得到葡萄糖、牛血清蛋白和半乳糖醛酸标准曲线回归方程分别为:y=15.03x-0.1098,R2=0.997;y=0.0041x+0.0188,R2=0.9934;y=8.6x-0.003,R2=0.9937。据此测得的芋头水溶性粗多糖组分含量如表1所示。芋头粗多糖中主要成分为多糖,含量达到61%,糖醛酸含量约为13%,说明其中含有酸性多糖。样品中依然含有少量蛋白质,这部分蛋白可能是与多糖结合形成了聚合物,也可能是蛋白杂质。另因南宁回南天,空气湿度高,高达90%以上,导致样品易吸潮,故样品水分含量较高,占16%。

表1 芋头水溶性粗多糖化学组成
2.2 芋头水溶性多糖的纯化和鉴定
2.2.1 芋头水溶性粗多糖的DEAE-52阴离子交换柱层析 前期实验发现DEAE-52纤维素对多糖具有显著吸附作用,在1 h内可有效吸附多糖,故选用DEAE-52进行阴离子交换柱层析,得到洗脱曲线如图1所示。芋头水溶性粗多糖经超纯水和不同浓度的NaCl溶液梯度洗脱后得到四个洗脱峰,如图1所示。相比Li等[6]的分离结果,本实验多得到一个0.3 mol/L NaCl洗脱组分。其中超纯水洗脱组分有最强的吸收峰,说明芋头水溶性多糖中主要为中性多糖,命名为TPS1。其次为0.1 mol/L NaCl溶液洗脱得到的酸性多糖组分,命名为TPS2。收集两种主要组分,浓缩并透析脱盐后进行冷冻干燥,得到两种白色多糖粉末,得率分别为53.28%和39.84%,纯度分别为87.4%和81.5%,高于姜绍通等[12]相同洗脱组分的82%和68%。符合预期实验设想,可进行后续实验操作。
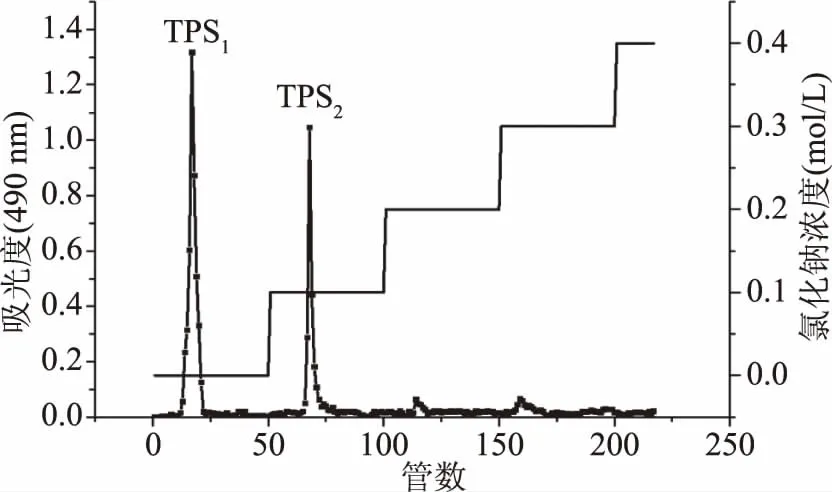
图1 芋头水溶性多糖的洗脱曲线
2.2.2 芋头水溶性多糖主要洗脱组分的Sephadex G-200凝胶柱层析 凝胶具有一定大小的孔径,起到分子筛的作用。大分子优先流出,而小分子滞后流出,从而将不同分子量大小的多糖分离开。经DEAE52-纤维素纯化后得到的两种主要多糖组分TPS1和TPS2,进一步经过SephadexG-200凝胶柱,均得到单一洗脱峰,如图2所示。故初步认为TPS1和TPS2为单一组分[20-21]。
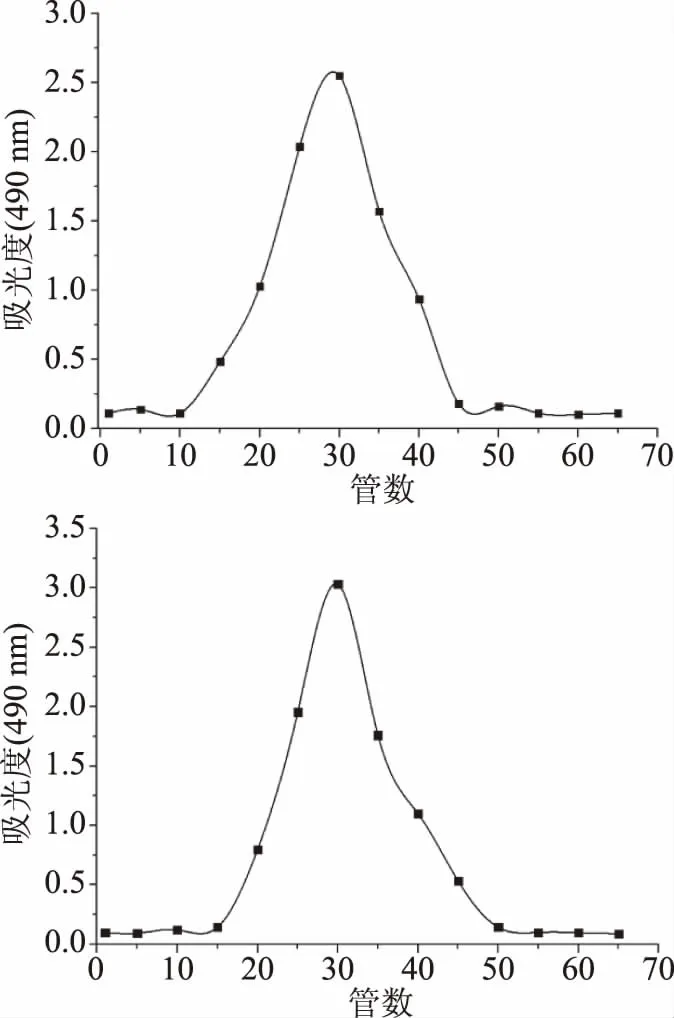
图2 TPS1和TPS2的Sephadex G-200 凝胶柱洗脱曲线
2.2.3 芋头水溶性多糖组分的鉴定
2.2.3.1 SDS-聚丙烯酰胺凝胶电泳 图3电泳图显示,通过DEAE52-纤维素离子交换树脂后得到的TPS1和TPS2中的蛋白含量明显减少,小分子量的蛋白基本去除。48 kDa左右的蛋白在TPS1和TPS2中依然存在。另外,与超纯水洗脱出来的TPS1相比较,0.1 mol/L NaCl溶液洗脱出的TPS2中依然含有63~75 kDa的蛋白。另,SephadexG-200凝胶柱层析结果显示TPS1和TPS2为单一多糖,故认为TPS1和TPS2可能是含有少量蛋白的多糖蛋白复合物。
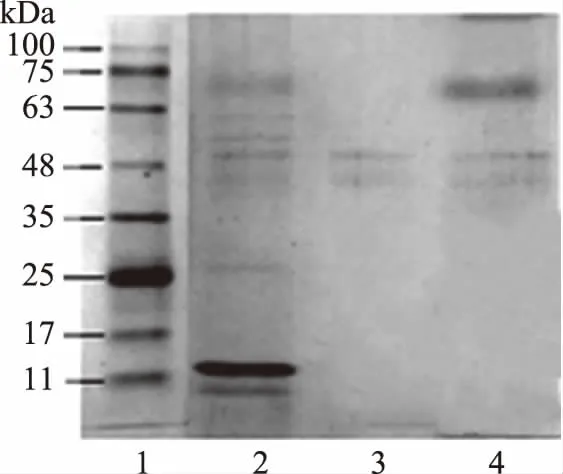
图3 芋头水溶性多糖组分的电泳图
2.2.3.2 红外光谱分析 TPS1和TPS2的红外光谱分析图如图4所示,二者均在3404 cm-1附近处出现宽而强的吸收峰,此为O-H伸缩振动峰,在2928.53和2934.17 cm-1处出现相对较弱的特征吸收峰,为C-H伸缩振动峰。以上区域出现的吸收峰是糖类化合物的特征吸收峰[22-23]。1600 cm-1附近分别出现一弱一强的吸收峰(TPS1:1639.18 cm-1;TPS2:1642.95 cm-1),由羧基的C=O的非对称和对称伸缩振动引起,初步表明TPS2含有大量的糖醛酸。TPS2在1542.55 cm-1处出现一个较强的吸收峰,为H-N-C=O。TPS2在1237.62 cm-1处出现较强的吸收峰为S=O的伸缩振动峰,表明TPS2为一种硫酸多糖。吡喃糖在1100~1010 cm-1范围内有三个强吸收峰,呋喃糖在该区域出现两个较强吸收峰[24]。TPS1在1078.98和1025.14 cm-1,以及TPS2在1078.68和1032.60 cm-1出现吸收峰二者都含有呋喃糖环。TPS1在935.74 cm-1处出现的吸收峰表明其中可能存在甘露糖。TPS1在855.80、762.70 cm-1处的吸收峰被认为是由α-吡喃环对称伸缩振动引起的[22,25]。TPS2在878.37 cm-1处为β-构型多糖的特征吸收峰[26]。综上,TPS1中单糖组分可能有甘露糖,且同时存在α-吡喃环和呋喃环,TPS2中含有大量糖醛酸和少量蛋白,组成单糖为呋喃糖,成苷的半缩醛羟基主要为β-构型。
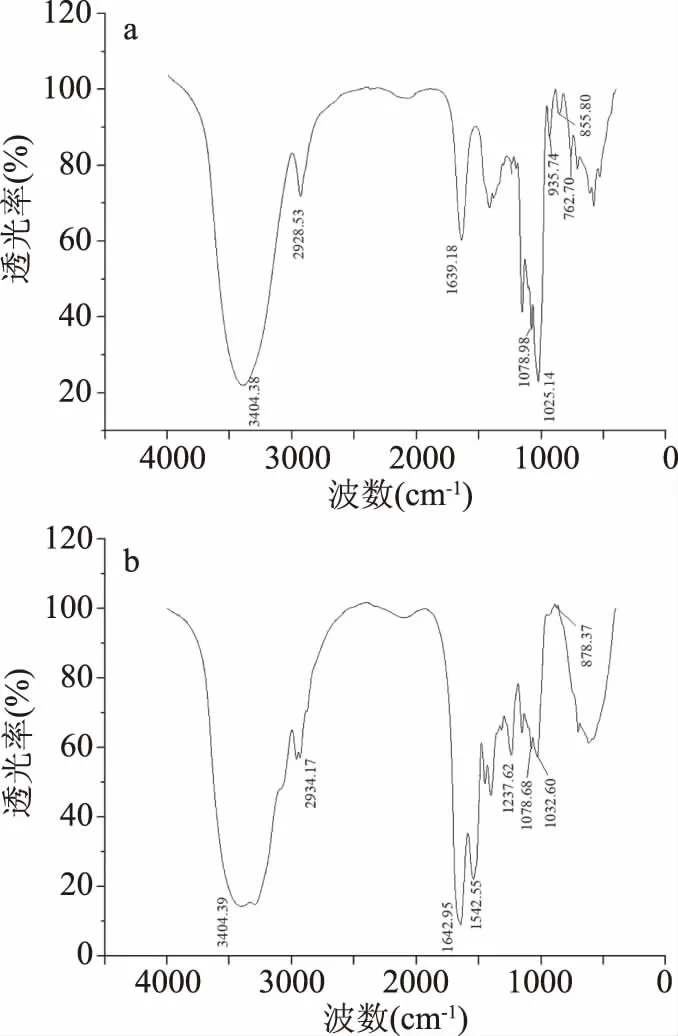
图4 TPS1(a)和TPS2(b)的红外吸收光谱图
2.3 芋头水溶性多糖组分对巨噬细胞RAW264.7的影响
2.3.1 芋头水溶性多糖对RAW264.7增殖活性的影响 巨噬细胞作为免疫系统中重要的免疫调节细胞,其功能正常与否直接或间接关系到免疫应答过程中的抗原呈递和抗原清除等能力。表2表明实验浓度范围内的TPS1和TPS2对巨噬细胞增殖无毒害作用,TPS1和TPS2均可显著(P<0.05)提高该细胞的增殖活力,可用于后续实验开展。当TPS1和TPS2的浓度分别为50和100 μg/mL时,细胞存活率最高可达到120.33%和129.00%,在空白对照组的基础上可分别增加20.33%和29.00%,TPS1和TPS2的促增殖作用并不依赖于浓度大小,具体机制还有待进一步讨论。另,同一浓度下,TPS2的促增殖能力均优于TPS1。
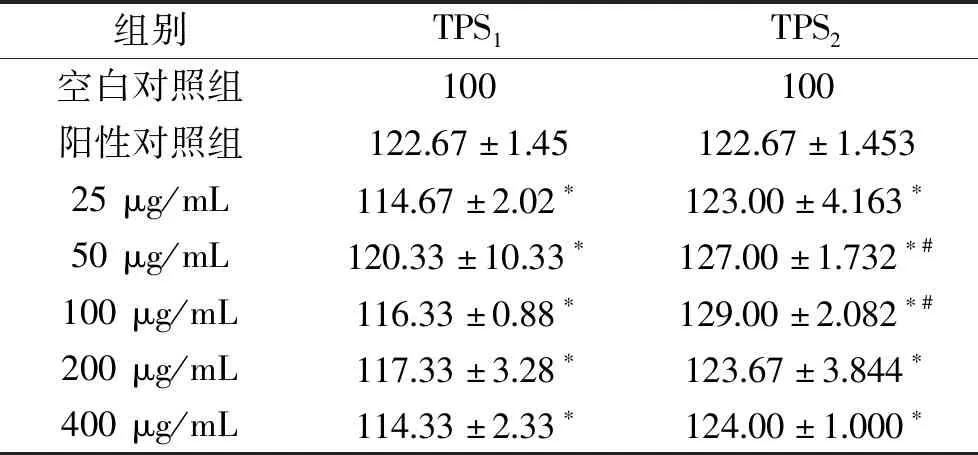
表2 TPS1和TPS2对RAW264.7细胞存活率的影响(%)
2.3.2 芋头水溶性多糖对RAW264.7吞噬活性的影响 吞噬功能是巨噬细胞基础功能之一,吞噬活性增加被认为是巨噬细胞活化的标志[27]。表3表明TPS1在整个实验浓度范围内能够显著(P<0.05)促进RAW264.7吞噬能力,浓度为200 μg/mL时,细胞吞噬指数最高为2.07,为空白对照组的2.07倍,且显著(P<0.05)高于LPS处理下的RAW264.7吞噬活性(1.86);TPS2在中低浓度(25~100 μg/mL)能够显著(P<0.05)提高吞噬能力,且与浓度呈正相关,表现出浓度依赖关系,在浓度为100 μg/mL时有最大促进作用,吞噬指数为1.57,为空白对照组的1.57倍,但弱于阳性对照组。当TPS2浓度进一步增大至200、400 μg/mL,吞噬活性迅速降低,略低于空白对照组,但差异并不显著(P>0.05)。分析原因可能是TPS2浓度过大影响了细胞渗透压,导致吞噬活性降低。Li等[6]在对芋头多糖的促吞噬作用进行研究时,忽略了超纯水洗脱组分(即中性多糖的作用,也就是本文中的TPS1),而仅仅证明了0.1 mol/L NaCl洗脱组分(即酸性多糖,也就是本文中TPS2)的促吞噬作用,缺乏对中性多糖和酸性多糖的促吞噬能力的比较分析。本实验同时对TPS1和TPS2的促吞噬作用进行研究,各浓度的TPS1处理下的吞噬活性均与空白对照组有显著性差异(P<0.05);相比之下的TPS2仅在中低浓度(25~100 μg/mL)时表现出显著的(P<0.05)促进作用,其余浓度组分与空白对照组均无显著性差异。综上看来,中性多糖TPS1较之酸性多糖TPS2表现出更强的促吞噬活性,这可能是因为TPS1中含有的甘露糖,易于与巨噬细胞表面的甘露糖受体结合从而促进吞噬作用[28]。

表3 TPS1和TPS2对RAW264.7吞噬指数(PI)的影响
2.3.3 芋头水溶性多糖对RAW264.7合成NO能力的影响 表4表明TPS1和TPS2均能促进RAW264.7分泌NO。NO分泌量随着TPS1浓度的增大而显著增加(P<0.05),表现出浓度依赖关系,TPS1浓度为200 μg/mL时有最大分泌量26.98 μmol/L,为空白对照组的3.07倍,但仍低于阳性对照组。TPS2的促进作用呈现先增大后降低的趋势,存在最佳作用浓度100 μg/mL,此时的NO分泌量达40.14 μmol/L,为空白对照组的4.57倍,且极显著(P<0.01)高于阳性对照组。当TPS2浓度进一步增大,NO分泌量虽有降低但仍优于TPS1的促进作用,且显著(P<0.05)高于空白对照组,这说明TPS2在合适的浓度下可发挥出最优的促NO分泌作用,一旦浓度过高,TPS2将以不同的机制对巨噬细胞产生影响,导致NO分泌量降低,这还有待进一步的研究。与促进吞噬作用不同,同一浓度下,TPS1刺激巨噬细胞分泌NO的能力弱于TPS2,这将TPS1和TPS2二者在免疫活性调节作用上区分开,这可能与前文提到的TPS2中含有糖醛酸和硫酸基有关。Huang等[29]提出含有硫酸基的植物多糖更有利于巨噬细胞分泌NO、TNF-α和IL-1等细胞因子。

表4 TPS1和TPS2对RAW264.7分泌NO的影响(μmol/L)
2.3.4 芋头水溶性多糖对RAW264.7分泌细胞因子的影响 细胞因子作为免疫系统中细胞与细胞间相互作用的信号分子,起着重要的作用。TNF-α可杀死或抑制肿瘤细胞[30],能够加强免疫反应并诱导其它免疫因子的分泌[31];IL-1β可进一步激活巨噬细胞,可参与抗体产生。它们的分泌量可直接反映免疫功能状况。
表5和表6表明大于25 μg/mL的TPS1和TPS2能不同程度地提高RAW264.7分泌TNF-α和IL-1β的能力。在TPS1的浓度为50 μg/mL时,TNF-α达到最大分泌量287.10 ng/L,为空白对照组的3.04倍;TPS1浓度为400 μg/mL时,IL-1β分泌量最大,可增至空白对照组的1.37倍,分泌量为18.92 ng/L。TPS2的浓度为200 μg/mL时,TNF-α分泌量为空白对照组的3.76倍,达到355.33 ng/L;TPS2浓度为100 μg/mL时IL-1β有最大分泌量21.32 ng/L,为空白对照组的1.54倍。在TPS1和TPS2两种芋头水溶性多糖的作用下,TNF-α的提高程度大于IL-1β。相比于TPS1,TPS2对细胞因子的促进作用更大,这与前文提到的TPS2中含有较高含量的糖醛酸和硫酸基有关。有研究表明糖醛酸含量显著影响酸性多糖的免疫调节活性,糖醛酸含量越高,对细胞因子的促进作用越强[32]。另,硫酸基的存在能够改变多糖的空间位阻和静电斥力,提高水溶性[33],使得多糖更容易与巨噬细胞的受体蛋白结合,激活下游信号通路,提高NO及细胞因子的分泌。
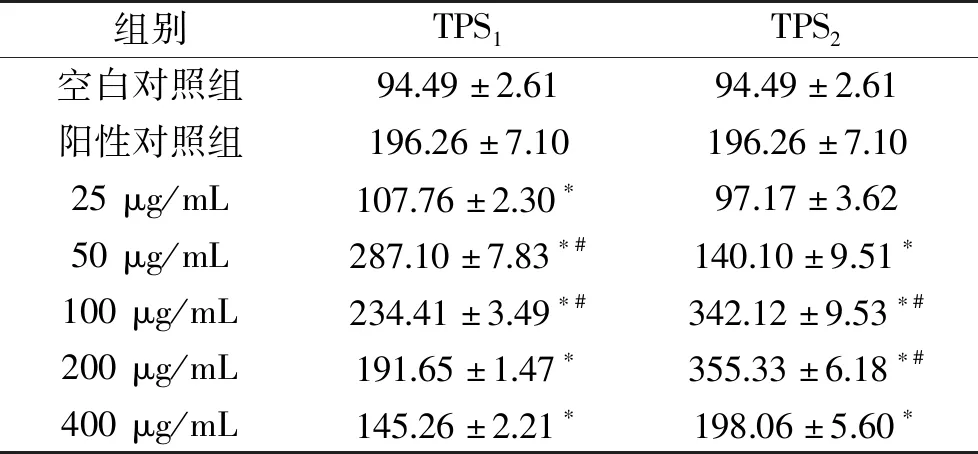
表5 TPS1和TPS2对RAW264.7分泌TNF-α的影响(ng/L)
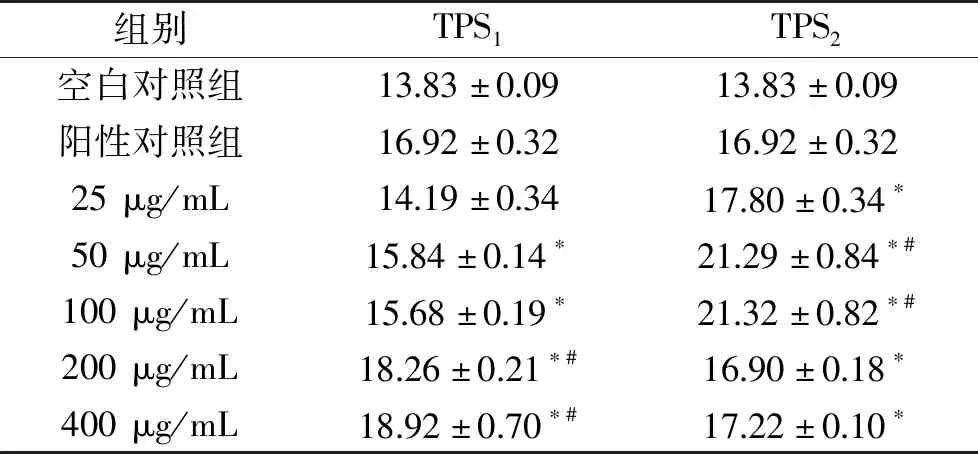
表6 TPS1和TPS2对RAW264.7分泌IL-1β的影响(ng/L)
3 结论
本文通过DEAE-52柱层析得到两种新的芋头水溶性多糖TPS1和TPS2,Sephadex G-200和SDS-PAGE共同表明TPS1为一种含有甘露糖的α构型中性多糖-蛋白复合物,TPS2为含有硫酸基团和大量糖醛酸的β构型酸性多糖-蛋白复合物。体外实验评估发现TPS1和TPS2都可提高巨噬细胞吞噬能力,并促进NO、TNF-α和IL-1β等细胞因子的分泌。综合比较发现,TPS1对吞噬活性的促进作用优于对NO、细胞因子的促进作用,而TPS2具有相反的效应。这与二者在组成和结构的差异有关。TPS1在935.74 cm-1处出现的吸收峰初步表明其中含有甘露糖,推测易与巨噬细胞甘露糖受体结合,促进吞噬作用;TPS2中在1642.95和1237.62 cm-1处出现吸收峰,表明其含有大量的糖醛酸和硫酸基团,这使得它的空间位阻以及静电斥力发生变化,利于TPS2与巨噬细胞的蛋白受体结合,激活下游信号通路,促进NO和细胞因子的分泌;其系统完整的构效关系还有待进一步研究。综上,TPS1和TPS2都可作为免疫调节剂添加到功能性食品中,为新型的芋头产品的研发提高理论依据,进而提高芋头的食用及商业价值。
