莱茵衣藻三基因共调控油脂积累研究
2020-10-23黄瑛殷剑波李小连贾彬黄敏
黄瑛,殷剑波,李小连,贾彬,黄敏
(1深圳市海洋生物资源与生态环境科学重点实验室,深圳市海藻生物技术工程实验室,广东省植物表观遗传学重点实验室,深圳大学 生命科学与海洋学院,深圳518060;2中南民族大学 生物医学工程学院,武汉 430074)
微藻通过光照自养和异养方式生产高价值生物活性化合物,包括色素、脂类和类胡萝卜素等,其衍生物在功能性食物、动物饲料、药物、化学原料及生物燃料等领域展现出巨大的潜力[1].随着合成生物学兴起,多基因共调控技术在微藻脂质合成中发挥着日益重要的功能,成为突破藻类产油瓶颈,开发稳定高效产脂工程株的关键.通过脂质合成与代谢机制的多通路共同优化,引导碳流量流向脂质合成途径具有广阔的应用前景.
提高油脂积累可以通过多种策略来实现.增加脂肪酸合成前体乙酰辅酶A含量或提高NADPH的还原力;通过降低CIS活性[2]或磷酸烯醇丙酮酸羧化激酶活性(PEPC)[3]可引导更多的碳流量流向脂肪酸合成.降低LACS[4]的活性,可以减少脂肪酸的氧化积累脂肪酸.过表达乙酰辅酶A羧化酶(ACAC)[5]或者酰基去饱和酶(FAD)[6]等也可以增加脂肪酸的合成.转录因子控制多种酶的活性,可以调节细胞的应激反应和生长,影响着脂质的合成.过表达转录因子DOF[7]或bZIP[8],可以影响脂肪酸合成的相关基因,例如ACAC和LACS等,因此转录因子可作为全局调节因子,调节微藻细胞代谢网络并影响脂质合成与代谢途径.
使用模式生物莱茵衣藻作为多基因调控积累油脂的研究对象,通过在衣藻中进行RNAi干扰抑制CIS和LACS,从而改变碳通量和减少脂肪酸氧化;同时过表达内源性DOF转录因子,增加脂肪酸合成,实现多基因共调控.本研究分析了多基因共调控的微藻生长及油脂积累等生理生化的变化,为高产油脂藻株的构建提供参考.
1 材料与方法
1.1 材料
莱茵衣藻cc849,莱茵衣藻DOF工程藻来源于深圳海洋生物资源与生态环境科学重点实验室藻种库,莱茵衣藻DOF工程藻含有热激启动子HSP70A-RBCS2,可过表达DOF基因.载体PMAA7IR来源于深圳海洋生物资源与生态环境科学重点实验室,载体PMAA7IR包含启动子RBCS2、用于5-FI筛选的MAA7 基因、EcoRⅠ酶切位点和潮霉素基因.
1.2 培养条件
培养基采用TAP培养基.初始接种细胞浓度5×104个/mL,光照强度60 μmol/m2·s.热激条件为藻株生长至第4 d水浴40 ℃ 30 min后正常培养.
1.3 载体的构建及转化
1.3.1 载体的构建
引物序物列如表1.分别以引物1扩增莱茵衣藻CIS的3′UTR片段,以引物2扩增莱茵衣藻LACS的3′UTR片段;分别以扩增片段CIS和LACS为模板,引物3扩增CIS反向互补片段,以引物4扩增LACS反向互补片段.间隔序列sp片段则由引物5扩增.连接后插入pMaa7IR载体,获得PMAA7IR/LACS2-CIS1 IR沉默载体.扩增程序如下:(1)95 ℃,3 min;(2)94 ℃,30 s;(3)60 ℃,30 s;(4)72 ℃,50 s;(2)~(4)30个循环;(5)72℃,5 min.
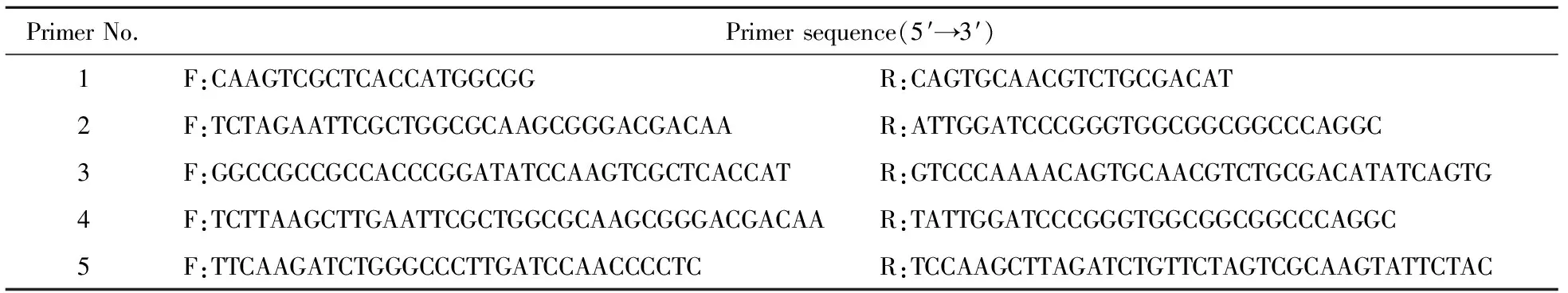
表1 用于扩增PCR引物
1.3.2 莱茵衣藻转化
将PMAA7IR/LACS2-CIS1 IR沉默载体利用珠磨法转入DOF工程藻.转化后藻株转移至50 mL无菌离心管,并在弱光25 ℃、100 r/min培养过夜.5000 r/min离心5 min收集藻细胞.涂于色氨酸、潮霉素和5-FI的 TAP固体平板,平板倒置于25 ℃,光照60 μmol/m2·s培养.
1.4 中性脂含量测定
取对数期细胞,0.01 M PBS缓冲液洗两遍,吸取980 μL稀释藻液转移至流式细胞管,加入20 μL的BODIPY505/515染液.BD FACSCalibur流式分析仪,选取FITC通道,读数10000个细胞,每个样重复3次.
1.5 脂肪酸含量测定
藻粉10 mg置于15 mL玻璃管,加入2 M NaOH-CH3OH溶液反应,再加入4 M HCl-CH3OH溶液,正己烷萃取后氮吹仪吹干.500 μL CH2Cl2悬浮,并转移至色谱进样瓶中,上机检测.GC-MS气相色谱柱为VF-23 MS,柱子规格为30.0 m×320 μm×0.25 μm,最高温度为260 ℃.进样口温度为250 ℃,采用分流进样模式,分流比为10∶1,载气为高纯He.柱温箱升温程序:(1)70 ℃,4 min;(2)25 ℃/min速率升温至195 ℃;(3)3 ℃/min速率升温至205 ℃;(4)8 ℃/min速率升温至230 ℃,保持1 min.质谱检测器选择全扫描模式,气相色谱-质谱传输线温度为250 ℃.
1.6 生长曲线、淀粉和可溶性蛋白质的测定
利用血球计数板每隔24 h记录细胞数目测定生长曲线.淀粉测定按照淀粉提取试剂盒(Solarbio)说明提取并检测.蛋白质测定条件为:藻液2 mL离心加入PBS缓冲液冲洗,加入200 μL BugBuster Protein Extraction Reagent(默克)裂解液,水浴在30 °C震荡反应30 min,离心取上清液稀释至标准曲线的直线范围,酶标仪检测.
1.7 基因表达量检测
按照Trizol说明书提取RNA,用PrimeScriptTMRAT reagent Kit with gDNA Eraser(Takara)反转录试剂盒合成cDNA.按照KOD SYBR qPCR Mix Kit(Toyobo)用于qRT-PCR的检测.以β-actin为内参.其程序为:(1)98 ℃ 2min;(2)98 ℃ 10 s,(3)60 ℃ 30 s,(4)72 ℃ 30 s,(2)~(4)40个循环.
2 结果
2.1 三基因工程藻的筛选及其分子生物学分析
通过重叠扩增PCR法连接LACS2基因的3′UTR片段和CIS1基因3′UTR片段形成串联反向重复序列(图1),插入至EcoRⅠ限制性酶切位点的沉默载体PMAA7IR,得到重组载体(PMAA7IR/LACS2-CIS1 IR).将重组载体采用珠磨法转入DOF工程藻,在含有浓度为12.5 μg/mL潮霉素和浓度5 μM的5FI的TAP平板筛选三基因工程藻的转化子(图2a).提取部分转化子的基因组DNA进行PCR检测基因组验证,显示PMAA7IR/LACS2-CIS1 IR已成功整合到DOF工程藻株基因组DNA中(图2b).利用荧光染色法测定150株三基因工程藻中性脂含量,发现33株三基因工程藻中性脂含量较野生型cc849高(图2c).其中工程藻DLC-4、DLC-7 和DLC-8脂质含量较高,与野生型cc849相比,工程藻DLC-4脂质含量增加了74%(图2d).分析基因表达量表明,三基因转化藻株DLC-4和DLC-8中LACS2和CIS1均下调表达,其中DLC-4与对照组相比分别下调表达58%和26%(图2e).上述结果表明,DOF-LACS2-CIS1三基因转化藻株构建成功.
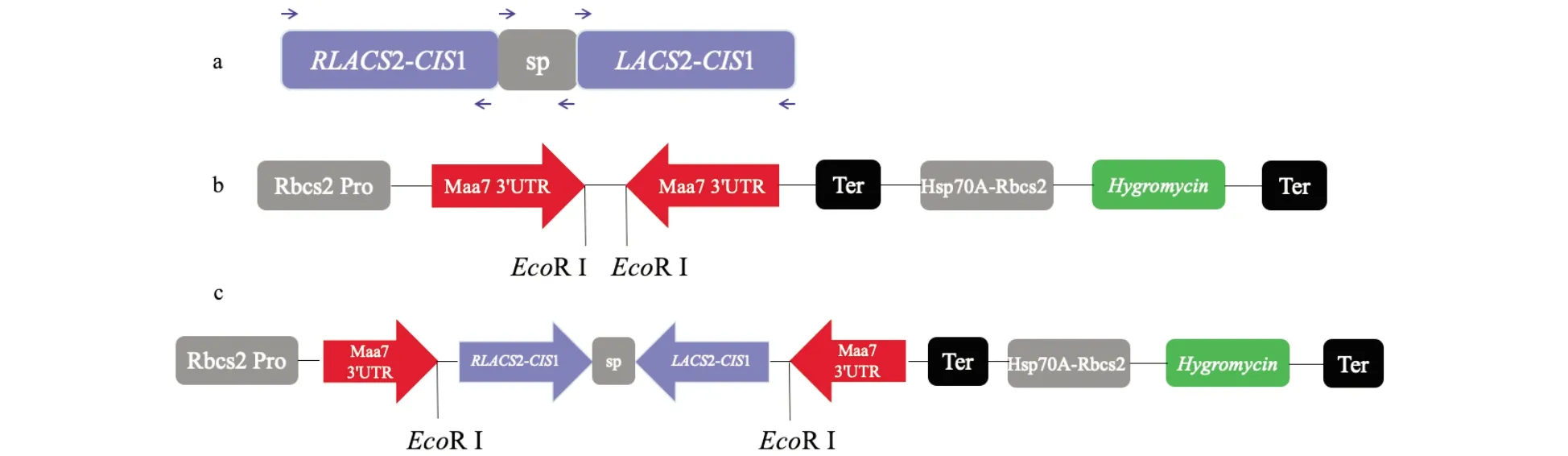
(a)重叠PCR合成LACS2-CIS1反向重复片段;(b)沉默载体PMAA7IR示意图;(c)重组载体(pMaa7IR/LACS2-CIS1 IR); 箭头代表引物

(a)工程藻转化株;(b)双基因LACS2-CIS1和荧光素酶的基因组验证;(c)通过中性脂筛选转化株;(d)选定的转化株;(e)qRT-PCR验证双基因LACS2-CIS1的表达量;*P < 0.05,** P< 0.01,***P<0.001,student t test(n=3)
2.2 三基因共调控藻株的生理生化特性
微藻生物量在生物燃料、高价值营养品等产品的大规模生产起着很重要的因素.对比三基因藻株(DLC-4)与cc849(WT)的生长(图3a),在8 d的培养期间,2种微藻生长趋势相似,均可以达到较高细胞密度1.4×107个/mL.DLC-4在接种后的第4 d进入平台期,比WT提前1 d.胞内中性脂随着细胞的生长不断积累,在对数期后期和平台期积累的油脂最高(图3b),DLC-4的中性脂在第5 d以后趋于平稳,而WT的中性脂在第5 d达到最大值.对比培养第6 d藻株的蛋白(图3c),淀粉(图3d)以及脂肪酸(图3e)的含量,发现与WT相比,DLC-4的蛋白和淀粉含量略微下降,淀粉含量分别为73.64 mg/g和66.90 mg/g;蛋白含量分别为134.29 mg/g和122.99 mg/g;而胞内脂肪酸含量上升了31%.这说明降低CIS1和LACS2活性引导更多的碳流量流向脂肪酸合成[2]和减少了脂肪酸的氧化[4].

(a)生长曲线;(b)对数后期及平台期的中性脂含量;(c)蛋白含量;(d)淀粉含量;(e)脂肪酸含量;*P<0.05,student t test(n=3)
2.3 热诱导后三基因共调控藻株的生理生化特性
由于DOF工程藻具有热激启动子,因此藻细胞正常培养至第4 d热激诱导,第5 d以后2种微藻的生长均受到影响(图4a).热激后的DLC-4(HDLC-4)的中性脂在第6 d最大(图4b).WT与热激后的WT(HWT)相比脂肪酸含量无明显差异(图4c).HDLC-4与热激前比较淀粉含量分别为112.82 mg/g和61.91 mg/g(图4d),蛋白浓度分别为163.86 mg/g和124.57 mg/g(图4e),淀粉和蛋白含量下降了45%和24%,而脂肪酸含量上升了52%(图4f).说明在热激启动作用下,随着DOF转录因子的过表达,三基因共调控的手段可能减少微藻的淀粉和蛋白的含量,为脂肪酸合成提供所需的前体和能量,促进脂肪酸含量提高更多.

(a)生长曲线;(b)对数后期及平台期中性脂含量;(c)WT 和 HWT脂肪酸含量对比;(d)HWT 和 HDLC-4淀粉含量对比;(e)HWT 和 HDLC-4蛋白含量对比;(f)HWT 和 HDLC-4脂肪酸含量对比; *P<0.05,**P< 0.01,student t test(n=3)
3 分析与讨论
DOF、LACS2 和CIS1 基因参与细胞内多种代谢活动,是细胞内代谢途径的关键酶.小球藻过表达大豆DOF基因上调了长链酰基辅酶A合成酶和乙酰辅酶A活性增加脂肪酸含量[7].ACS参与细胞脂肪合成和降解.2016年在衣藻中发现两个ACS基因[4],其中LACS2与拟南芥参与β-氧化的ACS基因相似[9].通过反义RNA干扰下调其活性增加了大量的脂肪酸含量.通过RNAi干扰CIS基因,发现碳通量更多的分配从头合成脂肪酸,并上调磷脂酸磷酸酯酶(PAP)和二酰甘油酰基转移酶(DGAT)的活性来增加TAG的积累[2].本研究对莱茵衣藻三基因共调控脂肪酸合成进行了分析.结果显示,在正常培养条件下,DLC-4脂肪酸含量相比WT提高了31%,生长趋势基本一致,但淀粉和蛋白质含量无显著性变化.可能是下调的CIS1 和LACS2 基因分别发挥基因功能,引导更多的碳流量用于脂肪酸合成及减少了脂肪酸氧化.
在热激诱导条件下,HSP70A-RBCS2启动子驱使DOF转录因子高表达.WT与HWT相比脂肪酸含量无明显差异.据报道,热激环境下可促进衣藻的膜脂直接转化为TAG作为储蓄物质而不影响脂肪酸和淀粉含量[10].这也排除了热激作为外界环境影响脂肪酸、淀粉的含量变化的可能.HDLC-4胞内总脂肪酸比HWT相比提高了52%,但蛋白和淀粉含量分别下降了24.0%和45%.表明在三基因共调控下,淀粉和蛋白的减少可能为脂肪酸合成提供所需的前体和能量.
研究表明,过表达硅藻双基因Δ5去饱和酶(PtD5)和丙二酰辅酶A酰基载体蛋白转酰基酶(MCAT)基因增加长链不饱和脂肪酸(EPA、ARA、DHA)的含量[11].过表达栅藻Scenedesmusquadricauda的三基因,包括乙酰辅酶A羧化酶ACC1、甘油激酶(GPD1)和磷酸甘油脱氢酶(GUT1),与野生型相比油脂显著增加[12].工程藻DLC-4虽能提高油脂含量,但作为高产油脂藻株应用于工业化生产,还需要参考更多基因组合,进行后续研究.
4 结语
通过将双基因沉默载体(LACS2-CIS1)转入莱茵衣藻DOF工程藻中,构建了莱茵衣藻三基因共调控藻株.与莱茵衣藻cc849相比,三基因藻株生长状态相似,淀粉和蛋白无明显改变,但胞内中性脂含量明显增加,且脂肪酸含量上升了31%.在热激启动作用下,三基因藻株淀粉和蛋白含量下降了58%和26%,胞内中性脂含量增加74%,脂肪酸含量上升了52%.故通过共调控三基因DOF-LASC2-CIS1显著提高了莱茵衣藻的脂质含量,也证明了使用多个基因改造技术在衣藻工程藻应用中具有重要的潜力,这为未来微藻生物资源利用发展提供了一个新思路.
