外源一氧化氮对铅胁迫下高羊茅生理特性的影响
2020-10-23刘利乐张静吴敏陈柯
刘利乐,张静,吴敏,陈柯*
(1 中南民族大学 资源与环境学院,武汉 430074;2武汉凯迪电力环保有限公司,武汉 430074)
重金属铅(Pb)是自然界中广泛分布的有毒金属,由于其不可进行生物降解,在环境中稳定存在,引发了许多环境污染问题,植物修复环境友好且成本低,是修复铅污染的良好选择[1].植物中重金属产生的影响包含影响植物种子萌发、幼苗发育、活性氧(ROS)的积累等.
高羊茅是一种多年生草本植物,其根系发达、具有纤维根且对环境适应性广适应性强,多见于园林绿化和护坡植被,现在生态修复方面广泛应用.据报道,高羊茅已经表现出了对Cu、Cd、Pb、Zn等各种重金属的抗性,在植物修复方面表现出了远大的应用前景[2].
一氧化氮(NO)作为在生物体内广泛分布的水溶性和脂溶性气体小分子信号物质,在细胞水溶液部分和细胞膜的脂相间自由穿梭,参与动植物重要的生理过程,对植物而言NO主要影响种子萌发、生长发育、光合作用、根系生长以及抗逆反应等.NO的作用是双重的,低浓度的NO能促进植物生长发育和提高植物的抗逆性,主要体现在NO的抗氧化性,减轻超氧阴离子毒害作用;高浓度NO不仅会抑制植物的生长发育,还会造成DNA损伤,甚至细胞死亡[3].NO能够拥有以上功能并参与生理调节,由于它与生物体内的众多信号途径密切相关,包括活性氧、茉莉酸、水杨酸和Ca2+途径等[4].硝普钠(SNP)是一种常用的外源一氧化氮供体,0.5 mmol的SNP约可产生0.2 μmol NO.施加外源SNP,可改善辣椒植株叶片和根的生理状况,提高抗氧化酶活性,有助于适应环境,还可提高干旱胁迫下紫花苜蓿的抗氧化酶活性等[5].因此,本文在已知高羊茅对重金属有耐性的前提下,通过外源添加NO,改善在铅胁迫下高羊茅的生理状况,减弱铅对高羊茅的损害,增加对铅的吸收并达到提高高羊茅修复效果的目的.
1 材料与方法
1.1 样品、试剂和仪器
选择“猎狗五号”高羊茅种子,播种于方形塑料盆中,以蛭石和珍珠岩作为培养基质,体积比为1∶1清水浇灌.待种子萌发并长出5 cm后,转移至光照培养室培育,每天光照16 h,光照强度为300 μmol/(m2·s),室温控制在23~26 ℃,持续2个月.
硝酸铅(Sinopharm);硝普钠(Sigma);酶活性试剂盒(南京建成生物工程研究所);3,3′-二氨基联苯胺(DAB,Sigma-Aldrich);超氧自由基染色剂氮蓝四唑(NBT,Sigma-Aldrich).手持式叶绿素荧光仪(SPAD-502,Minolta,Osaka,Japan);紫外分光光度计(MAPADA);火焰原子吸收光谱仪(AA-7001F,East & West Analytical Instrument);便携式脉冲调制式叶绿素荧光仪(PAM 2500,Heinz Walz GmbH);根拓扑扫描(WINRHIZO,Regent Instruments Inc.,Canada).
1.2 实验设计
将发芽2个月的高羊茅转移至锥形瓶中,用改良1/2 Hoagland营养液水培,其中使用氯化钾代替磷酸二氢钾,并通过氢氧化钾调节营养液中的pH值,调整范围为5.8~6.2,适应环境1周.随后用硝酸铅和硝普钠(SNP)进行处理,设置以下2个处理组:(1)对照组200 mg·L-1Pb2+(200Pb);(2)200 mg·L-1Pb2++200 μmol SNP(200PbS),每个处理组设置4个重复.每隔1 d补充营养液,每隔2 d更换新的营养液,持续2周.
1.3 实验方法
1.3.1 生物量和叶片叶绿素含量测定
在将高羊茅转为水培适应1周后,除去枯黄衰老的叶片,减去多余的叶片部分,只留10 cm高,调整高羊茅的重量(重量误差不超过10%),并记录.用Pb2+和SNP处理2周后,优先测定每瓶高羊茅的重量,即为最终生物量,用鲜重表示.
高羊茅在Pb2+和SNP的环境中处理2周后,可用手持式叶绿素荧光仪原位测定其叶绿素含量,每瓶测8个重复.
1.3.2 高羊茅根和叶中Pb2+含量测定
先将高羊茅的根和叶用10 mmol·L-1EDTA浸泡2次,每次10 min,再用蒸馏水洗涤3次,置于烘箱中,并在60 ℃下烘烤至恒重.然后将高羊茅的叶和根单独切割并称重,分别取0.2 g放入消解罐中,加入2 mL H2O2和6 mL HNO3,在微波消解器中消解10 min,结束后用火焰原子吸收光谱仪测定其中Pb2+浓度.
1.3.3 酶活性测定
取0.1 g高羊茅的组织分别置于2 mL离心管中,加入2个直径为3 mm的钢球并在液氮中快速冷冻,用破碎机粉碎植物组织.再加入0.9 mL 在4 ℃下预冷冻的pH=7.8的磷酸缓冲溶液,以3500 r·min-1在4 ℃离心20 min,取上清液备用.根据SOD、POD和APX的酶活性试剂盒的说明进行紫外分光光度计测定.
1.3.4 脂质过氧化
通过对ALZAHRANI和RADY描述的方法稍作修改后测定丙二醛(MDA)的含量[6].将新鲜植物组织破碎后加入缓冲溶液离心后可取上清液待测.
1.3.5 叶片电导率测定
取0.1 g高羊茅叶片,用蒸馏水洗净后,放入试管中,加入15 mL蒸馏水,室温下振荡24 h即可用电导率仪测量初始电导率.将试管于121 ℃高压灭菌30 min,待冷却至室温后,可确定其最终电导率.
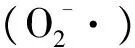
分别用DAB和NBT测定高羊茅叶片中过氧化氢和超氧阴离子的含量.取0.5 g叶子浸入DAB溶液中并在真空中染色30 min,再将染色的叶子转移到乙酸-甘油-乙醇(体积比1∶1∶3)溶液中.在100 ℃水浴5 min,再将叶子置于甘油-乙醇(体积比1∶4)中30 min,最后,用液氮将染色后的叶片研磨成粉状,混入0.2 mol·L-1HClO4,以12000 g在37 ℃下离心10 min.取上清液在450 nm处测量吸光度,并根据标准曲线计算H2O2的浓度.

1.3.7 快速叶绿素(Chl)荧光瞬态和荧光动力学曲线的测定
通过便携式脉冲调制式叶绿素荧光仪进行叶绿素荧光瞬态曲线和慢速叶绿素荧光动力学的测量.
1.3.8 根系形态分析
高羊茅根系形态的分析可通过自动化根拓扑扫描装置来确定.使用WINRHIZO扫描进行分析,从分析的结果中可获得根的总长度(RL)、根投影面积(PA)、根表面积(RS)、根平均直径(AD)、根体积(RV)和根尖数(RTS)的数据.
1.3.9 根细胞壁制取及多糖分析
取0.1 g新生根尖,破碎后与1.5 mL 80%乙醇混合后,置冰中30 min,用1.5 mL 80%乙醇清洗沉淀,去掉上清液.分别用1.5 mL经预冷冻的丙酮、甲醇-氯仿(体积比1∶1)混合物、甲醇洗涤,去掉上清液,冷冻干燥,即可得到粗细胞壁.细胞壁的分级提取.
果胶:用0.75 mL 含有0.1% NaBH4(pH 4)的0.5%草酸铵缓冲液在沸水浴中提取2次干燥的粗细胞壁材料各1 h,离心,收集上清液得到果胶组分.
HCl:在室温下用0.5 mL含有0.1% NaBH4的4% KOH分别对沉淀萃取3次,总时间为24 h.离心,收集上清液得到HCl组分,再用冰醋酸中和.
HC2:在室温下用0.5 mL含有0.1% NaBH4的24% KOH分别对沉淀萃取3次,总时间为24 h.离心,收集上清液得到HC2组分,再用冰醋酸中和.
纤维素:将24% KOH萃取后的沉淀冻干,称重并讨论纤维素组分.
细胞壁组分中的多糖含量用中性糖和糖醛酸来表示,其中Pectin、HC1和HC2中的中性糖用苯酚-硫酸法检测,糖醛酸用间羟基联苯法检测,而纤维素的中性糖含量检测需要先预处理,用4 mL 2 mol·L-1的硫酸在95 ℃下水解沉淀2 h后离心,取上清液,残渣用热水洗涤3次后与上清液混合,定容至100 mL,再按苯酚-硫酸法测定,各细胞壁组分含量均以鲜重表示.
1.3.10 数据分析
2 结果与分析
2.1 外源NO对铅胁迫下高羊茅生物量、叶绿素含量和Pb2+吸收的影响
高羊茅在受到Pb2+胁迫后会出现长势变差,生物量逐渐下降等反应,而外源添加了SNP后,能够缓解Pb2+的抑制现象.由图1可见:分别用Pb2+和SNP处理14 d后,与对照组200Pb相比,200PbS条件下高羊茅的生物量和叶绿素含量出现明显提高,分别增加了15.4%和11.1%.由于NO可直接作用于细胞壁,使其结构变得松散,或者作用于细胞膜,增强其流动性功能,使得细胞得到扩展[7].

图1 硝普钠对铅胁迫下高羊茅生物量和叶绿素含量的影响
相一致的,对于Pb2+的吸收来说,由表1可知:在200PbS胁迫的根中Pb2+的积累量与200Pb存在微量差别,但是叶片中200PbS Pb2+含量比200Pb少9.4%,并且向叶片的转移量更少,这说明经SNP处理后,Pb2+主要被保存在了根中,减少叶中的Pb2+含量.
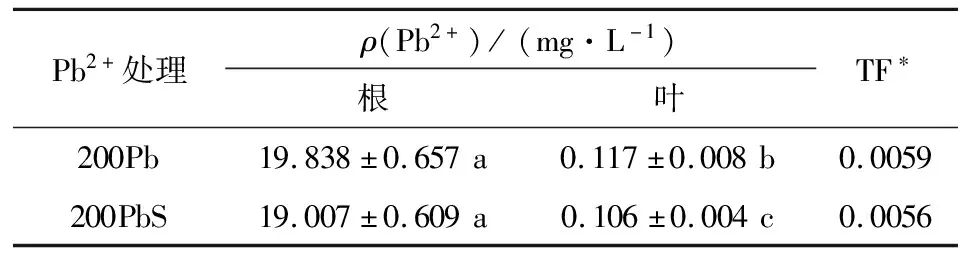
表1 铅在高羊茅根和叶中的积累
2.2 外源NO对铅胁迫下高羊茅抗氧化酶的影响
植物能够正常的生长发育,是因为其内部各个生理过程的氧化还原环境处于平衡状态,这得益于其自身的抗氧化酶系统,SOD能清除植物细胞内超氧阴离子自由基,POD和APX能够将生物体内的积累H2O2分解为水和氧气,减弱H2O2对其的毒害作用.但当受到胁迫时会打破这个平衡,使各个酶活性受到抑制,导致过量的活性氧对机体产生毒害作用[8],甚至造成植株死亡,NO作为外界胁迫下的抗氧化剂,对植物细胞起保护作用,可直接清除活性氧[9].外源NO对铅胁迫下高羊茅抗氧化酶的影响结果见图2,图2中高羊茅的SOD、POD和APX的活性,无论在是根还是叶中,200PbS处理的组分,均高于200Pb的活性,叶的抗氧化物酶活性均高于根,其中200PbS叶片中APX的活性比根高234.9%.NO提高了植物的抗氧化性,相关抗氧化酶SOD、POD、APX的活性也有所改善.
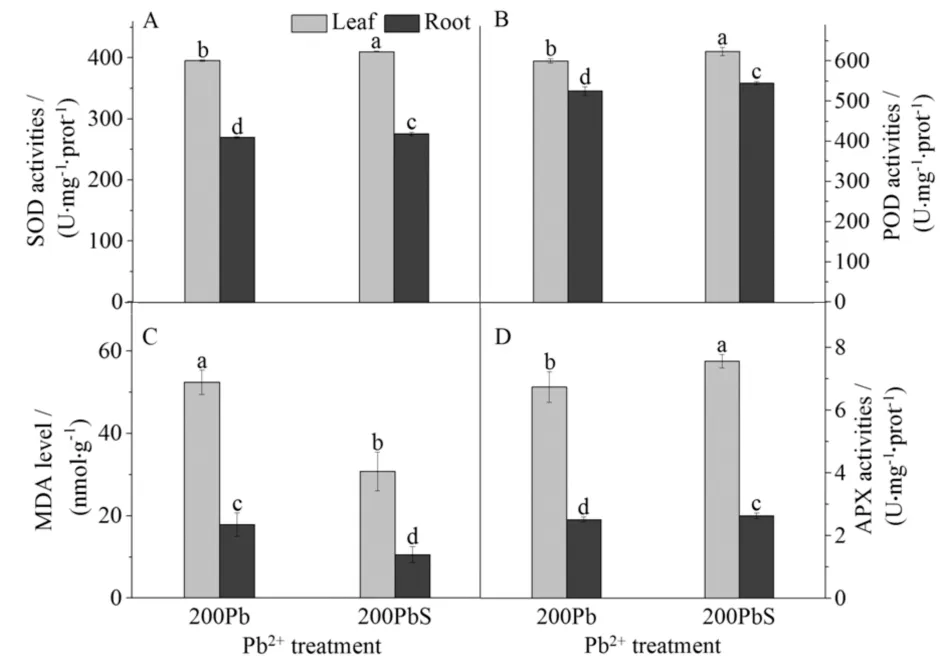
图2 硝普钠对铅胁迫下高羊茅根和叶中超氧化物歧化酶(A)、过氧化物酶(B)、丙二醛水平(C)和抗坏血酸过氧化物酶(D)活性的影响
2.3 外源NO对铅胁迫下高羊茅活性氧含量、脂质过氧化和电导率的影响
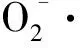
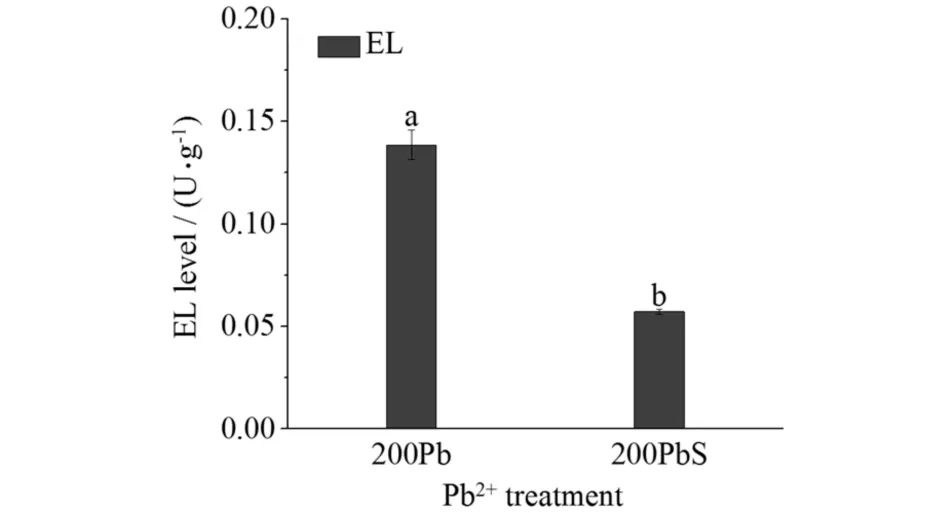
图3 硝普钠对铅胁迫下高羊茅叶片电导率的影响
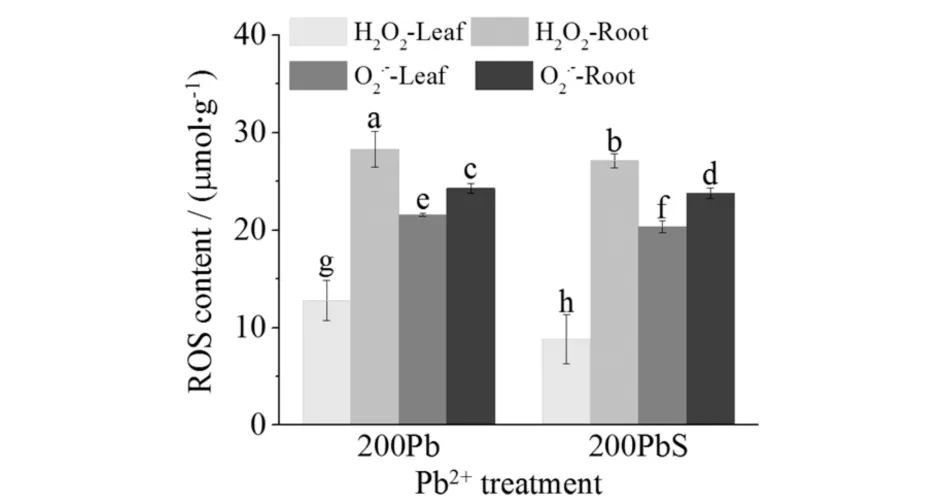
图4 硝普钠对铅胁迫下高羊茅叶片中活性氧含量的影响
2.4 外源NO对铅胁迫下高羊茅光合作用的影响
高羊茅作为一种普通的绿色植物,其生长和繁殖的主要能量来自光合作用,而叶绿素是植物进行光合作用的必需物质,决定着植物的光合速率,图1中SNP增加了高羊茅Chl的水平,说明一定浓度的NO能促进植物叶片中Chl的合成[11].除此之外,NO还能缓解Pb2+引起的光抑制,200PbS比200Pb的初始荧光值低,说明200PbS的PSII反应中心受到的抑制更小(图5、图6、表2),即Pb2+的光抑制现象减弱[12].图6显示,在Pb2+和SNP处理2周后,高羊茅叶片出现了明显的K-band和L-band,说明在反应过程中电子传递收到阻碍,而200PbS的影响程度更低,SNP有效缓解了这种抑制.

图5 硝普钠对铅胁迫下高羊茅叶片OJIP瞬态曲线的影响
A表示OJIP瞬态曲线上从O点到K点的荧光值,Wok=(Ft﹣Fo)/(Fk﹣Fo);B表示O点到K点间200Pb与200PbS荧光值的差值,ΔWok
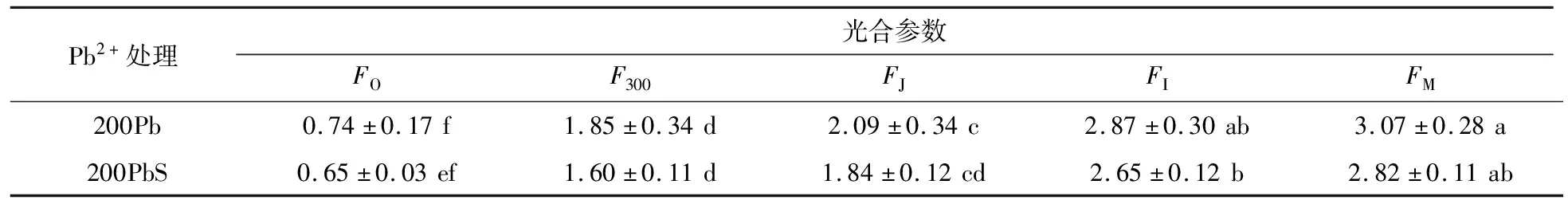
表2 从OJIP曲线得到的光合作用基本荧光参数
在Pb2+处理下,会使得天线色素吸收的光能更多的用于热耗散,而减少光化学反应的量[13],但经SNP处理后,出现了相反的变化,从表3可知,和对照组200Pb相比,200PbS处理组φP0、ψE0、γRC和PIABS都出现上升趋势,其中PIABS增加了15.8%,而δR0和PItotal分别下降了15.9%和10.3%.在表4中,200PbS处理组的非光化学淬灭系数(NPQ、qN)都表现为下降,光化学淬灭系数(qP、qL)都表现为上升,说明NO有利于植物光合作用过程(表4).
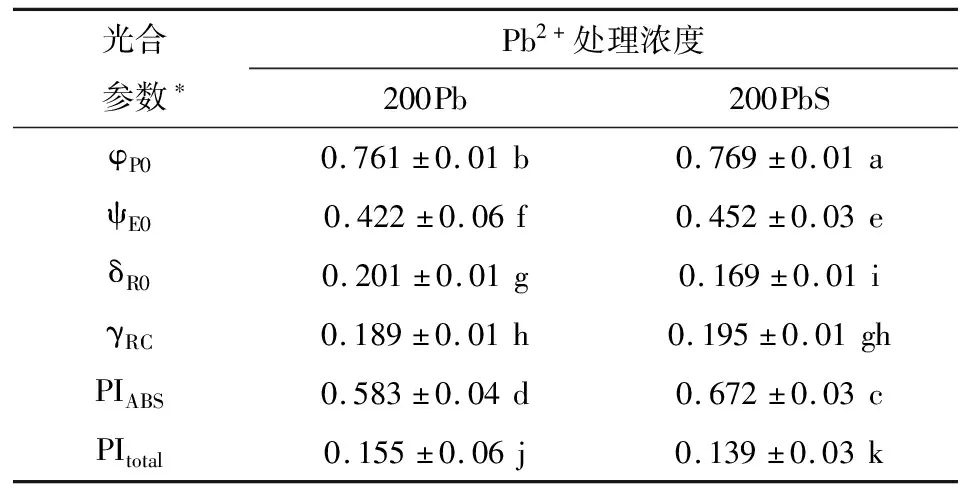
表3 通过JIP-test分析OJIP荧光瞬态曲线所得光合作用参数

表4 通过慢速叶绿素荧光动力学曲线得到的光合作用参数
2.5 外源NO对铅胁迫下高羊茅根系结构及组分的影响
根系在植物的生长发育过程中起重要作用,其形态和结构均能反映受胁迫程度的大小,也是高羊茅吸取营养液的直接器官,是直接与Pb2+和SNP接触的部分,能够快速反映出植株的真实状况.表5直观地展示了高羊茅根结构的状况(RL、PA、RS、AD、RV和RTS),NO增加了高羊茅根系的生物量和比表面积,减少了根尖数,由于Pb2+引起根尖分裂受阻,影响了根的正常生理过程,导致根系生长受阻,而NO通过减少对Pb2+的吸收,减轻了Pb2+对根系的破坏(表1).

表5 高羊茅根系数据(总根长、根投影面积、根表面积、根平均直径、根体积和根尖数)
细胞壁是响应金属胁迫的功能信号分子和代谢所在的位点,骨架主要由果胶、HC1、HC2和纤维素构成.植物应对Pb2+胁迫的防御策略主要是通过细胞壁增厚.由图7可见:在根细胞壁中,200Pb的各个组分(果胶、HC1、HC2和纤维素)的含量、中性糖和糖醛酸的总量均比200PbS高,中性糖和糖醛酸的总量各高22.7%和42.9%.经Pb2+处理后,高羊茅根系的多糖总量(中性糖和糖醛酸的和)增加,形成了Pb2+的额外积累空间,为其在植物的吸收提供了基础[14].糖醛酸作为细胞壁中吸附 Pb2+主要部位,果胶中200Pb的糖醛酸与中性糖的比值也比200PbS高33.3%.而NO可以抑制细胞壁增厚的进程,减少细胞壁中Pb2+的结合位点,阻止Pb2+通过细胞壁和减少渗入原生质体的Pb2+的量(图7),预防引起ROS的过量积累(图4),维持氧化还原平衡和正常生物代谢[15].
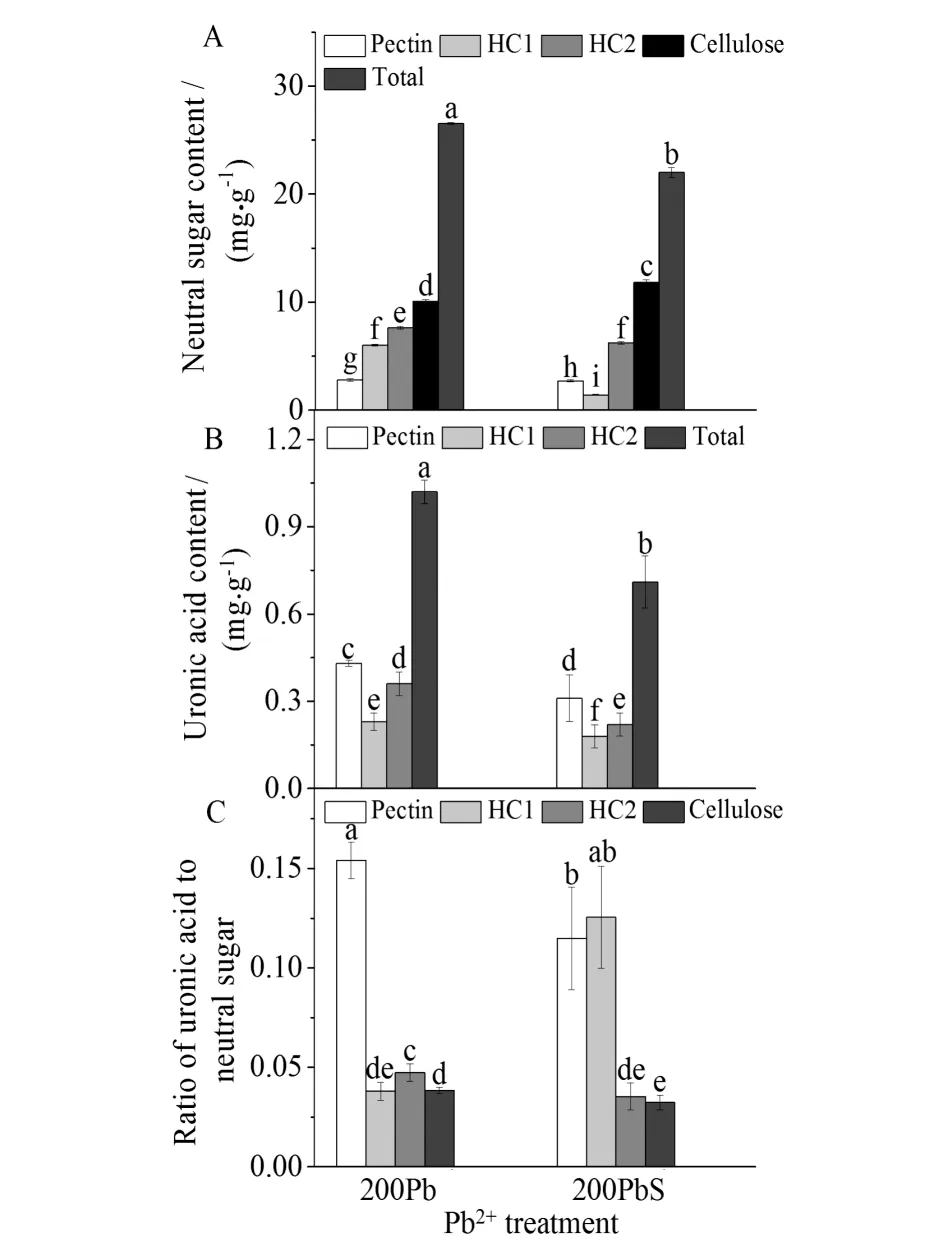
图7 硝普钠对铅胁迫下高羊茅根细胞壁中性糖(A)、糖醛酸(B)及它们比例(C)的影响
3 结论
外源一氧化氮缓解铅对高羊茅的胁迫作用的机理在于:
(2)NO提高了抗氧化酶(SOD、POD、APX)的活性,维持植物体内的氧化还原平衡,降低脂质过氧化对细胞膜的破坏,抑制氧化损伤.
(3)NO重塑高羊茅根系的结构和组成,减少细胞壁中Pb2+的附着位点,特别是减少Pb2+向叶片的转移,促进叶绿素的合成,保证光合作用的正常运行,使其能为高羊茅的生长发育提供充足的营养.
