白花蛇舌草-半枝莲药对组分对结肠腺癌Lovo细胞生物学行为的影响
2020-10-23包萨如拉安桂凤萨如拉苏步德格日乐
包萨如拉,安桂凤,萨如拉,苏步德格日乐
大肠癌是常见的消化系统恶性肿瘤,目前已成为我国发病率上升最快的消化道恶性肿瘤[1]。据2018年全球癌症数据调查显示,大肠癌的发病率居第4位,死亡率居第2位[2]。结、直肠癌均属于大肠癌,根治性手术切除是目前最有效的治疗方法[3],但患者就诊时多为中、晚期,癌细胞转移侵犯邻近组织,导致根治率低[4]。尤其是无法手术的患者,其5年生存率<5%[5]。因此,对于大肠癌的治疗及疗效的提高,除了早期干预外,还应从其发生、浸润和转移的分子调控机制方面寻求新的治疗靶点和药物。白花蛇舌草和半枝莲均有抗炎、活血化瘀、抗癌和疗毒敛疮的作用,在中药配伍中常作药对使用[6-7]。目前白花蛇舌草-半枝莲药对常融入方剂中,如“重建中气抗癌汤I号”等[8]。此外,部分基础研究证实,白花蛇舌草-半枝莲药对提取物可抑制胃癌[9]、肝癌[10]和乳腺癌[11]细胞的增殖,降低迁移和侵袭能力,并诱导细胞凋亡。目前对白花蛇舌草-半枝莲抑制大肠癌细胞作用的报道较少。本研究旨在探讨白花蛇舌草-半枝莲对人结肠腺癌Lovo细胞生物学行为的影响,为临床应用提供理论依据。
1 材料与方法
1.1细胞及试剂 人结肠腺癌Lovo细胞购自美国ATCC公司。白花蛇舌草、半枝莲购自内蒙古民族大学医院中药房,白花蛇舌草为茜草科植物白花蛇舌草的干燥全草,半枝莲为唇形科植物半枝莲的干燥全草。RPMI 1640培养基(美国Gibeo公司);二甲基亚砜(美国Sigma公司);兔抗人β-肌动蛋白(β-actin)多克隆抗体、兔抗人苏氨酸激酶(Akt)多克隆抗体、兔抗人血管内皮生长因子受体2(VEGFR-2)多克隆抗体、兔抗人B淋巴细胞瘤-2基因(Bcl-2)多克隆抗体、兔抗人Bcl-2相关X蛋白(Bax)多克隆抗体、兔抗人Grb2相关结合蛋白1(Gab1)多克隆抗体、兔抗人基质金属蛋白酶-9(MMP-9)多克隆抗体、兔抗人磷脂酰肌醇3-激酶(PI3K)多克隆抗体(英国Abcam公司);山羊抗兔过氧化物酶二抗(北京康为世纪公司);MTT检测试剂盒(美国Sigma公司);Transwell小室(美国Millipore公司);BCA试剂盒(上海威奥生物科技有限公司);TUNEL细胞凋亡检测试剂盒(上海碧云天公司)。
1.2仪器 WD-9413B型凝胶成像系统(北京六一生物科技有限公司);BX53型荧光显微镜(日本Olympus公司);SD Cell型转移电泳槽(美国Thermo公司);VE-180型垂直板电泳装置(上海天能科技有限公司);muLISKAN-MK3酶标仪(美国Bio-rad公司);Titan G260-300型透射电镜(日本日立电子公司);CytoFLEX型流式细胞仪(贝克曼公司)。
1.3白花蛇舌草-半枝莲组分制备 白花蛇舌草-半枝莲组分制备方法参考文献[12],将白花蛇舌草、半枝莲按质量1∶1比例取材后进行3次煎煮,无菌纱布滤渣,获得水提物,后取适量浸膏用石油醚回流脱脂,再以乙酸乙酯进行多次萃取,浓缩干燥后获得白花蛇舌草-半枝莲药对乙酸乙酯组分,并计算得率。得率=目标物质含量/原料物质含量×100%。根据参考文献[12]对白花蛇舌草-半枝莲乙酸乙酯组分进行检测:取白花蛇舌草-半枝莲乙酸乙酯浸膏及对羟基苯乙酮、野黄芩苷、木犀草素、芹菜素样本,加入1 mL甲醇,充分溶解后过滤、离心,并采用超高效液相色谱(UPLC)进行分析。UPLC色谱条件:柱温40℃,流动相为乙腈(C)-0.1%甲酸(D),梯度洗脱(0~20 min,5%C和95%D;20~22 min,100%C;22~25 min,5%C和95%D)。
1.4细胞培养与分组 取复苏后的人结肠腺癌Lovo细胞接种于96孔板内,培养于含10%胎牛血清和1%双抗的RPMI 1640培养基中。细胞设对照组以及低、中、高剂量白花蛇舌草-半枝莲药对干预组,分别予以白花蛇舌草-半枝莲药对0、10、30、50 mg/L处理。细胞培养条件为:37 ℃,5%CO2,隔天换液1次。各组Lovo细胞均培养72 h,取对数生长期细胞进行后续实验。
1.5MTT检测细胞增殖能力 各组细胞培养24、48、72 h后每孔加入MTT溶液50 μL,孵育4 h,加入二甲基亚砜200 μL,每组6个复孔,酶标仪调定波长为490 nm进行检测,以每组细胞光密度(OD)值反映各组细胞增殖能力,计算增值抑制率。增殖抑制率=[(1-实验组OD值)/对照组OD值]×100%。
1.6流式细胞术检测细胞周期 取培养48 h的细胞,以0.25%胰酶消化,1 500 r/min离心10 min,弃上清,PBS洗2次,加70%预冷乙醇溶液,振荡,4℃固定过夜。PBS洗2次,室温条件下加碘化丙啶(PI)30 μL/管染色20 min,上机检测各组细胞周期的分布情况。
1.7Transwell小室检测细胞侵袭能力 将50 mg/L的Matrige基质胶(1∶8稀释)平铺在孔径8 μm的Transwell小室聚碳酸滤膜的上室内表面,干燥过夜。在各组Lovo细胞培养48 h后,取约5×104个细胞置于Transwell的上室中,滴入无血清培养液重悬细胞,然后移至Transwell小室中层。培养24 h后,经PBS冲洗,多聚甲醛固定,结晶紫染色,显微镜下计数穿膜的细胞个数,实验独立重复6次,以视野内平均细胞数表示细胞侵袭能力。
1.8划痕实验检测细胞迁移能力 用记号笔在6孔板背面划多条直线,取培养48 h的各组细胞,每孔铺1×106个细胞,用1 mL枪头垂直于板底和直线划痕,记录宽度拍照。加入无血清DMEM培养基继续培养24 h,PBS冲洗3次记录细胞划痕宽度,实验独立重复6次,计算细胞划痕闭合率。划痕闭合率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
1.9TUNEL法检测细胞凋亡 取对数生长期的各组Lovo细胞,将1×106个细胞接种于6孔板中,经过0.1%Trition X-100透化后,加入3%H2O2200 μL,PBS漂洗后加入蛋白酶K灭活DNA和RNA,最后加入TUNEL工作液,恒温箱中避光孵育60 min。取出后经PBS冲洗3次加入DAPI反应液,反应20 min后冲洗封片。应用荧光显微镜观察细胞,绿色代表已凋亡细胞,蓝色代表存活细胞,实验独立重复6次。凋亡指数=各视野阳性细胞数/视野所有细胞总数×100%。
1.10Western blot法检测Gab1、VEGFR-2、PI3K、Akt、MMP-9、Bcl-2和Bax蛋白表达 取各组待测样品12 μL,蛋白Marker 5 μL,SDS-PAGE进行电泳,转膜,封闭,加入Gab1、VEGFR-2、PI3K、Akt、MMP-9、Bcl-2及Bax蛋白一抗(均为1∶1 000稀释),4℃孵育过夜,洗膜,加入二抗(1∶700稀释),室温孵育2 h,洗膜,ECL显像,用凝胶图像处理系统分析表达水平,实验独立重复6次。目的蛋白的相对表达量=目的蛋白的灰度值/β-actin的灰度值。
1.11统计学方法 采用SPSS 19.0软件对数据进行处理。符合正态分布的计量资料数据以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 白花蛇舌草-半枝莲药对组分制备结果 白花蛇舌草-半枝莲药对经乙酸乙酯萃取后得率为0.61%。UPLC分析结果显示,白花蛇舌草-半枝莲药对中主要含有对羟基苯乙酮、野黄芩苷、木犀草素和芹菜素4种化合物,符合白花蛇舌草-半枝莲药对乙酸乙酯组分成分。见图1。
2.2 4组细胞增殖抑制率变化 与对照组相比,培养24、48及72 h后,低、中、高剂量组细胞的增殖抑制率增加,呈剂量依赖性,差异有统计学意义(均P<0.05),见表1。
2.3 各组Lovo细胞周期分布变化 与对照组相比,低、中、高剂量组培养48 h后,G1期肿瘤细胞比例增加,S期和G2期细胞比例减少,且呈剂量依赖性(均P<0.05)。见图2、表2。
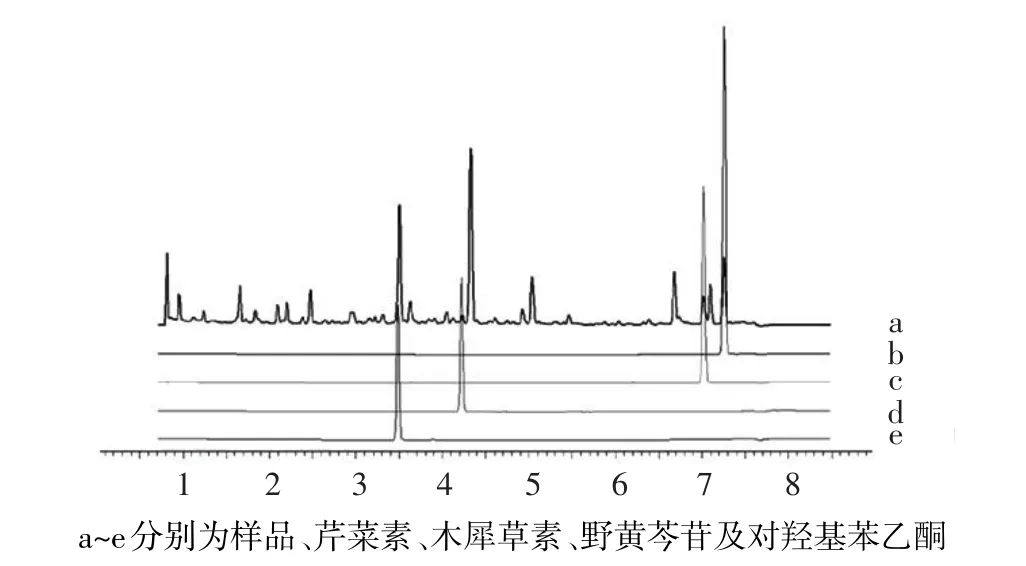
Fig.1 UPLC analysis of the components of Hedyotis diffusa-Sculellaria barbata图1 白花蛇舌草-半枝莲药对组分UPLC分析谱
Tab.1 The proliferation inhibition rates in the four groups of Lovo cells表1 4组Lovo细胞增殖抑制率变化 (n=6,±s)
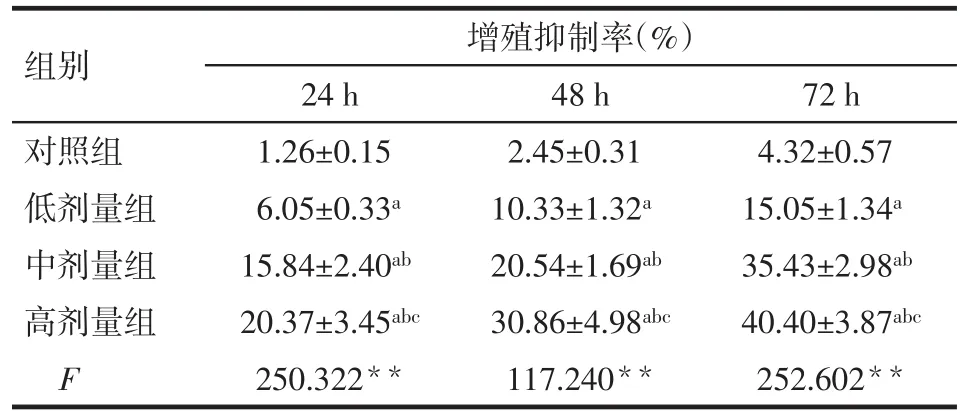
Tab.1 The proliferation inhibition rates in the four groups of Lovo cells表1 4组Lovo细胞增殖抑制率变化 (n=6,±s)
**P<0.01,a与对照组比较,b与低剂量组比较,c与中剂量组比较,P<0.05,表2~5同
增殖抑制率(%)组别对照组低剂量组中剂量组高剂量组F 24 h 1.26±0.15 6.05±0.33a 15.84±2.40ab 20.37±3.45abc 250.322**48 h 2.45±0.31 10.33±1.32a 20.54±1.69ab 30.86±4.98abc 117.240**72 h 4.32±0.57 15.05±1.34a 35.43±2.98ab 40.40±3.87abc 252.602**
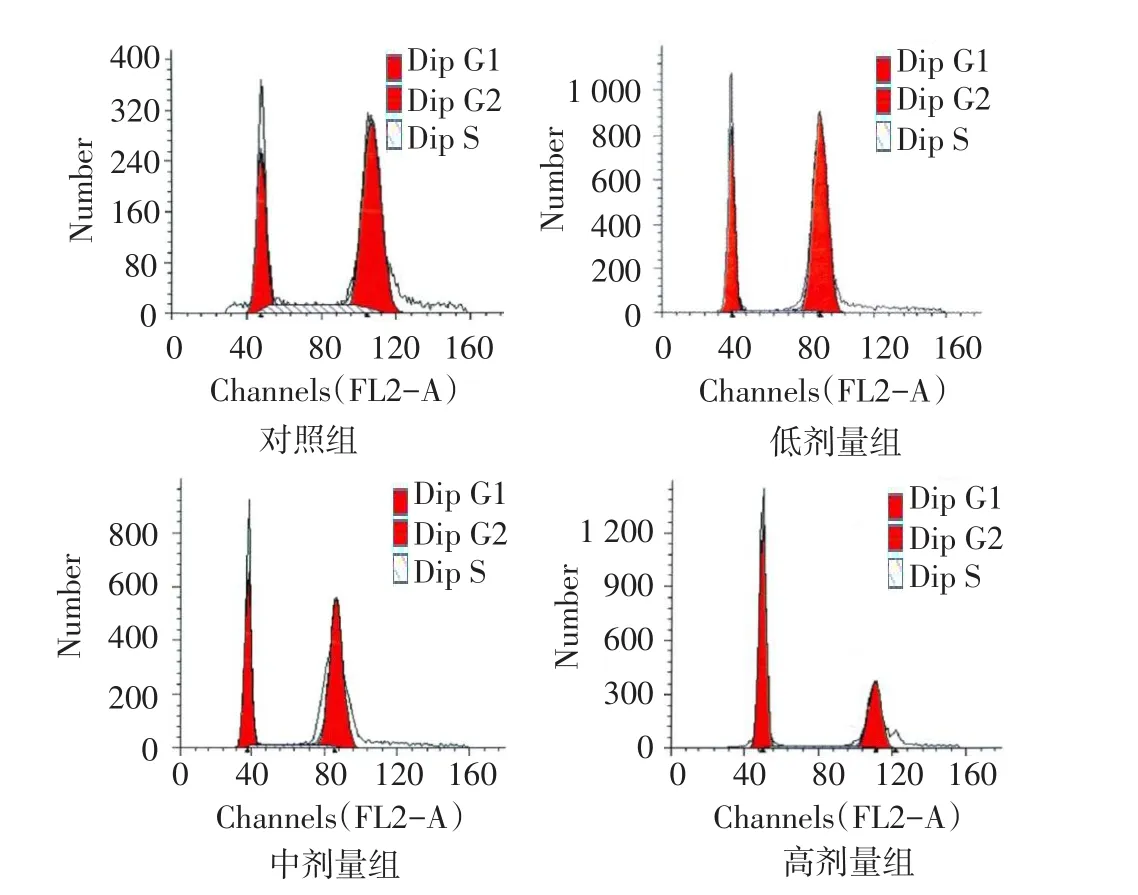
Fig. 2 The pictures of cell cycle distributions in the four groups of Lovo cells图2 4组Lovo细胞细胞周期分布图
2.4 4组Lovo细胞侵袭、迁移及凋亡水平的变化比较 与对照组相比,低、中、高剂量组培养48 h后侵袭细胞数和划痕闭合率明显减少,细胞凋亡指数增高,且呈剂量依赖性,差异有统计学意义(P<0.05),见表3、图3~5。
Tab.2 Changes of cell cycle distributions in the four groups of Lovo cells表2 4组Lovo细胞细胞周期分布变化 (n=6,%,±s)
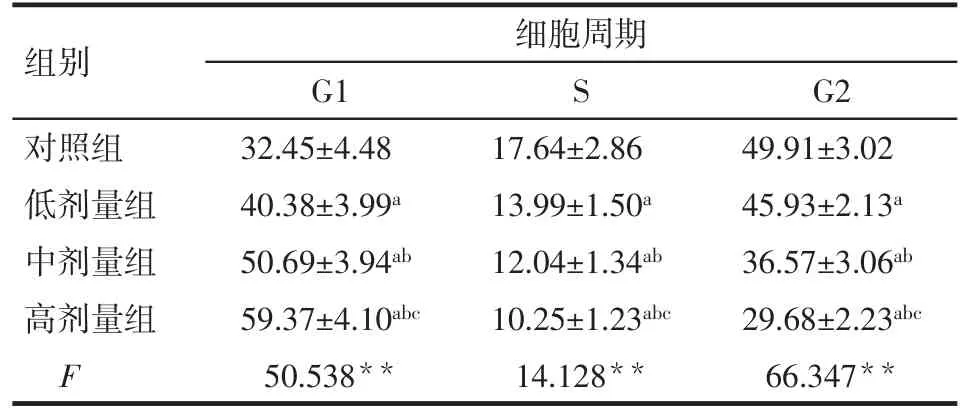
Tab.2 Changes of cell cycle distributions in the four groups of Lovo cells表2 4组Lovo细胞细胞周期分布变化 (n=6,%,±s)
组别对照组低剂量组中剂量组高剂量组F细胞周期G1 32.45±4.48 40.38±3.99a 50.69±3.94ab 59.37±4.10abc 50.538**S 17.64±2.86 13.99±1.50a 12.04±1.34ab 10.25±1.23abc 14.128**G2 49.91±3.02 45.93±2.13a 36.57±3.06ab 29.68±2.23abc 66.347**
Tab.3 Changes of invasive cell number,scratch closure rate and apoptosis index in the four groups of Lovo cells表3 4组Lovo细胞侵袭细胞数、划痕闭合率及凋亡指数变化 (n=6,±s)
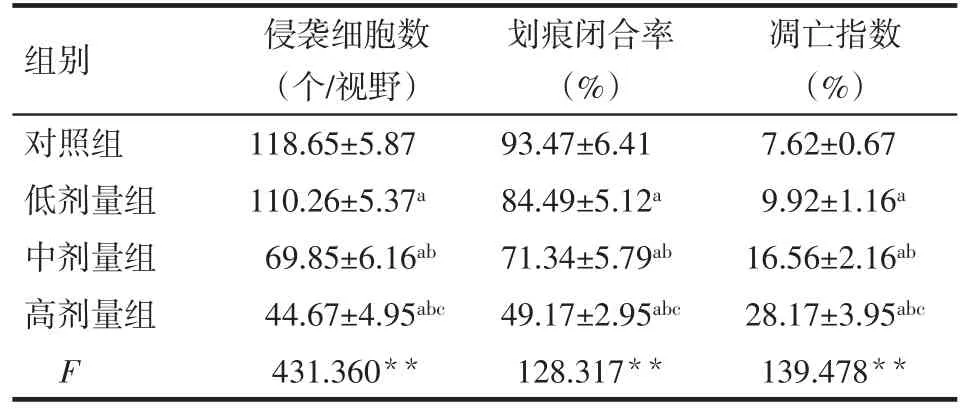
Tab.3 Changes of invasive cell number,scratch closure rate and apoptosis index in the four groups of Lovo cells表3 4组Lovo细胞侵袭细胞数、划痕闭合率及凋亡指数变化 (n=6,±s)
组别对照组低剂量组中剂量组高剂量组F侵袭细胞数(个/视野)118.65±5.87 110.26±5.37a 69.85±6.16ab 44.67±4.95abc 431.360**划痕闭合率(%)93.47±6.41 84.49±5.12a 71.34±5.79ab 49.17±2.95abc 128.317**凋亡指数(%)7.62±0.67 9.92±1.16a 16.56±2.16ab 28.17±3.95abc 139.478**
2.5 各组细胞Gab1、VEGFR-2、PI3K、Akt、MMP-9、Bcl-2和Bax蛋白表达检测结果 与对照组相比,低、中、高剂量组细胞中Gab1、VEGFR-2、PI3K、Akt、MMP-9及Bcl-2表达降低,Bax表达升高,呈剂量依赖性,差异有统计学意义(均P<0.05)。表4、5,见图6。
Tab.4 Expressions of Gab1,VEGFR-2,PI3K and Akt proteins in the four groups of Lovo cells表44组Lovo细胞Gab1、VEGFR-2、PI3K、Akt蛋白表达结果 (n=6,±s)

Tab.4 Expressions of Gab1,VEGFR-2,PI3K and Akt proteins in the four groups of Lovo cells表44组Lovo细胞Gab1、VEGFR-2、PI3K、Akt蛋白表达结果 (n=6,±s)
组别对照组低剂量组中剂量组高剂量组F Gab1/β-actin 1.15±0.11 0.72±0.07a 0.54±0.07ab 0.31±0.04abc 150.650**VEGFR-2/β-actin 0.91±0.10 0.72±0.07a 0.64±0.05ab 0.37±0.04abc 72.460**PI3K/β-actin 1.26±0.12 0.99±0.09a 0.76±0.08ab 0.54±0.04abc 95.084**Akt/β-actin 0.94±0.06 0.72±0.06a 0.59±0.09ab 0.39±0.06abc 55.984**
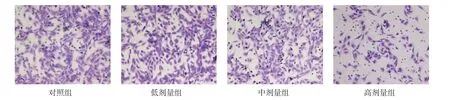
Fig.3 Changes of the invasion ability in the four groups of Lovo cells(×400)图3 4组Lovo细胞侵袭能力变化(×400)

Fig.4 Changes of the migration levels in the four groups of Lovo cells(×400)图4 4组Lovo细胞迁移能力变化(×400)
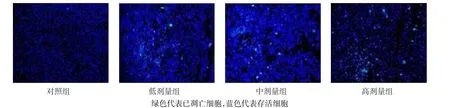
Fig.5 Changes of the apoptosis rate in the four groups of Lovo cells(TUNEL staining,×200)图5 4组细胞凋亡水平变化(TUNEL染色,×200)
3 讨论
王单单等[12]通过中药系统药理学分析平台,预估白花蛇舌草-半枝莲药对中19种成分可影响大肠癌细胞33个靶点及25条信号通路,有望成为大肠癌治疗的辅助药物。本实验采用0、10、30、50 mg/L的白花蛇舌草-半枝莲药对组分干预人结肠腺癌Lovo细胞,发现白花蛇舌草-半枝莲药对组分可增加Lovo细胞G1期比例,诱导细胞凋亡,并抑制Lovo细胞增殖、侵袭、迁移能力,且具有剂量依赖性。笔者推测白花蛇舌草-半枝莲药对组分可将Lovo细胞阻滞于G1期,抑制结肠腺癌Lovo细胞增殖;并通过诱导癌细胞的凋亡,降低其迁移和侵袭能力。
Tab.5 Expressions of MMP-9,Bcl-2 and Bax proteins in the four groups of Lovo cells表5 各组Lovo细胞MMP-9、Bcl-2及Bax蛋白表达 (n=6,±s)
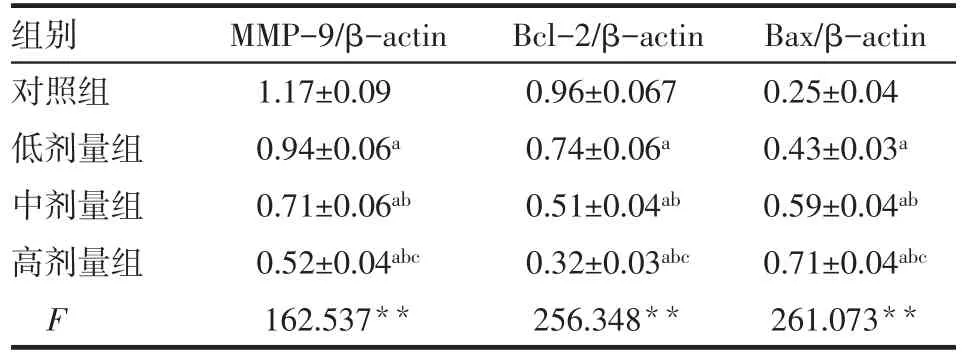
Tab.5 Expressions of MMP-9,Bcl-2 and Bax proteins in the four groups of Lovo cells表5 各组Lovo细胞MMP-9、Bcl-2及Bax蛋白表达 (n=6,±s)
组别对照组低剂量组中剂量组高剂量组F MMP-9/β-actin 1.17±0.09 0.94±0.06a 0.71±0.06ab 0.52±0.04abc 162.537**Bcl-2/β-actin 0.96±0.067 0.74±0.06a 0.51±0.04ab 0.32±0.03abc 256.348**Bax/β-actin 0.25±0.04 0.43±0.03a 0.59±0.04ab 0.71±0.04abc 261.073**
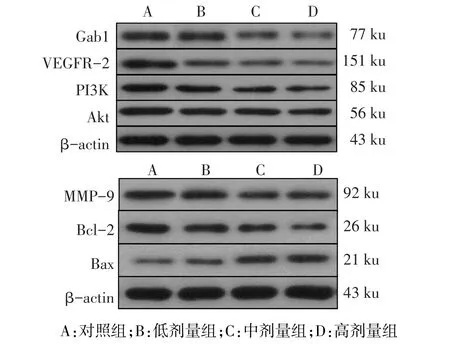
Fig.6 Electrophoretic diagram of Gab1,VEGFR-2,PI3K,Akt,MMP-9,Bcl-2 and Bax in the four groups of Lovo cells图6 4组Lovo细胞Gab1、VEGFR-2、PI3K、Akt、MMP-9、Bcl-2及Bax表达
Gab1是一种多底物适配蛋白,Gab1在N端附近具有高度保守的富含脯氨酸PH结构域,且含有多个SH2和SH3结合位点和Met偶联序列[13]。PH结构域能够结合细胞膜上的PIP3蛋白,将Gab1锚定在细胞膜内表面,进一步增加Gab1与受体相互作用的机会。SH2结合位点可以绑定包含YXXP序列的信号分子,如PI3K亚基p85、SHP2、PLC-γCrk,发挥生物效应[14]。Gab1与肿瘤特别是胃肠道肿瘤的发生、侵袭和转移密切相关[15]。Bai等[16]证实大肠癌组织中高表达Gab1,并且Gab1与患者癌组织分化和淋巴转移相关。VEGFR-2可以增加MMP-9的表达,降解细胞外基质(ECM)和基底膜的主要成分胶原Ⅳ,促进肿瘤细胞转移及侵袭能力,并与肿瘤血管和淋巴系统的生成有关[17-18]。PI3K/Akt信号通路通过多种机制调控体内肿瘤的生物学行为,与大肠癌细胞侵袭和凋亡、血管及淋巴管形成、肿瘤预后等密切相关[19-21]。Bcl-2是一种抗凋亡蛋白,Bax与Bcl-2同族,具有诱导肿瘤细胞凋亡作用,Bcl-2与Bax比例影响肿瘤细胞的凋亡走向[22]。Gab1可介导VEGFR-2激活PI3K/Akt信号通路,并增加PI3K/Akt通路的活化程度,促进细胞侵袭,而MMP-9是PI3K/Akt重要的下游靶蛋白[23-25]。
为了进一步探究白花蛇舌草-半枝莲对结肠腺癌Lovo细胞生物学影响的具体机制,笔者对Lovo细胞中Gab1/VEGFR-2/PI3K/Akt信号通路蛋白及MMP-9、Bax和Bcl-2的表达进行检测。发现白花蛇舌草-半枝莲药对组分低、中、高剂量组细胞中VEGFR-2、Gab1、PI3K、Akt、Bcl-2及MMP-9表达降低,Bax表达升高,呈剂量依赖性。结合Lovo细胞生物学行为实验结果,笔者分析认为白花蛇舌草-半枝莲药对组分可能通过抑制Gab1/VEGFR-2/PI3K/Akt信号通路表达,抑制下游MMP-9表达,使肿瘤细胞难以降解ECM和基底膜,削弱Lovo细胞侵袭和迁移能力;同时,PI3K/Akt通路的低表达,促使Bcl-2/Bax失衡,诱导细胞凋亡,与TUNEL检测结果一致。
综上所述,白花蛇舌草-半枝莲药对组分可抑制结肠腺癌Lovo细胞增殖、迁移及侵袭能力,并诱导细胞凋亡。其机制可能与阻滞肿瘤细胞分裂周期、抑制Gab1/VEGFR-2/PI3K/Akt信号通路有关。
