阳荷主要化学组分分析与抗菌活性评价研究
2020-10-22梁帅郑尧邓鑫韦斌刘芳任永申
梁帅,郑尧,邓鑫,韦斌,刘芳,任永申*
(1 中南民族大学 药学院,武汉430074;2 巴东县国昱药材种植专业合作社,巴东444300;3 湖北巴务相生态农业有限公司,巴东444300)
阳荷(Zingiberstriolatum)为姜科姜属多年生草本植物,又名洋姜、野良姜等,主要产于我国西南部至东南部地区,生长于林荫下、溪边[1].阳荷的药食两用历史久远,其根茎、幼嫩茎叶及花序均可食用,传统医学以其根茎入药[2].
阳荷富含红花红色素、花色素苷、膳食纤维、氨基酸、蛋白质和微量元素等,具有活血调经、祛痰止咳、解毒消肿、抗炎抗菌、抗氧化和降血糖作用,主治月经不调、痛经、跌打损伤、咳嗽气喘等疾病[3-7].在食品方面,已经开发了阳荷罐头、泡菜及阳荷汁饮料等产品,销往全国各地及日本、韩国等国家[8].但目前对阳荷主要药物活性成分如挥发油、黄酮、生物碱、多糖等功效作用的比较、阳荷产品质量标准等工作尚缺乏进一步研究,严重制约了其开发利用[9-11].
本研究根据中国药典中药材质量标准通则要求,测定了鲜品阳荷水分、灰分、总浸出物、总多糖、总黄酮和挥发油的含量,并采用HPLC-ELSD测定了阳荷总多糖中5种主要糖份的含量,比较了各类化学成分抑菌作用的抑菌圈直径与MIC和MBC,客观评价了各类化学组分抗菌活性差异,为阳荷质量控制及开发利用提供新的科学依据.
1 仪器和试剂
1.1 仪器
电子天平(AUW-120D,日本岛津);高效液相色谱仪(Dionex Ultimate 2000,美国赛默飞); 蒸发光散射检测器(ELSD2000ES,美国Alltech);酶标仪(Multiskan Sky,美国赛默飞)和超声波清洗仪(KQ5200B,昆山市超声仪器);旋转蒸发仪(RE 52-98,上海亚荣).
1.2 药品及试剂
新鲜阳荷(采自湖北恩施巴东县),经中南民族大学廖矛川教授鉴定为姜科植物阳荷(Zingiberstriolatum)的根茎.
小檗碱(批号:Y31J9H67024,纯度>98%),购于上海源叶生物科技;芦丁(批号:20170224,纯度>98%),D-无水葡萄糖(批号:20171221,纯度>98%),果糖(批号:20171109,纯度>98%),蔗糖(批号:20180105,纯度>98%),半乳糖(批号:0171228,纯度>98%),木糖(批号:20170224,纯度>98%),购于上海金穗生物科技;乙腈、甲醇为色谱纯,水为超纯水;其余试剂均为分析纯,购于国药集团.
2 方法和结果
2.1 常规项目检查
根据《中华人民共和国药典》(2015版)一部附录要求,对阳荷样品进行水分、总灰分、酸不溶性灰分、水浸出物和70%醇浸出物测定[12].阳荷鲜品样品在6 h内含水量变化如图1,阳荷鲜品中水分的平均含量约为94.12%;阳荷烘干品总灰分平均含量为4.51%,酸不溶性灰分平均含量为1.55%;阳荷烘干品水浸出物平均含量为28.22%,70%醇浸出物平均含量为38.90%(表1).
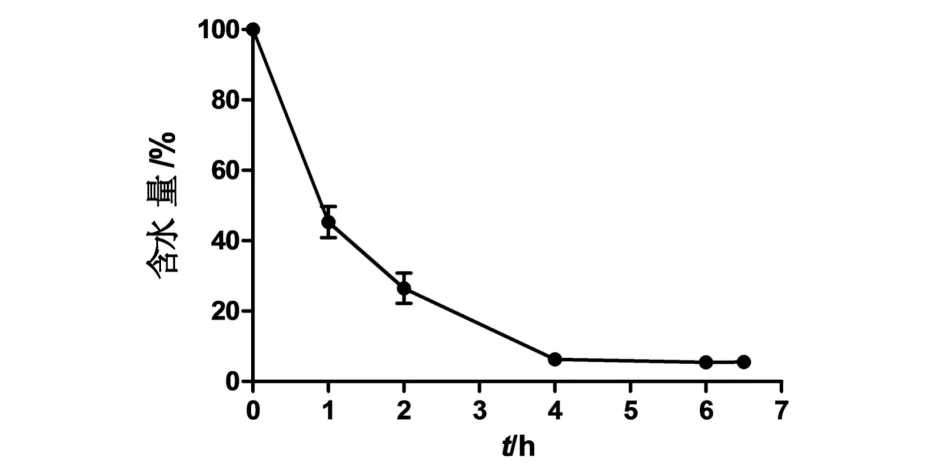
图1 鲜品阳荷水分含量

表1 阳荷中水分、灰分和浸出物含量(n=6)
2.2 阳荷样品中总多糖含量测定
2.2.1 阳荷多糖供试品溶液制备
5 g阳荷样品3份,按料液比1∶30(g∶mL)加入蒸馏水,温度70 ℃,300 W超声功率提取0.5 h,分离煎出液,药渣提取3次,合并各次提取液,浓缩至规定浓度,加入4倍体积的80%乙醇,沉淀16 h,离心,弃上清液,取沉淀用水溶解,作为阳荷多糖供试品溶液.
2.2.2 显色与测定方法
取对照品浓度为1 mg/mL的D-无水葡萄糖标准溶液各1.0 mL,加5%苯酚溶液1 mL,缓慢加入5 mL浓硫酸,摇匀,90 ℃热水浴30 min,冷却至室温.以蒸馏水做空白对照,萘酚-浓硫酸显色,500 nm波长下测定吸光度.
2.2.3 专属性实验
取c阴性对照蒸馏水及供试品溶液各1.0 mL,按“2.2.2”项下显色与测定,以紫外分光光度计在200~600 nm范围内扫描.结果显示,对照品及供试品溶液均在500 nm波长处有最大吸收,阴性对照无吸收.
2.2.4 D-无水葡萄标准品配制及标准曲线的绘制
D-无水葡萄糖对照品10.00 mg加纯化水配置成1 mg/mL的标准溶液.取对照品溶液1.0、2.0、3.0、4.0、5.0 mL,按“2.2.2”项下方法操作,在λmax=500 nm波长处分别测定吸光度(A).以吸光度值为纵坐标Y,浓度(mg/mL)为横坐标X,绘制标准曲线:Y=8.7176X+0.112(r=0.9995),浓度在0.04~0.2 mg/mL范围内呈线性关系.
2.2.5 方法学考察
精密度试验:取系列浓度对照品溶液中的任意一份,按“2.2.2”方法处理后,用紫外分光光度计于500 nm处扫描5次,计算RSD值为0.68%,表明仪器的精密度良好.
稳定性试验:供试品溶液按“2.2.2”项下的操作方法处理后,分别在0、0.5、1.0、1.5、2 h测吸光度,计算RSD值为0.57%,表明样品溶液在2 h内稳定性良好.
重复性试验:制备份供试品溶液,按“2.2.2”项下的操作方法处理后,分别测定吸光度,计算RSD值为0.55%,表明该含量测定方法重复性良好.
2.2.6 加样回收率试验
称量6份已知含量的阳荷药材粉末,按“2.2.1”项制备6份供试品溶液,分别加入相同量的D-无水葡萄糖对照品溶液测定,阳荷多糖的平均加样回收率为99.31%,RSD为0.98%(表2).表明该含量测定方法的准确度良好可靠.

表2 阳荷总多糖的加样回收率实验结果(n=6)
2.2.7 阳荷总多糖供试品测定
结果表明阳荷总多糖平均含量为8.39%(表3),RSD=0.81%.

表3 阳荷中总多糖、总黄酮、总生物碱和挥发油含量
2.3 阳荷总黄酮含量测定
2.3.1 阳荷总黄酮供试品溶液制备
5 g的阳荷样品3份,按料液比1∶30(g∶mL)加入甲醇,浸提温度70 ℃,在300 W超声功率提取0.5 h,分离煎出液,药渣依次提取数次,合并,浓缩至规定浓度,离心,取上清液作为供试品溶液.
2.3.2 显色与测定方法
取供试品溶液1.0 mL置于25 mL容量瓶中,加60%乙醇5.0 mL,混匀,加入5%的亚硝酸钠溶液1.0 mL,摇匀,静置6 min,再加入4%氢氧化钠溶液10.0 mL,最终用60%的乙醇溶液定容至25 mL,摇匀,静置15 min,60%乙醇作空白对照,同条件下显色.
2.3.3 专属性实验
取对照品、阴性对照及供试品溶液各1.0 mL,按“2.3.2”显色与测定,以紫外分光光度计在200~600 nm范围内扫描.结果显示,对照品及供试品溶液均在510 nm波长处有最大吸收.
2.3.4 芦丁标准品配制和标准曲线的绘制
芦丁对照品10.00 mg,加甲醇配置成1 mg/mL的标准溶液.取对照品溶液1.0、2.0、3.0、4.0、5.0 mL,按“2.3.2”方法显色,在510 nm波长处测吸光度(A).以吸光度值为纵坐标Y,浓度(mg/mL)为横坐标X,绘制标准曲线.标准曲线为回归方程为Y=17.921X+0.0056(r=0.9999),芦丁浓度在0.04~0.2 mg/mL范围内呈线性关系.
2.3.5 方法学考察
精密度、稳定性和重复性试验:按“2.2.5”方法测定,按“2.3.2”方法显色,RSD值分别为0.85%、0.57%和0.41%,表明仪器的精密度、稳定性和重复性良好.
2.3.6 加样回收率试验
6份已知含量的阳荷粉末,按“2.3.1”方法制备6份供试品溶液,分别加入相同量的芦丁对照品溶液,按照“2.3.2”方法测定,阳荷的平均加样回收率为99.52%(表4).

表4 阳荷总黄酮的加样回收率实验结果(n=6)
2.3.7阳荷总黄酮供试品总黄酮测定
测定结果:总黄酮平均含量为8.31%(表3),RSD=0.83%.
2.4 阳荷总生物碱含量测定
2.4.1 阳荷总生物碱供试品溶液制备
称取5 g的阳荷样品3份,按1∶30(g∶mL)的料液比加入0.5%盐酸,50 ℃,300 W超声功率提取0.5 h,抽滤,取滤液,药材残渣用0.5%盐酸溶液多次冲洗抽滤,合并滤液.滤液避光冷却静置至室温,用10%NaOH溶液调节pH至11,将溶液移至分液漏斗后用氯仿萃取3次,每次40 mL,合并氯仿层,回收后得总生物碱.
2.4.2 显色与测定方法
取供试品溶液各1.0 mL,加入枸橼酸-磷酸氢二钠缓冲溶液(pH值4.5)5.0 mL,加入溴甲酚绿溶液2.0 mL,摇匀,以三氯甲烷10 mL萃取,取萃取液,以随行试剂为空白,在410 nm波长处测定吸光度.
2.4.3 专属性实验
取对照品、阴性对照(氯仿)及供试品溶液各1.0 mL,按“2.4.2”方法显色与测定,以紫外分光光度计在200~600 nm范围内扫描.结果显示,对照品及供试品溶液均在410 nm波长处有最大吸收,阴性对照无吸收.
2.4.4 小檗碱标准品配制及标准曲线的绘制
小檗碱对照品10.00 mg加甲醇配置成1 mg/mL的标准溶液.取对照品溶液1.0、2.0、3.0、4.0、5.0 mL,按“2.4.2”方法显色,在λmax=410 nm波长处分别测吸光度(A).以吸光度值为纵坐标Y,浓度(mg/mL)为横坐标X,绘制标准曲线,得到线性回归方程为:Y=10.531X+0.0044(r=0.9971),小檗碱浓度在0.04~0.2 mg/mL范围内呈线性关系.
2.4.5 方法学考察
精密度、稳定性和重复性试验:按“2.2.5”和“2.4.2”方法测定,计算RSD值分别为0.77%、0.18%和0.55%,表明仪器的精密度、稳定性和重复性良好.
2.4.6 加样回收率试验
取6份已知含量的阳荷粉末,按“2.4.1”方法制备6份供试品溶液,分别加入相同量的小檗碱对照品溶液,按照“2.4.2”方法测定,结果阳荷的平均加样回收率为98.92%(表5),RSD为0.87%.
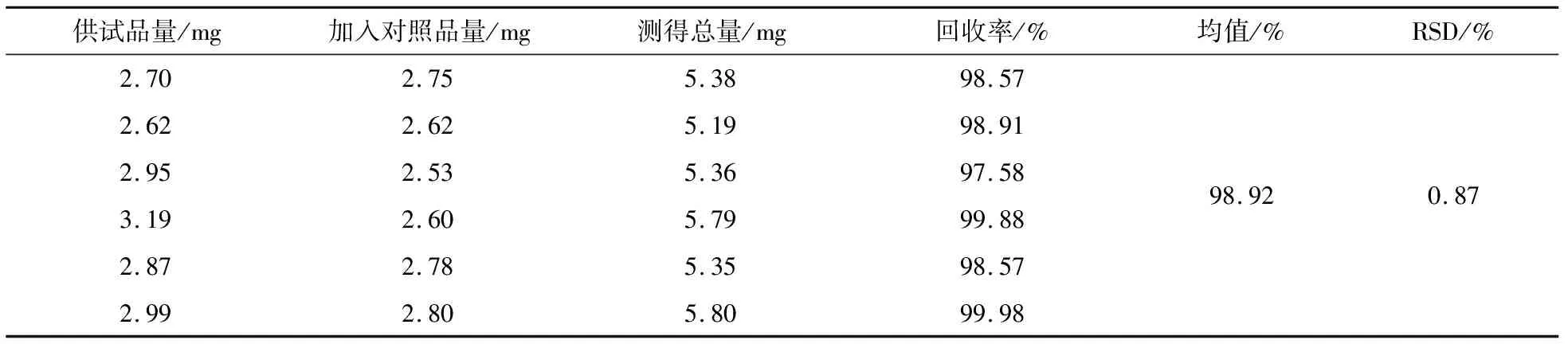
表5 阳荷总生物碱的加样回收率实验结果(n=6)
2.4.7 阳荷总生物碱供试品测定
测定结果:总生物碱平均含量为:0.27%(表3),RSD=0.76%.
2.5 阳荷挥发油的含量测定
2.5.1 阳荷挥发油供试品溶液制备
3份250 g的鲜品阳荷匀浆后,以1∶3(g∶mL)的料液比加入纯水,搅拌均匀,分别超声60 min,蒸馏,时间4 h,收集馏出液,用石油醚萃取挥发油,加入适量无水硫酸钠(不出现结晶为宜),回收石油醚完全后计算提取率.
2.5.2 供试品测定结果
测定结果:总挥发油平均含量为:0.039%(表3),RSD=1.07%.
2.6 HPLC-ELSD定量测定阳荷总多糖中单糖及二糖组成和含量
2.6.1 阳荷总多糖供试品制备
1 mg纯化后的阳荷多糖用超纯水配置成1.0 mg/mL溶液,9000 r/min,4 ℃离心20 min,取上清液,用滤纸进行1次抽滤得到多糖溶液.用蒸馏水稀释100倍,然后以0.45 μm孔径的微孔滤膜滤液供HPLC-ELSD 分析.
2.6.2 色谱条件
色谱柱:GRACE Prevail Carbohydrate糖分析柱(4.6 mm×250 mm,5 μm);流动相,乙腈∶水(72∶28,v/v);流速:1.0 mL/min;柱温:30 ℃;ELSD漂移管温度:100 ℃;氮气为辅气,流量:1.8 L/min;雾化温度:115 ℃;分析时间:20 min;进样体积:20 μL.
2.6.3 方法学考察
标准曲线:按试验方法分别对果糖、葡萄糖、蔗糖、木糖和半乳糖对照品溶液系列进行测定,其线性范围、线性回归方程、相关系数见表7.
精密度、稳定性和重复性试验:按“2.2.5”和“2.6.2”方法测定,RSD值分别为0.15%、1.03%和0.36%,表明仪器的精密度、稳定性和重复性良好.
2.6.4 加样回收率试验
称取制备得到的阳荷多糖6份,分别加入一定量的果糖、葡萄糖、蔗糖、木糖和半乳糖对照品溶液,按试验方法制备供试品溶液,用HPLC-ELSD测定,计算加样回收率,测定结果见表6,加样回收率在99.7%~101%之间.
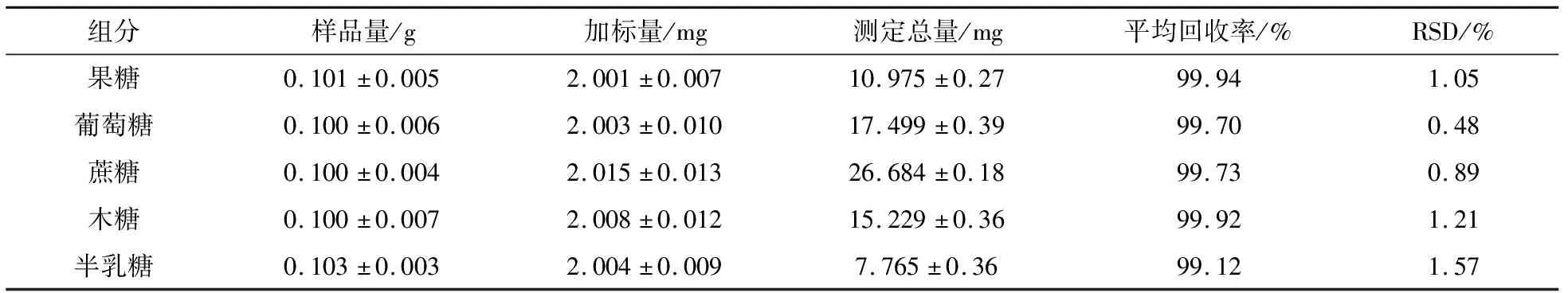
表6 五种糖组分的加样回收率(n=6)
2.6.5 供试品含量测定
如图2所示.通过HPLC-ELSD检测共鉴定出5种糖:葡萄糖、果糖、蔗糖、木糖和半乳糖,含量分别为:8.98%、15.55%、24.75%、13.22%、5.78%(表7).

表7 阳荷多糖中葡萄糖、果糖、蔗糖、木糖和半乳糖的含量
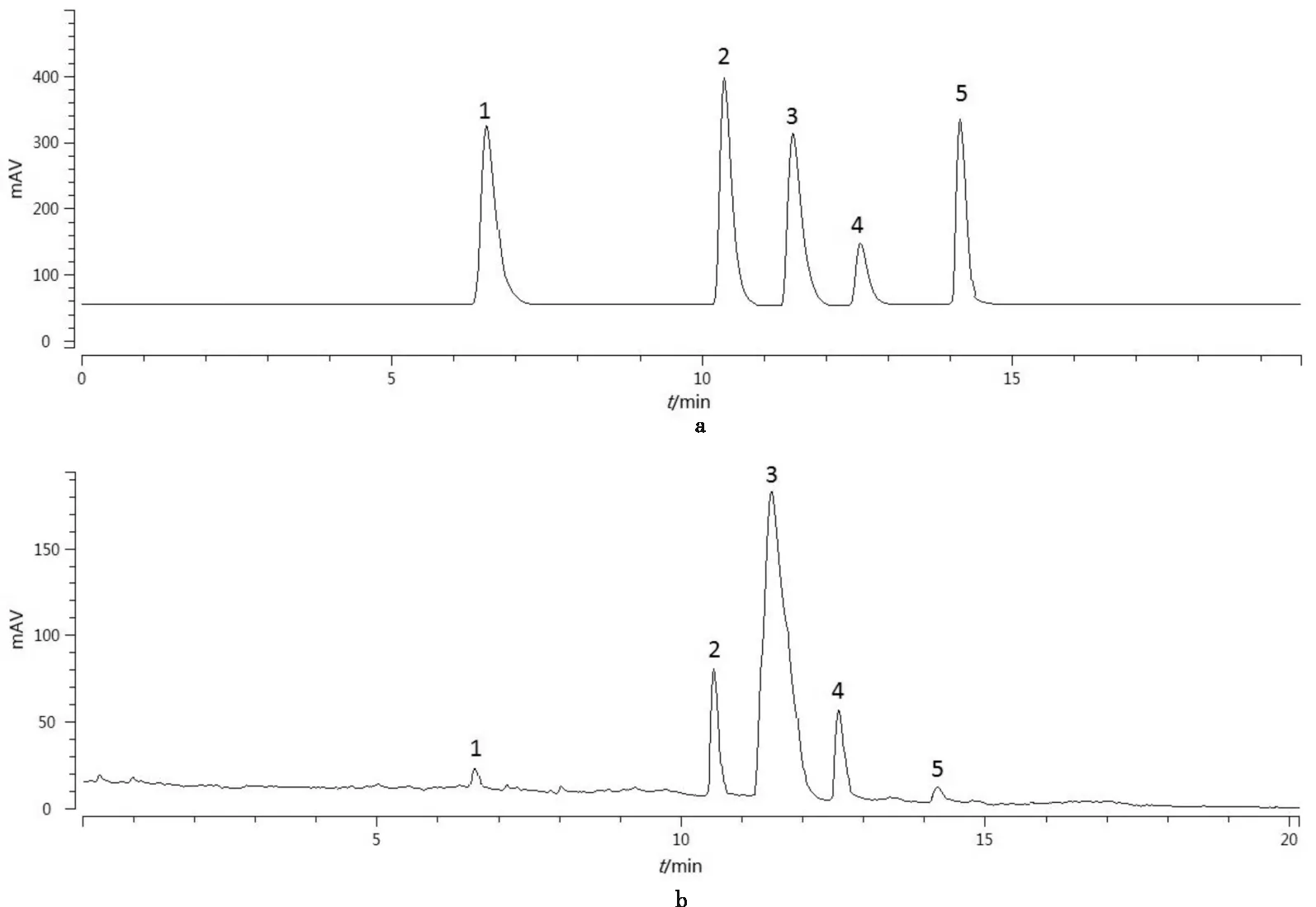
(1)果糖;(2)葡萄糖;(3)蔗糖;(4)木糖;(5)半乳糖
2.7 阳荷6种组分抗菌活性检测
2.7.1 阳荷6种不同提取物的制备
阳荷水提物、醇提物、总多糖、总黄酮、总生物碱和挥发油各100.0 mg,用适量DMSO溶解,配制成初始质量浓度为100 mg/mL的高浓度药物原液.以下所有操作均在无菌条件下进行.
2.7.2 细菌培养
用划线法将冷冻保存的金色葡萄球菌供试菌种接于相应的固体培养基上,于37 ℃温箱培育18~24 h.用无菌生理盐水稀释后经麦氏比浊管比浊,制成含3×108cfu/mL的菌悬液.
2.7.3 抗菌活性测定(滤纸片法)
将滤纸片(直径6 mm)分别在药物原液和空白对照溶液中浸渍后取出,每张纸片含待测药物分别为10 mg,空白对照为DMSO.取0.1 mL菌液,均匀涂布整块MH琼脂培养基表面,室温放置3~5 min后,贴加含药纸片,37 ℃恒温恒湿培养箱培养18~24 h,测定其纸片周围抑菌圈直径的大小,重复测定3次.
2.7.4 MIC测定
阳荷6种不同提取物,用相应量的10%DMSO液体肉汤培养基充分溶解成100 mg/mL药物,按二倍稀释法稀释成50、25、12.5、6.125和3.625 mg/mL无菌样品浓度.96孔板中每孔加入100 μL MH液体培养基、50 μL的样液、50 μL的菌液,设定空白为含有10%DMSO的肉汤液体培养基,混匀.在37 ℃恒温箱培养18~24 h后,加入30 μL浓度为30%的碘硝基四唑紫(INT),37 ℃恒温箱培养1 h后显色,以不显示紫色微孔的终浓度为MIC.
2.7.5 MBC的测定
分别从各提取物MIC以及大于MIC的孔中吸取培养液50 μL转接于150 μL的培养基中,37 ℃恒温箱中培养18~24 h,每孔加入30 μL浓度为30%的INT,37 ℃恒温箱培养1 h后显色,不显示紫红色微孔的终浓度为样品的MBC.
2.7.6 6种提取物的MIC和MBC检测结果
水浸出物、醇浸出物、总多糖、总生物碱、总黄酮和挥发油的MIC分别为12.50、12.50、50.00、12.50、12.50、6.25 mg/mL,MBC分别为25.00、12.50、50.00、25.00、12.50、6.25 mg/mL(表8).结果表明,阳荷6种不同提取物均有一定的抗菌活性,在相同浓度下,挥发油的抑菌效果最好,其次是醇提取物,最后是总多糖.
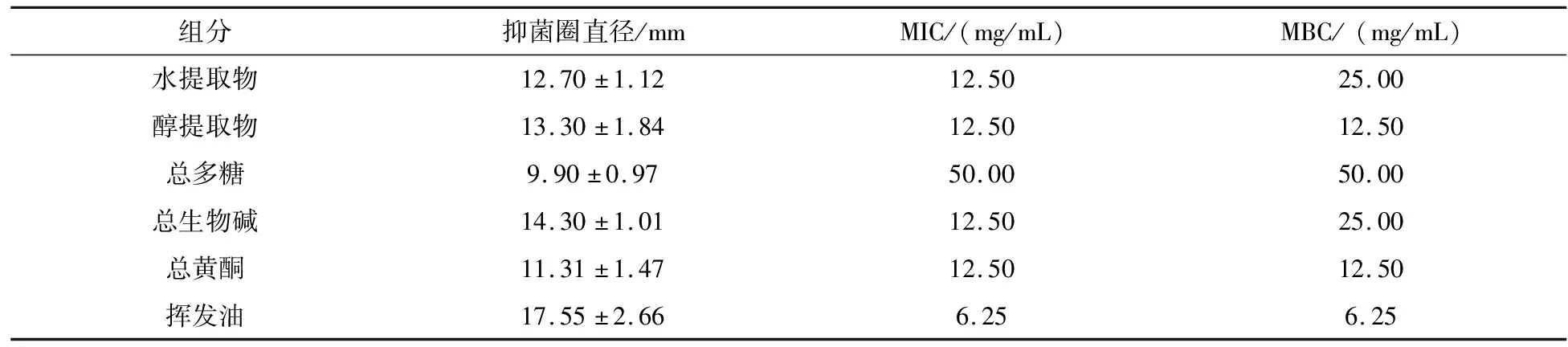
表8 阳荷水提取物、醇提取物、总多糖、总生物碱、挥发油和总黄酮MIC和MBC测定结果(n=3)
3 结语
研究表明,鲜品阳荷水分含量约为94.12%,阳荷中含有总多糖、总黄酮、总生物碱和挥发油等化学组分.上述组分抑菌活性的检测结果表明各组分均具有一定的抗菌活性,其中挥发油抗菌活性最强、总生物碱次之、多糖抗菌活性较弱,这与相关报道基本一致[13].因此阳荷作为药食两用植物,特别是夏季食用后可以起到调节肠道菌群、减少微生物感染的作用.研究为阳荷作为具有抗菌作用产品的开发提供了科学依据,但其发挥抗菌作用的主要活性成分尚需深入研究[14].
本研究建立阳荷总多糖、总黄酮、总生物碱、挥发油和5种糖的含量测定方法,比较了各化学组分的抗菌活性,初步建立了科学可行的阳荷质量控制方法,为阳荷的深入研究与开发应用提供了一定的科学依据.
