黄连内生真菌Fusarium tricinctum发酵液化学成分研究
2020-10-22艾洪莲叶可吕晓张娴杨会祥李正辉
艾洪莲,叶可,吕晓,张娴,杨会祥,李正辉
(中南民族大学 药学院,武汉 430074)
药用植物内生真菌是寻找新型活性成分的重要潜在资源.内生真菌除可产生与宿主植物相同或相似活性成分,还表现出与药用植物具有协同互作等多种生物学功能,为解决珍稀濒危药用植物资源保护和可持续利用提供了新的思路[1].黄连是毛茛科植物黄连(Coptischinensis)、三角叶黄连(Coptisdeltoidea)或云连(Coptisteeta)的干燥根茎[2].从黄连中提取的小檗碱类成分有着广泛的药理活性,而黄连(Coptischinensis)是主要来源.目前,野生黄连资源日趋匮乏[3],人工种植周期太长、组织培养技术尚不成熟.
本课题组在研究黄连内生真菌多样性的基础上,选取一株优势内生真菌Fusariumtricinctum,并对其发酵液的化学成分进行了初步研究.经过发酵液浓缩、乙酸乙酯萃取、反复柱层析、高效液相分析制备后,从该菌的代谢产物中分离得到10个化合物单体(图1).
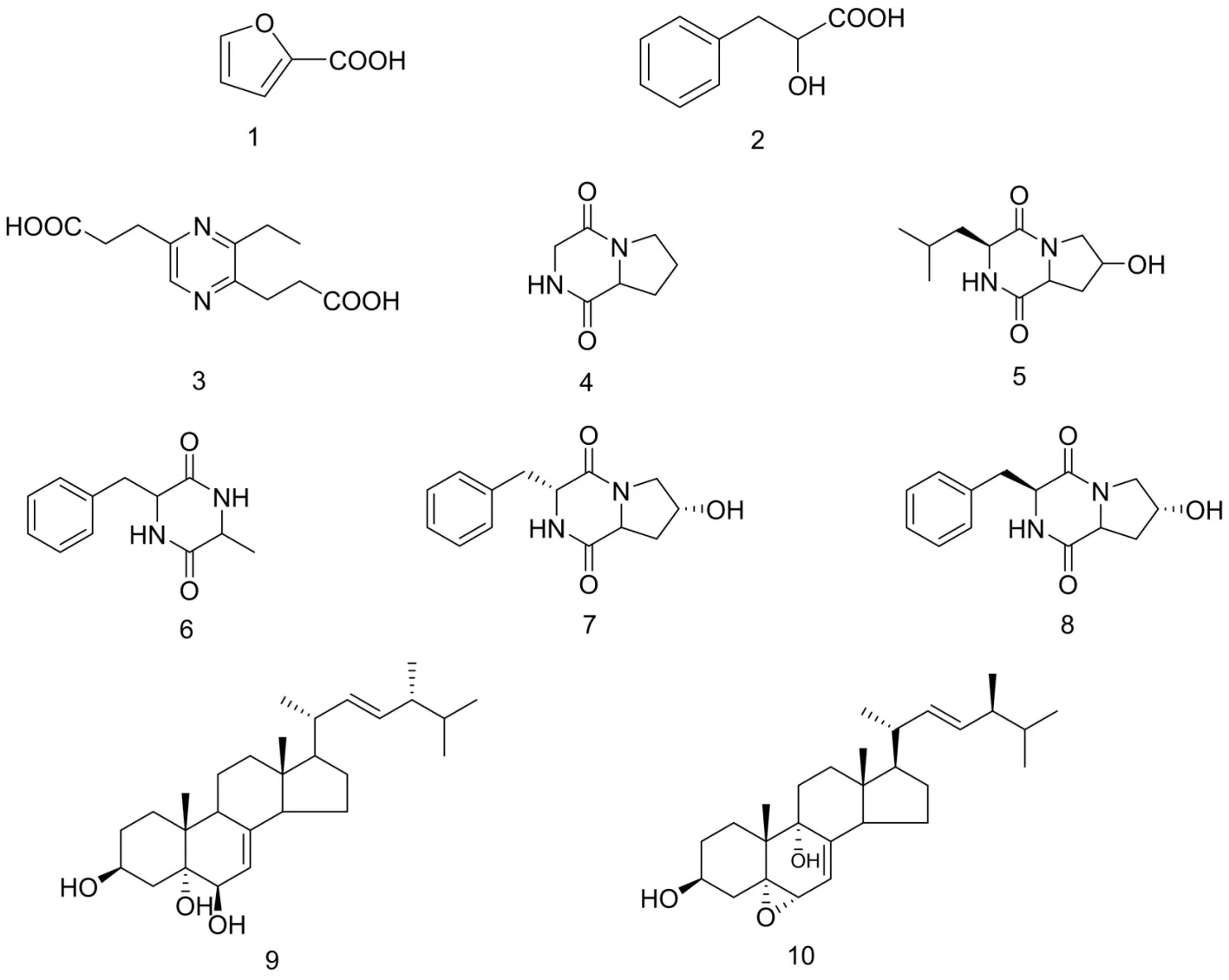
图1 化合物1~10的结构式
1 实验部分
1.1 仪器与材料
核磁共振波谱仪(德国Bruker公司,AM600型),其中1H NMR在600 MHz下测定,13C NMR在150 MHz下测定.
柱色谱材料:柱色谱用硅胶(80~100目和200~300目)与GF254TLC板(青岛海洋化工厂);Sephadex-LH 20(瑞典Amersham biosciences公司);反相材料Chromatorex(40~75 μm)(日本Fuji Silysia公司);分析型HPLC为Agilent 1260,色谱柱为Agilent Zorbax SB-C18柱(4.6 mm×150 mm),径粒为5 μm;制备型HPLC为Agilent 1260,色谱柱为Agilent Zorbax SB-C18柱(9.4 mm×150 mm),径粒为5 μm.显色方法为紫外灯下波长254 nm和365 nm处观察荧光,香草醛溶液及10%硫酸乙醇溶液显色剂加热显色.
1.2 发酵培养
采用液体培养方法.培养基:葡萄糖5%,猪肉胨蛋白0.15%,KH2PO4和MgSO4各0.05%;培养条件:24 ℃;转速 150 r/min;暗培养20 d.过滤后得到发酵液21 L.
1.3 提取分离
发酵液经浓缩后,用乙酸乙酯反复萃取3次,将萃取液合并浓缩.菌丝体经等比例氯仿甲醇混合溶液浸泡3次,合并后浓缩;共得到浸膏113 g.浸膏经正相硅胶柱层析(氯仿-甲醇:100∶0→0∶100)梯度洗脱得到6个组分(A~E).组分C经过反相中压(水-甲醇:100∶0→0∶100)分离,用薄层层析色谱检测,浓缩得到5个亚组分C1~C5.组分C3经正相硅胶柱层析(氯仿-甲醇)分离得到6个组分,C3d和C3e经过Sephadex-LH 20(甲醇)和制备型HPLC(乙腈-水和甲醇-水)分离得到化合物1~3.组分D经过反相中压(水-甲醇:100∶0→0∶100)分离,用薄层层析色谱检测,浓缩得到10个亚组分D1~D10.组分D4经过正相硅胶柱层析(氯仿-甲醇:100∶0→0∶100)分离得到7个组分,D4g和D4f经过Sephadex-LH 20(甲醇)和制备型HPLC(乙腈-水和甲醇-水)分离得到化合物4~8.组分D8经过正相硅胶柱层析(石油醚-丙酮:100∶0→0∶100)和制备型HPLC(乙腈-水和甲醇-水)分离得到化合物9和10.
2 结构鉴定
化合物1:分子式C5H4O3,无色针晶.1H NMR(CD3OD,600 MHz): δH7.72(1H,m,H-3),7.20(1H,dd,J=3.5,1.0 Hz,H-5),6.58(1H,dt,J=3.5,2.0 Hz,H-4).13C NMR(CD3OD,150 MHz): δC161.9(C-1),147.9(C-5),146.5(C-2),118.9(C-3),112.9(C-4).以上数据与文献[4]数据基本一致.故化合物1被确定为α-呋喃甲酸.
化合物2:分子式C9H10O3,白色颗粒状粉末.1H NMR(CD3OD,600 MHz): δH7.26(4H,m,H-Ph),7.19(1H,m,H-Ph),4.30(1H,br.s,H-2),3.11(1H,dd,J=13.8,3.8 Hz,H-3a),2.88(1H,dd,J=13.8,8.0 Hz,H-3b).13C NMR(CD3OD,150 MHz): δC178.0(C-1),139.7(C-4),130.6(C-5,9),129.2(C-6,8),127.4(C-7),73.3(C-2),41.7(C-3).以上数据与文献[5]数据基本一致.故化合物2被确定为2-羟基-3-苯基丙酸.
化合物3:分子式C10H12N2O4,黄色油状.1H NMR(CD3OD,600 MHz): δH8.25(1H,s,H-6),3.09(2H,t,J=7.20 Hz,H-7),3.04(2H,t,J=7.30 Hz,H-10),2.88(2H,q,J=7.50 Hz,H-13),2.77(2H,t,J=7.20 Hz,H-8),2.74(2H,t,J=7.30 Hz,H-11),1.29(3H,t,J=7.50 Hz,H-14).13C NMR(CD3OD,150 MHz): δC177.2(C-9),176.9(C-12),157.0(C-3),153.8(C-5),152.1(C-2),141.5(C-6),34.1(C-11),33.0(C-8),30.6(C-10),29.3(C-7),28.1(C-13),12.9(C-14).以上数据与文献[6]数据基本一致.故化合物3被确定为3-乙基-2,5-二丙酸哌嗪.
化合物4:分子式C7H9N2O2,白色无定形固体.1H NMR(CD3OD,600 MHz): δH4.24(1H,ddd,J=9.1,6.6,2.2 Hz,H-6),4.11(1H,dd,J=16.8,2.2 Hz,H-3a),3.74(1H,d,J=16.8 Hz,H-3b),3.54(2H,m,H-9),2.32(1H,m,H-7a),2.03(1H,m,H-7b),1.95(2H,m,H-8).13C NMR(CD3OD,150 MHz): δC172.0(C-5),166.4(C-2),59.8(C-6),46.9(C-3),46.3(C-9),29.3(C-7),23.2(C-8).以上数据与文献[7]数据基本一致.故化合物4被确定为环-(甘氨酸-L-脯氨酸).
化合物5:分子式C11H19N2O3,白色粉末.1H NMR(CD3OD,600 MHz): δH4.53(1H,dd,J=11.1,6.5 Hz,H-6),4.47(1H,t,J=4.4 Hz,H-8),4.18(1H,m,H-3),3.66(1H,dd,J=12.8,4.4 Hz,H-9a),3.44(1H,d,J=12.8 Hz,H-9b),2.28(1H,dd,J=13.3,6.5 Hz,H-7a),2.09(1H,ddd,J=13.3,11.1,4.4 Hz,H-7b),1.92(1H,m,H-10a),1.88(1H,m,H-11),1.52(1H,ddd,J=12.8,7.6,4.8 Hz,H-10b),0.97(3H,d,J=6.4 Hz,H-13),0.96(3H,d,J=6.4 Hz,H-12).13C NMR(CD3OD,150 MHz): δC173.1(C-5),169.0(C-2),69.1(C-8),58.7(C-6),55.1(C-3),54.5(C-9),39.3(C-10),38.1(C-7),25.7(C-11),23.3(C-13),22.1(C-12).以上数据和文献[8]数据基本一致.故化合物5被确定为环-(L-4-羟基脯氨酸-L-亮氨酸).
化合物6:分子式C12H14N2O2,白色结晶.1H NMR(CD3OD,600 MHz): δH7.30(2H,m,H-11,13),7.26(1H,m,H-12),7.21(2H,m,H-10,14),4.31(1H,ddd,J=4.8,3.8,1.3 Hz,H-3),3.75(1H,qd,J=7.0,1.3Hz,H-6),3.28(1H,dd,J=13.8,3.8 Hz,H-8a),2.85(1H,dd,J=13.8,4.8 Hz,H-3b),0.51(3H,d,J= 7.0 Hz,H-7).13C NMR(CD3OD,150 MHz): δC170.6(C-5),168.5(C-2),139.6(C-9),131.7(C-11,13),129.5(C-10,14),128.3(C-12),57.3(C-3),51.6(C-6),40.3(C-8),20.4(C-7).以上数据和文献[9]数据基本一致.故化合物6被确定为环-(苯丙氨酸-丙氨酸).
化合物7:分子式C14H14N2O2,黄色无定形固体.1H NMR(CD3OD,600 MHz): δH7.30(3H,m,H-13,14,15),7.18(2H,m,H-12,16),4.22(2H,m,H-3,8),3.60(1H,dd,J=12.4,3.8 Hz,H-9a),3.28(1H,dd,J=12.4,6.0 Hz,H-9b),3.19(1H,dd,J=13.7,5.1 Hz,H-10a),3.00(1H,dd,J=13.7,4.8 Hz,H-10b),2.78(1H,t,J=8.5 Hz,H-6),2.23(1H,ddd,J=13.2,8.5,6.0 Hz,H-7a),1.91(1H,m,H-7b).13C NMR(CD3OD,150 MHz): δC170.9(C-5),167.7(C-2),136.7(C-11),131.2(C-13,15),129.6(C-12,16),128.5(C-14),68.4(C-8),59.6(C-6),57.2(C-3),53.9(C-9),40.8(C-10),38.00(C-7).以上数据和文献[10]数据基本一致.故化合物7被确定为环-(L-4-羟基脯氨酸-D-苯丙氨酸).
化合物8:分子式C14H14N2O2,黄色胶状.1H NMR(CD3OD,600 MHz): δH7.28(2H,m,H-12,16),7.24(3H,m,H-13,14,15),4.49(1H,td,J=5.1,2.0 Hz,H-3),4.37(1H,ddd,J=11.7,5.8,2.0 Hz,H-6),4.28(1H,t,J=5.0 Hz,H-8),3.71(1H,dd,J=13.0,5.0 Hz,H-9a),3.29(1H,d,J=13.0 Hz,H-9b),3.17(2H,dd,J=5.1,2.8 Hz,H-10),2.07(1H,dd,J=13.0,5.8 Hz,H-7a),1.36(1H,ddd,J=13.0,11.7,5.0 Hz,H-7b).13C NMR(CD3OD,150 MHz): δC171.2(C-5),167.1(C-2),137.3(C-11),131.0(C-13,15),129.4(C-12,14),128.0(C-14),68.5(C-8),58.3(C-6),57.6(C-3),55.2(C-9),38.8(C-10),38.0(C-7).以上数据与文献[11]基本一致.故化合物8被确定为环-(L-4-羟基脯氨酸-L-苯丙氨酸).并且化合物7和化合物8是一对端基异构体.
化合物9:分子式C28H46O5,白色粉末.1H NMR(CD3OD,600 MHz): δH5.27(1H,m,H-7),5.23(2H,m,H-22,23),3.97(1H,m,H-3),3.54(1H,dt,J=5.2,2.0 Hz,H-6),1.06(3H,s,H-9),1.04(3H,d,J=6.6 Hz,H-21),0.94(3H,d,J=6.8 Hz,H-28),0.87(3H,d,J=6.8 Hz,H-27),0.85(3H,d,J=6.8 Hz,H-28),0.64(3H,s,H-18).13C NMR(CD3OD,150 MHz): δC143.7(C-8),137.0(C-22),133.2(C-23),119.0(C-7),76.9(C-5),74.2(C-6),68.3(C-3),57.3(C-17),55.9(C-14),44.7(C-13),44.3(C-9),44.3(C-24),41.8(C-20),40.7(C-4),40.5(C-12),38.1(C-10),34.3(C-25),33.9(C-2),31.7(C-1),29.1(C-16),24.0(C-15),23.0(C-11),21.6(C-21),20.4(C-17),20.0(C-26),18.9(C-19),18.2(C-28),12.8(C-18).以上数据与文献[12]数据基本一致.故化合物9被确定为(22E,24R)-7,22-二烯-3β,5α,6β-麦角三醇.
化合物10:分子式C28H44O3,白色晶体.1H-NMR(CD3OD,600 MHz): δH5.33(1H,dd,J=5.2,2.4 Hz,H-7),5.23(1H,m,H-23),5.21(1H,m,H-22),3.99(1H,m,H-3),3.65(1H,dd,J=5.2,2.4 Hz,H-6),2.50(1H,m,H-14),2.20(1H,dt,J=13.8,4.0 Hz,H-1a),2.11(1H,dd,J=13.6,11.4 Hz,H-4a),2.05(1H,m,H-20),1.89(1H,m,H-11a),1.87(1H,m,H-2a),1.85(1H,m,H-24),1.82(1H,m,H-12a),1.79(1H,m,H-16a),1.64(1H,m,H-4b),1.61(1H,m,H-12b),1.59(1H,m,H-11b),1.56(1H,m,H-15a),1.52(1H,m,H-2b),1.49(1H,m,H-15b),1.47(1H,m,H-25),1.37(1H,m,H-17),1.36(1H,m,H-1b),1.35(1H,m,H-16b),1.12(3H,s,H-19),1.04(3H,d,J=6.6 Hz,H-21),0.95(3H,d,J=6.8 Hz,H-28),0.87(3H,d,J=6.8 Hz,H-26),0.85(3H,d,J=6.8 Hz,H-27),0.66(3H,s,H-18).13C NMR(CD3OD,150 MHz): δC143.8(C-8),136.9(C-22),133.3(C-23),121.0(C-7),78.9(C-5),76.0(C-9),73.6(C-6),68.1(C-3),57.3(C-17),51.8(C-14),44.8(C-13),44.3(C-24),41.8(C-20),41.4(C-10),40.7(C-4),36.5(C-12),34.3(C-25),31.6(C-2),29.2(C-16),29.1(C-11),28.2(C-1),24.0(C-15),22.2(C-19),21.6(C-21),20.4(C-26),20.0(C-27),18.2(C-18),12.2(C-18).以上数据和文献[13]数据基本一致.故化合物10被确定为(24S)-5α,6α-epoxyergosta-7,22-dien-3β,9α-diol.
3 结语
本文分离得到的10个化合物单体.其中化合物4~8为环二肽类成分,又称2,5-二酮哌嗪.据文献报道,环二肽类成分具有抑制毒素、促进癌细胞凋亡、镇痛、抗菌、抗病毒、抗凝血和抗高血糖等生物活性[14-15].化合物9和10是甾体类成分.甾体类成分则具有抗肿瘤和抗菌等生物活性,而且还是一种重要的医药原料.内生真菌具有易培养保藏,发酵周期短等特点,并且蕴藏着丰富的基因簇,可产生多种多样的结构新颖、活性显著的次生代谢产物,其有望成为继药用植物后另一个新的“潜在药源分子宝库”[16-17].此外,内生真菌与宿主植物共生,互相作用、互惠互利,具有促进宿主植物生长、促进种子萌发及打破种子休眠和提高宿主植物的抗逆性等[16]作用.该菌共生于宿主植物黄连中,是否具有上述生物学功能,值得进一步研究和探索.
