蟾酥注射液联合阿帕替尼治疗晚期胃癌患者的疗效
2020-10-19田园杨沛刚檀碧波郭洪海刘洋张泽丁平安赵群
田园 杨沛刚 檀碧波 郭洪海 刘洋 张泽 丁平安 赵群
河北医科大学第四医院外三科(石家庄050011)
胃癌是我国乃至全世界最常见的恶性肿瘤之一,其中进展期胃癌占80%[1],其发病率和死亡率均居前五位[2]。早期胃癌并无特异性的临床表现,故患者就诊时多已达到进展期乃至晚期,对于晚期胃癌的治疗目前多为以化疗为主,而对于二线及二线治疗失败后的晚期胃癌患者治疗方案多处于临床试验阶段,由我国自主研发的阿帕替尼在晚期胃癌治疗中得到了较好的结果[3-4]。同时蟾酥注射液在以往的临床辅助抗肿瘤治疗过程中表现出较好的临床效果,有效单体蟾毒灵、华蟾酥毒基也在抗肿瘤基础研究中表现出优势[5-8]。故本研究在阿帕替尼治疗晚期胃癌的基础上联合蟾酥注射液,评估其疗效及安全性,报道如下。
1 资料与方法
1.1 一般资料所选对象均为2019年1-12月就诊于我院胃癌患者,均经病理细胞学诊断证实,并被明确诊断为晚期胃癌(Ⅳ期),经过二线或二线以上化疗后失败,预计生存期超过3 个月以上,至少能完成4 个疗程以上治疗,能评定疗效及不良反应。共计50 例接受治疗,其中男37 例,女13 例,年龄47~73 岁,平均59 岁。随机分为观察组(25 例)和对照组(25 例)。两组患者术前基本特征差异无统计学意义,见表1。该临床研究经河北医科大学第四医院伦理委员会批准通过。

表1 两组患者一般临床资料特征Tab.1 General clinical data characteristics of patients in two group例
患者入选标准:(1)年龄:18~75岁,男女不限;(2)经病理组织学和/或细胞学确诊的晚期胃癌或胃食管结合部腺癌,具有胃外可测量病灶(螺旋CT 扫描≥10 mm,满足RECIST 1.1 标准);(3)二线化疗失败的晚期胃癌或胃食管结合部腺癌患者。治疗失败的定义:治疗过程中疾病进展或治疗结束后肿瘤复发转移,或者出现不可耐受的毒性;进展期疾病的每一线的治疗包括用药时间≥1 个周期或者更长时间的一种或多种化疗药物;允许前期进行辅助/新辅助治疗,如果辅助/新辅助治疗期间或者完成后≤24 周内出现了肿瘤复发转移,则认为前期的辅助/新辅助治疗是一个针对进展期疾病的一线全身化疗;允许前期的治疗是化疗联合分子靶向药物。(4)ECOG PS:0~2 分;(5)主要脏器功能正常,符合下列要求:血常规检查,需符合(14 d 内未输血):HB ≥90 g/L,ANC ≥1.5×109/L,PLT ≥80×109/L;生化检查需符合以下标准:BIL < 1.5 倍正常值上限(ULN),ALT 和AST <2.5×ULN,如有肝转移,则ALT 和AST < 5×ULN;血清Cr ≤1×ULN,内生肌酐清除率≥50 mL/min(Cockcroft⁃Gault 公式);(6)预计生存期≥3 个月。
1.2 治疗方法对照组单药口服阿帕替尼,850 mg,口服,每天一次,28 d 为一个观察周期。观察组在口服阿帕替尼的同时加用蟾酥注射液治疗,用5%葡萄糖500 mL 加蟾酥注射液20 mL(静脉点滴超过4 h),每日静脉滴注1 次,半个月为一个周期,休息15 d 重复,共2 周期为一疗程,连用2 疗程。
1.3 观察指标采用实体瘤疗效评价标准对本研究治疗情况进行评价。完全缓解(CR):患者病灶均完全消失,且维持时间≥28 d;部分缓解(PR):患者病灶缩小> 50%,且维持时间≥28 d;疾病稳定(SD):患者病灶未出现明显改变;疾病进展(PD):患者病灶增大或出现新病灶。总有效率(ORR)=(CR+PR)/n×100%,疾病控制率(DCR)=(CR+PR+SD)/n×100%。根据美国国家癌症研究所通用毒性标准(NCI⁃CTC)4.0 版进行毒性分析评价。
检测血清糖类抗原19⁃9(CA199)、癌胚抗原(CEA)含量。两组患者治疗前后检测CA19⁃9、CEA 含量,分别抽取患者静脉血,检测其中CA199、CEA 的含量。
检测免疫功能指标。两组患者治疗前后检测CD3+、CD4+、CD8+、CD4+/CD8+、IgG、IgA、IgM,抽取患者静脉血进行检测。
1.4 统计学方法采用SPSS 20.0 软件对本研究中相关数据进行处理,计量资料以均数±标准差表示,采用独立样本t检验;计数资料以例(%)表示,采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 临床疗效
2.1.1 观察组疗效评价部分缓解(PR)20%(5/25),疾病稳定(SD)56%(14/25),疾病进展(PD)24%(6/25)。
2.1.2 对照组疗效评价部分缓解(PR)8%(2/25),疾病稳定(SD)40%(10/25),疾病进展(PD)52%(13/25)。
两组均无完全缓解病例。观察组总有效率(ORR)为20%(5/25)与对照组ORR 为8%(2/25)差异无统计学意义(χ2=1.495,P=0.221)。观察组疾病控制率(DCR)为76%(19/25)与对照组DCR为48%(12/25)差异有统计学意义(χ2=4.160,P=0.041)。
2.2 毒副反应观察组及对照组各25 例进展期胃癌患者均根据美国国家癌症研究所通用毒性标准(NCI⁃CTC,version 4.0)进行毒性分析的评价,非血液系统毒副反应主要为恶心呕吐、肝功能异常、神经毒性和乏力等;血液学毒副反应主要为白细胞减少、中性粒细胞减少和贫血。不良反应均不严重,经积极对症处理后均好转,无化疗相关死亡,其发生率见表3,中性粒细胞减少及乏力症状治疗组较对照组明显减少(P< 0.05),见表2、3。

表2 两组患者血液学不良反应发生率Tab.2 Hematological adverse reactions in two groups例(%)

表3 两组患者非血液学不良反应发生率Tab.3 Non⁃hematological adverse reactions in two groups例(%)
2.3 肿瘤标志物变化情况CA199 及CEA 治疗前观察组较对照组差异无统计学意义(P> 0.05),经治疗后观察组的CA199 水平明显较对照组降低。差异具有统计学意义(P< 0.05),CEA 水平较对照组差异无统计学意义(P>0.05)。见表4。
2.4 免疫功能指标变化情况CD3+、CD4+轻度下降(P>0.05)、CD8+轻度升高(P>0.05)、CD4+/CD8+轻度下降(P>0.05),观察组与对照组治疗后相比,CD3+、CD4+及CD4+/CD8+降低较少,CD8+升高较少,差异具有统计学意义(P< 0.05)。IgG、IgA、IgM 轻度下降(P> 0.05),观察组与对照组治疗后相比,IgG、IgA、IgM 降低较少,差异具有统计学意义(P<0.05),见表5、6。
表4 两组患者治疗前后肿瘤标志物变化情况Tab.4 Tumor markers before and after treatment in two groups ±s

表4 两组患者治疗前后肿瘤标志物变化情况Tab.4 Tumor markers before and after treatment in two groups ±s
注:与对照组治疗后比较,▲P < 0.05,与对照组治疗前比较,*P>0.05
组别观察组对照组治疗前治疗后治疗前治疗后CA199(KU/L)156.37±251.93*47.15±72.98▲185.34±214.95 102.63±188.36 CEA(ng/mL)7.23±10.55*4.63±4.28*9.25±12.83 8.58±10.04
3 讨论
晚期胃癌的治疗方案多为铂类、氟尿嘧啶类、紫杉醇类、伊立替康等经典药物,经过一线或二线治疗后,如病情进展多为支持治疗,临床用药已匮乏。
近年来,靶向治疗药物的研发给晚期胃癌患者带来了希望,我国自主研发新一代口服小分子血管内皮生长因子受体⁃2(VEGFR⁃2)酪氨酸激酶抑制剂阿帕替尼的临床应用,让二线及二线以上失败的晚期胃癌患者得到了新的治疗方案。阮寒光等[4]报道阿帕替尼治疗二线失败后晚期胃癌患者2 个周期后的疾病控制率(DCR)和客观反应率(ORR)分别为78.57%和9.52%,4 个周期后为57.14%和19.05%。郎丰平等[9]对阿帕替尼治疗晚期胃癌的疗效及安全性进行分析显示,患者部分缓解率(21.4%)、稳定率(57.1%)、进展率(21.4%)、总缓解率(21.4%)以及疾病控制率(78.6%),其主要不良反应也均在可接受范围内。而本研究中对照组的疾病控制率48%、有效率8%与上述研究及其他临床研究结果[10-12]基本保持一致,而观察组较高的的疾病控制率和有效率主要得益于在阿帕替尼的基础上加上了蟾酥注射液治疗。
蟾酥注射液近年来在临床上多用于辅助抗肿瘤治疗,在多种实体肿瘤治疗中有临床报道,是从天然中药材中华大蟾蜍成黑眶蟾蜍的耳后腺及皮肤腺的干燥分泌物中提取的有效成分,其抗癌成分是由蟾毒灵和华蟾酥毒基等组成[13-16],单体成分无法直接应用于临床,在基础研究中对肿瘤细胞株的作用效果较为显著。蟾酥注射液在以往的报道中用于胃癌患者实属少见,多见于肺癌、胰腺癌、卵巢癌和淋巴瘤等方面[17-19]的应用,表现出较好的辅助抗肿瘤疗效,与此同时增强机体免疫力,减少治疗过程中的骨髓抑制发生率。
蟾酥注射液在基础和临床研究中,体现出了改善和提高机体免疫功能的功效,本研究在治疗过程中治疗组的毒副作用明显低于对照组及免疫指标的变化,体现出了蟾酥注射液在阿帕替尼靶向治疗过程中减少了毒副反应的发生,也有效的保证了治疗期间患者的免疫功能,为更好的完成治疗提供了保证。这些研究结果也为后续胃癌的中西医结合治疗提供了方向,在围手术期治疗以期待有同样较好的效果。
综上所述,蟾酥注射液在阿帕替尼对晚期胃癌靶向治疗过程中起到了协同抗肿瘤、拮抗毒副作用等功效,更好的改善了阿帕替尼的临床治疗效果,值得临床上进一步推广应用。
表5 两组患者治疗前后淋巴细胞变化情况Tab.5 Lymphocyte count before and after treatment in two groups ±s
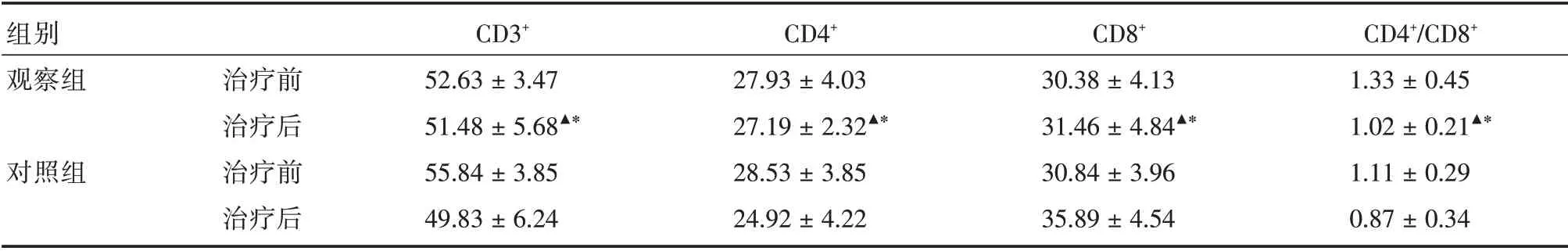
表5 两组患者治疗前后淋巴细胞变化情况Tab.5 Lymphocyte count before and after treatment in two groups ±s
注:与本组治疗前比较,▲P>0.05,与对照组治疗后比较,*P<0.05,下表同
组别观察组对照组治疗前治疗后治疗前治疗后CD3+52.63±3.47 51.48±5.68▲*55.84±3.85 49.83±6.24 CD4+27.93±4.03 27.19±2.32▲*28.53±3.85 24.92±4.22 CD8+30.38±4.13 31.46±4.84▲*30.84±3.96 35.89±4.54 CD4+/CD8+1.33±0.45 1.02±0.21▲*1.11±0.29 0.87±0.34
表6 两组患者治疗前后免疫球蛋白变化情况Tab.6 Immunoglobulin before and after treatment in two groups ±s

表6 两组患者治疗前后免疫球蛋白变化情况Tab.6 Immunoglobulin before and after treatment in two groups ±s
组别观察组对照组治疗前治疗后治疗前治疗后IgG 13.28±1.85 11.21±0.94▲*12.36±1.53 7.35±0.94 IgA 1.36±0.63 1.33±0.42▲*1.43±0.74 1.21±0.57 IgM 1.96±0.43 1.93±0.63▲*2.02±0.26 1.78±0.39
