氟中毒通过引起p16功能障碍抑制成骨细胞功能的机制
2020-10-19范淑玲宋小东赵玉芳
范淑玲 宋小东 赵玉芳
江西医学高等专科学校基础医学部解剖与组胚教研室(江西上饶334000)
过度消耗氟化物会损害多个器官和系统,尤其是骨骼和牙齿,可分别导致氟骨症和牙质氟骨症[1]。氟骨症的特征是骨质改变,包括骨硬化、骨软化或骨质疏松[2]。氟骨症病变的发生和发展与成骨细胞的异常增殖和活化有关[3]。NaF已被证明可通过改变细胞周期进程诱导成骨细胞凋亡[4]。p16 蛋白作为负调节细胞增殖的抑制视网膜母细胞瘤(Rb)的磷酸化细胞周期蛋白依赖性激酶家族成员的CDK4/6,故p16 基因功能的丧失阻止细胞周期抑制。组蛋白乙酰化与基因激活相关,去乙酰化与基因抑制相关[6]。蛋白尾巴的乙酰化发生在特定的位点和残基上,通过调控RNA 聚合酶Ⅱ和转录因子的DNA 可达性来控制基因表达。特异性蛋白1(Sp1)是转录因子,激活的Sp1蛋白识别p16 启动子中保守的Sp1⁃response 元件并进行调控其诱导[7-8]。组蛋白去乙酰化直接影响转录因子Sp1 的结合效率。本研究探究氟中毒通过引起p16 功能障碍抑制成骨细胞功能的机制。
1 材料与方法
1.1 实验动物24 周龄体质量200 g 的雄性SPF级SD 大鼠48 只购自军事医学科学院实验动物中心(实验室合格证号为SCXK⁃(军)2017⁃0004;饲养条件资质号码:SYXK⁃(军)2017⁃0004;动物使用的伦理审批号IACUC:2018⁃650⁃7001)。实验分组:对照组(n=12),自来水(氟离子浓度< 0.5 mg/L);高氟组(n=12),氟化钠(氟离子浓度33.00 mg/L);中氟组(n=12),氟化钠(氟离子浓度16.50 mg/L);低氟组(n=12),氟化钠(氟离子浓度8.25 mg/L)。实验遵循3R 原则。氟化钠的喂养方式为氟化钠溶液灌胃,喂养频率为每天1次,摄入量为5 mL/次。
1.2 实验方法
1.2.1 突触体钙离子浓度的测量18 个月后,当氟暴露完成后,实验鼠颈椎脱臼处死,突触体被分离。对突触体钙离子浓度进行测量测量。
1.2.2 成骨细胞活力分析采用3⁃(4,5⁃二甲基噻唑⁃2⁃yl)⁃2,4⁃二苯基四唑溴化铵(MTT)法(试剂购自上海碧云天公司)检测NaF 对细胞增殖的影响。细胞平铺在96 孔板中,细胞密度1×104,细胞粘附后孵育24 h。之后每孔加入20 μmol/L TT溶液(最终浓度为0.5 mg/mL),37 ℃孵育4 h;之后,弃去上清,每孔加入150 μL 二甲亚砜(DMSO)(试剂购自上海碧云天公司),充分震荡10 min,用微平板阅读器(试剂购自美国Thermo Electron 公司)在490 nm 处定量测定吸光度。
1.2.3 细胞周期分析流式细胞术测定细胞周期内细胞的分布。用碘化丙啶染色DNA 测定细胞周期分布。每组取约1.0×106个细胞,用2.5 mg/mL胰蛋白酶分离,用PBS 洗涤2 次,然后用70%冷乙醇在4 ℃固定4 h。然后将细胞洗两次PBS。加入50 μg/mL 含核糖核酸酶A(50 μg/mL)的碘化丙啶溶液(试剂购自上海碧云天公司),37 ℃黑暗中孵化为30 min。使用流式细胞仪测量细胞周期各阶段的细胞百分率,然后使用ModFit 软件进行分析。增殖指数(PI)计算公式为:PI=(S + G2/M)/(S+G2/M+G0/G1)。
1.2.4 实时荧光定量PCR采用TRIzol 按标准程序提取细胞中总RNA(试剂购自上海碧云天公司)。用纳米Drop2000C 测定RNA 浓度和纯度后,利用逆转录试剂盒随机引物逆转录总RNA(1 μg),按照制造商协议进行逆转录。在ABI PRISM 7500 序列检测系统上进行。实时荧光定量PCR 采用25 ng的cDNA,定量SYBR green master mix 检测单个基因转录水平。RT 反应体系(20 μL)见表1,反应条件见表2,实时荧光定量PCR,使用北京全式金生物技术公司合成下列相关引物,模板为cDNA,内参为GAPDH。对应基因引物序列见表3。

表1 cDNA 反转录体系Tab.1 cDNA reverse transcription system

表2 qPCR 反应条件Tab.2 qPCR reaction conditions

表3 引物的核苷酸序列Tab.3 Nucleotide sequence of primers
1.2.5 Western blot提取总蛋白,测蛋白浓度。取20 μg蛋白质电泳,转移到聚偏二氟乙烯(PVDF)膜上,在4 ℃孵育过夜,把膜膜放入平皿中,向容器中加入5%脱脂奶粉至完全将膜覆盖,摇床中封闭2 h;弃去脱脂奶粉溶液,取出膜置于TBST 中洗涤3次,每次5 min;加一抗(抗体anti⁃p16(1∶3 000)和β⁃actin(1∶3 000),4 ℃孵育过液,加辣根过氧化物酶标记的抗兔二抗(稀释1∶500,试剂购自美国protein intech 公司)孵育2 h 后,用增强化学发光法(购自美国Millipore 公司)检测。用Quantity One软件进行密度分析条带相对密度。
1.2.6 染色质免疫沉淀分析EZ⁃Magna ChIP TM A/G 抗乙酰组蛋白h3(lys9)、抗乙酰组蛋白h3(lys14)、抗乙酰组蛋白h4(lys12)、抗乙酰组蛋白h4(lys16)和抗sp1 抗体试剂盒进行染色质免疫沉淀(芯片)检测。简单地说,用1% 甲醛处理细胞10 min,使组蛋白与DNA交联。洗涤后的细胞颗粒悬浮在5 μL 溶解液中,在 超声仪中进行18 次超声处理每次9.9 s。以5 μL的上清液为输入,在剩余的上清液中加入5 μL 的免疫沉淀抗体和20 μL 的悬浮蛋白A/G磁珠。以抗RNA聚合酶为阳性对照,以正常小鼠IgG 为阴性对照。将ChIP 反应混合物与抗体在4 ℃孵育过夜。收集蛋白A/G串珠抗体/染色质复合物,在冷缓冲液中洗涤,洗脱,然后反向交联,用蛋白酶K 在62 ℃下消化2 h。用旋转柱从上清液中提取纯化了DNA,利用免疫沉淀法扩增p16基因的3个片段,分别由ChIP 1、ChIP 2和ChIP 3引物对输入DNA。引物设计见表4。利用cfx96TM 实时PCR 检测系统检测SYBR 混合预混剂extaqtm ii1 扩增免疫沉淀促进基因组DNA 的差异。

表4 ChIP 1、ChIP 2、ChIP3 引物设计结果Tab.4 Primer design results of ChIP 1,ChIP 2 and ChIP 3
1.3 动物质量测量干预18个月后测量大鼠的质量,通过统计学分析排除因营养不良等因素造成的统计学差异。
1.4 统计学方法本研究采用SPSS 20.0 统计分析软件(美国IBM 公司);计量资料采用均数±标准差表示,组间比较采用单因素方差分析或者重复测量的方差分析,组间两两比较采用LSD⁃t检验;计数资料采用例(%)表示,组间比较采用χ2分析;P<0.05 为差异有统计学意义。
2 结果
2.1 氟对海马[Ca2+]的影响所有氟处理组[Ca2+]均升高,中⁃氟组和高⁃氟组升高(P<0.05),与高⁃氟组于中⁃氟组相比出现下降的趋势,见表5。
表5 氟对海马[Ca2+]的影响Tab.5 Effect of fluoride on[Ca2 +]in hippocampus ±s
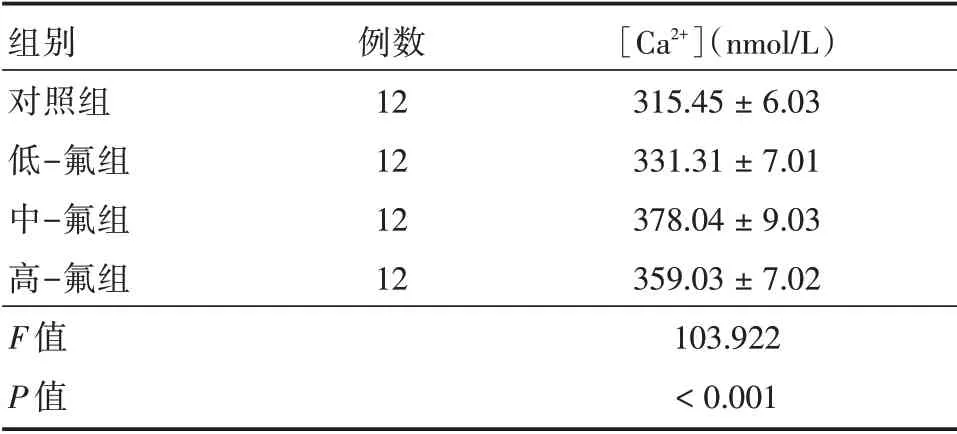
表5 氟对海马[Ca2+]的影响Tab.5 Effect of fluoride on[Ca2 +]in hippocampus ±s
组别对照组低-氟组中-氟组高-氟组F 值P 值例数12 12 12 12[Ca2+](nmol/L)315.45±6.03 331.31±7.01 378.04±9.03 359.03±7.02 103.922<0.001
2.2 氟化物增加细胞活性,促进成骨细胞增殖随着NaF 剂量的增加,细胞生存能力与其浓度呈依赖关系。与正常组相比,中⁃氟组细胞增殖能力增加(P<0.05)。随着氟浓度的逐渐增加,高⁃氟组细胞增殖能力下降。见表6。

表6 骨细胞增殖能力测定结果Tab.6 Measurement results of osteocyte proliferation
2.3 流式细胞仪测定氟对成骨细胞的影响NaF可使S 期细胞数量呈剂量依赖性增加(P< 0.05),随着NaF 浓度的升高,S 期和G2/M 期细胞比例增加,而G0/G1 期细胞比例呈剂量依赖性下降。随着NaF 浓度的增加,PI 呈剂量依赖性增加(P<0.05)。提示NaF 可影响细胞周期从G1 期向S 期的进展,可能导致成骨细胞通过G1 期迅速进入S 期,说明NaF 对成骨细胞具有促进增殖的作用,但NaF 浓度过高(高⁃氟组)的细胞增殖能力出现下降的趋势(P<0.05)。见表7、图1。

图1 流式细胞术检测细胞周期Fig.1 Cell cycle detected by flow cytometry
表7 G0/G1 期、S 期、G2/M 期细胞数量百分比Tab.7 Percentage of cells in G0/G1,s and G2/M stages ±s

表7 G0/G1 期、S 期、G2/M 期细胞数量百分比Tab.7 Percentage of cells in G0/G1,s and G2/M stages ±s
?
2.4 氟化物降低了成骨细胞中p16 的mRNA 和蛋白水平p16 的mRNA 水平(P< 0.05)和蛋白水平(P<0.05)呈剂量依赖性下调。见表8、9,图2。
表8 p16 mRNA 相对表达量Tab.8 Relative expression of p16 mRNA ±s

表8 p16 mRNA 相对表达量Tab.8 Relative expression of p16 mRNA ±s
组别对照组低-氟组中-氟组高-氟组F 值P 值例数12 12 12 12 p16 mRNA 相对表达量(%)0.98±0.11 0.76±0.21 0.37±0.12 0.12±0.03 102.24<0.001

图2 Western blot 测定p16 蛋白表达量Fig.2 Western blot determination of p16 protein expression
2.5 染色质免疫沉淀分析结果与空白组相比,在高⁃氟化钠治疗组,H3ac、H4ac、H3K4、H4K20 的组蛋白脱乙酰作用更强(P<0.05)。见图3。
表9 p16 蛋白相对表达量Tab.9 Relative expression of p16 protein ±s

表9 p16 蛋白相对表达量Tab.9 Relative expression of p16 protein ±s
组别对照组低-氟组中-氟组高-氟组F 值P 值例数12 12 12 12 p16 蛋白相对表达量(%)0.99±0.21 0.62±0.13 0.43±0.14 0.23±0.04 104.09<0.001
2.6 动物质量测量干预18个月后大鼠的质量增加,并通过统计学分析发现,可排除因营养不良等因素造成的统计学差异。见表10。
3 讨论
氟化物是一种有益的微量元素,能维持机体健康;然而,长期过量摄入氟化物会导致慢性氟中毒。慢性氟中毒对机体的影响主要表现为骨骼和氟斑牙、血、肝、肾、神经系统损害。神经细胞钙超载是神经系统疾病的重要机制之一,通过对脑缺血继发性损伤过程的分析,得出了这一结论。钙超载参与早期信号转导,其中海马神经细胞凋亡执行阶段更为重要。海马是钙超载引起神经损伤的重要靶器官。在本研究中,氟暴露增加了海马CA3 区[Ca2+]。提示在慢性氟中毒作用下,钙内流引起细胞内钙超载,且这种增加具有一定的规律性,与氟剂量的增加有关。LIU 等[9]发现七氟醚组大鼠海马神经元内的calpain[Ca2+]和76/80 kDa 在麻醉后1 d 水平升高。
表10 动物质量测量Tab.10 Animal quality measurement ±s

表10 动物质量测量Tab.10 Animal quality measurement ±s
组别对照组低-氟组中-氟组高-氟组F 值P 值例数12 12 12 12动物质量(g)256.93±9.58 260.27±10.72 256.50±12.65 266.98±10.87 6.926 0.099
然而,目前对于骨架的最佳发育和生长是否有必要还缺乏共识。氟中毒常见于发展中国家[10-11]。氟化物是一种细胞毒性物质,可诱导成骨细胞增殖和破坏细胞周期进程,导致氟骨症的发生。本研究中,NaF 处理导致细胞活力增加,细胞周期S 期细胞积累,并以剂量依赖的方式促进成骨细胞增殖。本研究的发现与之前的研究结果一致[12],进一步验证了NaF 破坏正常细胞周期模式并诱导成骨细胞异常增殖和激活的假说。然而,细胞周期的进展受到各种调节蛋白的控制:细胞周期蛋白及其辅因子、细胞周期蛋白依赖性激酶(CDKs)。
p16 蛋白通过抑制cyclin D/CDK4 和cyclin D/CDK6 复合物磷酸化视网膜母细胞瘤蛋白(pRb)来控制G1 期细胞周期增殖[8]。本研究观察到在NaF 暴露的人类初级成骨细胞中,p16 表达的转录抑制被组蛋白去乙酰化酶抑制剂(HDACi)TSA 逆转,这意味着p16 的抑制是由于组蛋白乙酰化的异常调节。
以前的大多数研究都集中在接触氟化物所引起的基因改变上[13-14]。本文研究各种表观遗传调控机制,以阐明氟的生物毒性,包括非编码RNA的表达和DNA 甲基化的改变[15-16]。同时,有假说认为组蛋白乙酰化修饰参与了氟所致的骨科和非骨科损伤[17]。组蛋白乙酰化调节基因的转录和表达。乙酰基修饰的组蛋白使带正电的赖氨酸基团带负电荷,从而削弱组蛋白与带负电的DNA 之间的静电相互作用。相比之下,组蛋白去乙酰化酶可以去除乙酰基,使组蛋白与DNA 相互作用更紧密,抑制基因转录[18]。
去乙酰化改变了染色质的紧密程度,压缩了染色质的结构,使其不易被调节因子所调控[19]。许多转录因子通过分布在p16 启动子区域的相应元件参与转录调控。许多转录因子通过分布在p16 启动子区域的相应元件参与转录调控。本实验结果表明,与空白组相比,在高⁃氟化钠治疗组,H3ac、H4ac、H3K4、H4K20 的组蛋白脱乙酰作用更强。此外,本研究发现,暴露于不同浓度的氟后,S 期和G2/M 期的比例均上升,而TSA 可以逆转这一趋势。提示DNA 损伤可能参与了氟中毒的进展[20-22]。氟化钠诱导p16 基因组蛋白脱乙酰作用,从而促进骨细胞生存能力和促进人类主要的成骨细胞增殖。综上所述,氟中毒通过引起p16 基因乙酰化抑制成骨细胞的功能。
