β1⁃AA下调脂联素水平诱发糖尿病的机制研究
2020-10-19何立娟张凤丽李跃袁慧
何立娟 张凤丽 李跃 袁慧
1清华大学医院(北京100084);2北京安贞医院(北京100029)
糖尿病是一种以慢性血糖水平增高为特征的代谢紊乱性疾病,是心脑血管疾病的主要危险因素,已成为严重危害公众健康的重要因素之一[1]。2013年研究报道我国成年人糖尿病的患病率高达11.6%,临床前期糖尿病的患病率为50%左右[2],已成为威胁人类健康的主要问题。已知糖尿病的发生机制有胰岛素抵抗及胰岛细胞分泌缺陷[3],虽然临床上针对这些机制的治疗可以控制糖尿病患者的血糖水平,但仍无法彻底治愈糖尿病,这无疑与其他未知因素有关。
β1肾上腺素受体自身抗体(autoantibodies against the second extracellular loop of the β1⁃adrenoceptor,β1⁃AA)是一种针对β1肾上腺素受体细胞外第二环产生的自身抗体。大量研究[4-6]表明,β1⁃AA 参与心力衰竭的发生发展,前期研究[7]证实,β1⁃AA 可通过调节T 淋巴细胞导致血糖升高,这提示β1⁃AA可能在糖尿病的发生发展中发挥重要作用,但具体机制尚未明确。因此,进一步探究β1⁃AA 在糖尿病发生发展中的作用对糖尿病的临床治疗有重要的意义。
脂联素(adiponectin,APN)是一种由脂肪细胞分泌的脂肪因子,主要的作用包括胰岛素增敏、抗炎及抗血管损伤[8]。近年来研究发现,脂联素可以通过抑制肝糖异生,促进脂肪酸氧化、胰岛素分泌及骨骼肌中糖摄取发挥降血糖作用[9]。研究显示,脂联素水平与肥胖指标及胰岛素抵抗指标成负相关[10],脂联素水平的降低在肥胖相关疾病(包括胰岛素抵抗、2 型糖尿病和心血管疾病)中起着重要作用[11],提示脂联素的降低可能参与糖尿病的发生。
因此,本研究的目的:(1)明确β1⁃AA 是否诱导糖尿病的发生;(2)检测β1⁃AA 诱导糖尿病过程中脂联素水平的改变,明确脂联素水平的改变与β1⁃AA 诱导糖尿病之间是否存在因果关系。
1 材料与方法
1.1 临床样本选取2016年6月至2017年6月于北京市安贞医院和清华大学医院住院的糖尿病患者45 例作为实验组,其中男27 例,女18 例,平均年龄(57.94±9.25)岁。糖尿病患者的入选标准是临床确诊为2 型糖尿病:(1)空腹8 h 以上,血糖>7.0 mmol/L;(2)餐后2 h 测血糖>11.1%;(3)糖化血红蛋白> 6.5%;(4)有糖尿病的相关症状,如口干、多饮等典型症状。同时入选45 例本院健康体检者作为对照组,其中女20 例,男25 例,平均年龄(56.76±9.42)岁。对照组入选标准:(1)既往无血糖升高史;(2)非妊娠期妇女;(3)没有胰岛功能障碍者。全部病例排除伴全身疾病(感染、肿瘤等)、自身免疫性疾病、有认知问题及精神障碍。本研究所有研究对象均需签订书面知情同意书且本研究已通过道德伦理委员会的批准,病例样本的一般资料见表1。
1.2 实验动物健康C57 小鼠(雄性,8 周龄,体质量18~22 g)由首都医科大学附属北京安贞医院动物中心提供。动物饲养于无病原体的室温环境中,并且每天以12∶12 h 明暗的时间暴露于暗光条件下。在整个研究期间,动物随意采食。所有实验动物经医院动物护理机构委员会批准,实验均按照中华人民共和国发布的《实验动物护理和使用指南》进行。
表1 糖尿病患者和健康体检者临床资料Tab.1 Clinical data of diabetic patients and healthy subjects ±s
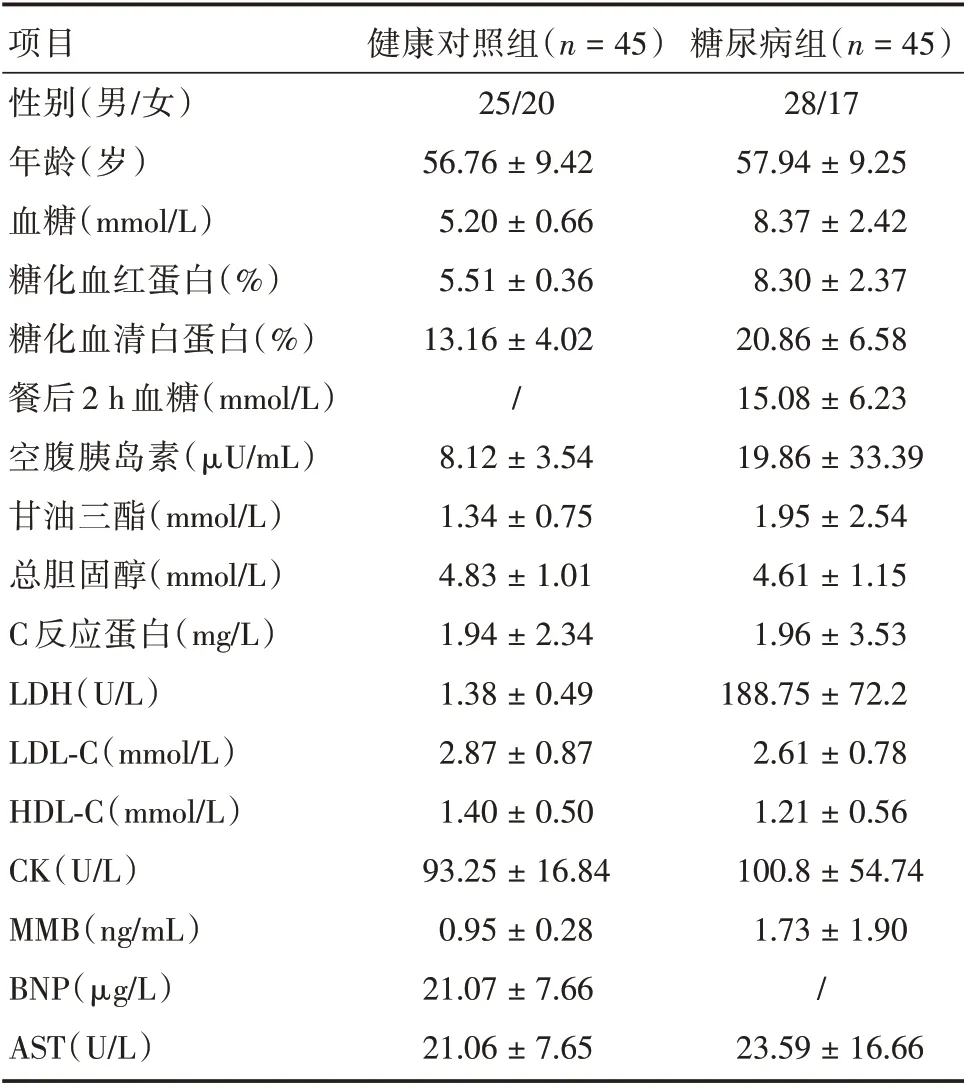
表1 糖尿病患者和健康体检者临床资料Tab.1 Clinical data of diabetic patients and healthy subjects ±s
注:LDH,乳酸脱氢酶;LDL⁃C,低密度脂蛋白胆固醇;HDL⁃C,高密度脂蛋白胆固醇;CK,肌酸激酶;MMB,CKMB 同工酶;BNP,脑钠肽;AST,谷草转氨酶
项目性别(男/女)年龄(岁)血糖(mmol/L)糖化血红蛋白(%)糖化血清白蛋白(%)餐后2 h 血糖(mmol/L)空腹胰岛素(μU/mL)甘油三酯(mmol/L)总胆固醇(mmol/L)C 反应蛋白(mg/L)LDH(U/L)LDL⁃C(mmol/L)HDL⁃C(mmol/L)CK(U/L)MMB(ng/mL)BNP(μg/L)AST(U/L)健康对照组(n=45)25/20 56.76±9.42 5.20±0.66 5.51±0.36 13.16±4.02/8.12±3.54 1.34±0.75 4.83±1.01 1.94±2.34 1.38±0.49 2.87±0.87 1.40±0.50 93.25±16.84 0.95±0.28 21.07±7.66 21.06±7.65糖尿病组(n=45)28/17 57.94±9.25 8.37±2.42 8.30±2.37 20.86±6.58 15.08±6.23 19.86±33.39 1.95±2.54 4.61±1.15 1.96±3.53 188.75±72.2 2.61±0.78 1.21±0.56 100.8±54.74 1.73±1.90/23.59±16.66
1.3 实验方法
1.3.1 肽段的合成及主动免疫抗原肽段的合成:首先根据人β1⁃肾上腺素受体细胞外第二环(β1⁃AR⁃ECII)的氨基酸序列(197aa⁃223aa,人鼠同源性100%),委托上海强耀生物科技有限公司合成长肽和短肽各一条,采用高压液相色谱仪分析合成肽段的纯度在98%以上,肽段的氨基酸序列分别为:H⁃W⁃W⁃R⁃A⁃E⁃S⁃D⁃E⁃A⁃R⁃R⁃C⁃Y⁃N⁃D⁃P⁃K⁃C⁃C⁃D⁃F⁃V⁃T⁃N⁃R⁃C 和C⁃H⁃W⁃W⁃R⁃A⁃E⁃S⁃D⁃E⁃A⁃R⁃R。
主动免疫:将β1⁃AA 阴性的8 周龄健康C57 小鼠随机分为两组。对照组(n=15)的小鼠用生理盐水和免疫佐剂的混合物免疫,而β1⁃AA 组(n=15)的小鼠用人工合成的β1⁃AR⁃ECII 和免疫佐剂的混合物免疫。将β1⁃AR⁃ECII 溶于Na2CO3溶液(pH 11.0)中,与相同体积的完全弗氏佐剂(Sigma⁃Aldrich,St.Louis,MO,USA)混合,然后以浓度为0.4 μg/g 皮下注射(初次免疫)。在初次免疫后1周,向一个后部位点加强皮下注射。然后每2 周进行一次加强免疫。在每次加强注射前1 d 收集血样。
1.3.2 酶联免疫吸附法(ELISA)血清中β1⁃AA的水平采用改良的ELISA 动态监测[12]。具体步骤如下:合成的人β1⁃AR⁃ECII抗原肽用碳酸盐缓冲液(pH 11.0)溶解后,以1 μg/mL 的剂量包被至96 孔板中,4 ℃过夜。加入0.1%的PMT 溶液[0.1%(w/v)牛白蛋白0.1%(v/v),加入吐温20 的磷酸盐缓冲液,pH 7.4、37 ℃封闭1 h,PBS⁃T 清洗3 次,每次5 min。之后将50 μL 待测血清样品用PMT 溶液按1∶10(v/v)稀释后加至微孔板中,37 ℃孵育1 h,PBS⁃T 清洗5 min×3 次。再将生物素化山羊抗人IgG(PMT 稀释的1∶4 500,Sigma)加入反应板中,37 ℃孵育1 h。3 次清洗后,加入亲和素化过氧化物酶(PMT 稀释1∶2 000,Sigma),相同条件孵育清洗。最后,2,2⁃azino⁃di(3⁃ethylbenzothiazoline)sul⁃phonic acid(ABTS)⁃H2O2(Roche,Basel,Switzerland)底物溶液加入微孔板中,37 ℃避光孵育30 min。酶标仪(Spectra Max Plus,Molecular Devices Corp,CA,USA)在405 nm 波长处读取OD值,检测样本OD值与阴性对照OD值之比>2.1 即判断检验样品为阳性,若其比值<1.5 则为阴性。
1.3.3 β1⁃AA 纯化IgGs 的提纯及鉴定从β1⁃AA阳性糖尿病患者分离血清,利用IgGs 亲和纯化试剂盒(MabTrap Kit)提纯血清中IgGs。3 mL 结合缓冲液平衡亲和柱(流速0.5 mL/min);0.5 mL 血清与等体积结合缓冲液稀释后加入柱体中;用7 mL 结合缓冲液冲洗亲和柱;5 mL 洗脱缓冲液洗出柱内IgGs,收集到预先装有中和缓冲液(保持蛋白活性)的离心管中,随后将提纯的IgGs 进行蛋白定量检测[BCA(bicinchoninic acid)试剂盒(Pierce,美国)],用SDS⁃PAGE 凝胶电泳法检测其纯度。
1.3.4 乳鼠心肌细胞跳动频率的检测提取的心肌细胞接种于96 孔板,培养2~3 d,实验分组为阴性IgG 组、β1⁃AA 组(10-7mol/L)、β1⁃AA(10-7mol/L)+β1⁃AR 阻断剂metoprolol 组(3×10-7mol/L)和单独的metoprolol 组(3×10-7mol/L);加入阻断剂1 h后再加入β1⁃AA 作用48 h,显微镜下每组观察7~8 个培养孔,每个培养孔随机计数6~8 个视野,每个视野每次计数30 s,最后计数分离的单个细胞1 min 内同步收缩的次数,验证β1⁃AA 的生物活性。
1.3.5 细胞培养及分化3T3⁃L1细胞在含10%FBS、100 U/mL 青霉素和100 μg/mL 链霉素的DMEM 培养基中,于37 ℃、5%CO2培养箱中培养,每2 d换液,当细胞融合度达到80%~90%时,以0.25%的胰蛋白酶消化,传代至6 孔板。待细胞融合2 d 后,先加0.5 mmol/L IBMX、1 μmol/L 地塞米松、10 mg/L 胰岛素,培养48 h,然后换含10% FBS 和10 mg/L 胰岛素的DMEM 培养基继续培养2 d,然后换成仅含10% FBS 的DMEM 培养基继续培养4~6 d。诱导分化8~12 d 的3T3⁃L1 细胞90%以上呈脂肪细胞表型,分别用10-6、10-7、10-8mol/L 浓度的β1⁃AA 给予刺激24 h。
1.3.6 血清中脂联素的检测脂联素主要由脂肪细胞分泌[13],为了探究脂肪细胞中脂联素的分泌是否受β1⁃AA 影响,首先将3T3⁃L1 前脂肪细胞诱导为脂肪细胞,然后用不同浓度的β1⁃AA 刺激脂肪细胞24 h,患者血清中脂联素水平应用人脂联素ELISA试剂盒(国产)进行检测。具体步骤详见说明书。
1.3.7 Western blot脂肪组织及心肌组织蛋白浓度用BCA 方法检测。蛋白上样量为每孔20 μg,分离胶浓度为10%,恒压80 V,电泳1 h,400 mA 恒流转膜1 h,按照0.1 mL/cm2加入5%脱脂奶粉封闭液,尽可能排除里面的气泡,室温孵育1 h。加入稀释于2.5 %脱脂奶粉的一抗(一抗稀释度为1∶1 000)4 ℃孵育过夜后弃去一抗,用TBST 洗3 次,每次5 min。弃去一抗加入1∶5 000稀释的相应二抗,室温摇动1 h,弃去二抗,用TBST 洗膜3 次,每次5 min。采用化学发光试剂(PIERCE公司)检测蛋白。
1.3.8 实时定量PCR引物由生工生物工程(北京)合成(表2),使用Trizol 试剂(Invitrogen,US)从冷冻脂肪组织中提取总RNA。紫外吸收测定法测定RNA 在分光光度计260 nm 和280 nm 处的吸收值,计算其浓度并评估RNA 纯度,使用逆转录酶(Promega)进行反应,将样品RNA 逆转录为cDNA。先将样品的目的基因以及管家基因进行PCR 扩增,其产物进行梯度稀释用于做标准曲线,据说明书由SYBR®Premix Ex(Life Technologies,USA)定量。使用2-ΔΔCt方法,计算结果。
1.3.9 标记法芯片技术收集主动免疫小鼠外周血清,利用AAM⁃BLG⁃1 试剂盒(RayBiotech,Inc.Guangzhou)检测外周血清中发生改变的细胞因子,根据试剂盒说明进行操作。采用数据分析软件—AAM⁃BLG⁃1 来进行数据预分析。

表2 RT⁃qPCR 引物Tab.2 Primers of RT⁃qPCR
1.4 统计学方法采用SPSS 16.0 统计软件对数据进行统计分析。正态分布的数据以均数±标准差表示,采用独立样本t检验和单因素方差分析。非正态分布的数据以M(P25,P75)表示,比较用Mann⁃WhitneyU检验或者Kruskal⁃WallisH检验。P<0.05为差异有统计学意义。
2 结果
2.1 β1⁃AA IgGs 增加乳鼠心肌细胞跳动频率从β1⁃AA 阳性糖尿病患者血清中分离的β1⁃AA IgGs(25 μg/mL)可增加乳鼠心肌细胞跳动频率(图1),其作用类似于β1⁃肾上腺素能受体激动剂异丙肾上腺素(ISO),而β1⁃肾上腺素能受体拮抗剂美托洛尔(1 μmol/L)可以消除β1⁃AA IgGs 的这种作用。
2.2 β1⁃AA 及脂联素在糖尿病患者血清中的分布与正常体检组相比,糖尿病患者血清中β1⁃AA水平显著增高[(0.82±0.31)vs.(0.12±0.10),P<0.001,图2A]。且在45 例糖尿病患者中有26 例呈β1⁃AA 阳性,其阳性率显著高于对照组(57.7%vs.1.1%,图2B);而脂联素浓度明显低于对照组[(14.52±3.76)ng/mLvs.(25.87±8.93)ng/mL,P<0.001,图2C];进一步分析发现,β1⁃AA 水平与脂联素水平呈负相关(图2D)。

图1 糖尿病患者血清中β1⁃AA 增加乳鼠心肌细胞跳动频率Fig.1 β1⁃AA in serum of diabetic patients increases beating frequency of neonatal rat cardiomyocytes

图2 糖尿病患者中β1⁃AA 水平和脂联素浓度Fig.2 Levels of β1⁃AA and adiponectin in diabetic patients
2.3 β1⁃AA长期存在可诱导C57小鼠血糖升高结果发现,与对照组相比,主动免疫8 周时,免疫组小鼠空腹血糖明显较高[(14.0±0.81)mmol/Lvs.(5.03±0.21)mmol/L,P<0.001],见图3A;同时,腹腔葡萄糖耐量试验(IPGTT)发现,主动免疫8 周,小鼠在糖负荷后30 min 和60 min 时,血糖也明显高于对照组[(13.0±1.5)mmol/Lvs.(7.70±1.21)mmol/L,P<0.01],见图3。以上结果初步提示,β1⁃AA 长期存在可能诱导糖尿病的发生。利用蛋白芯片技术筛选主动免疫小鼠外周血清中发生改变的细胞因子,结果发现脂联素水平在主动免疫8 周时明显低于对照组(表3),提示β1⁃AA 通过下调脂联素的水平诱导小鼠血糖升高。

表3 蛋白芯片技术检测主动免疫小鼠外周血清细胞因子的水平Tab.3 The level of serum cytokines in active immunized mice
2.4 β1⁃AA 可下调脂肪组织中脂联素水平结果显示,脂肪组织中脂联素蛋白水平及mRNA 水平显著低于对照组(图4),进一步提示脂联素水平的减少参与糖尿病的发生。

图3 β1⁃AA 诱导C57 小鼠血糖升高Fig.3 β1⁃AA induces hyperglycemia in C57 mice

图4 β1⁃AA 诱导脂肪组织中脂联素水平降低Fig.4 Decrease of adiponectin level in adipose tissue induced by β1⁃AA

图5 β1⁃AA 减少3T3⁃L1 细胞中脂联素分泌Fig.5 β1⁃AA reduces adiponectin secretion in 3T3⁃L1 cells
2.5 β1⁃AA 减少脂肪细胞中脂联素分泌结果显示,脂联素蛋白表达和mRNA 水平随着β1⁃AA 浓度的增高均逐渐下降(图5)。
3 讨论
糖尿病是一种慢性复杂的内分泌代谢紊乱,也是导致全球人群死亡的重要因素之一,严重威胁社会公众健康[14]。本研究发现,糖尿病患者血清中β1⁃AA 滴度及阳性率均显著高于健康对照组人群,且动物实验证实β1⁃AA 长期存在可导致小鼠血糖升高;主动免疫8 周时小鼠外周血清中脂联素水平显著降低,同时,从临床水平证实糖尿病患者血清中脂联素水平低于健康对照组;进一步从细胞水平验证β1⁃AA 长期存在可下调脂联素水平。以上结果初步提示,β1⁃AA 可通过下调脂联素水平而诱导糖尿病的发生。
以往研究表明,β1⁃AA 被动免疫可增加大鼠和小鼠的血糖水平,在被动免疫大鼠模型中,免疫期间观察到血糖水平随时间增加,并在第24 周达到峰值[7]。本研究从β1⁃AA 阳性的糖尿病患者提取出的总IgG 主动免疫小鼠8 周时,可以引起空腹血糖升高及腹腔葡萄糖耐量试验阳性,与以往的报道一致。
研究显示脂联素在胰岛素增敏(胰岛素代谢调节)、抗炎及抗缺血损伤及癌症的发生中发挥重要作用[15-16]。研究[17]发现,脂联素可以促进骨骼肌细胞脂肪酸的氧化和糖吸收,抑制肝脏的糖生成,是机体的血糖调节和脂质代谢的重要调节因子。研究[18]显示2 型糖尿病和有心血管疾病风险的肥胖患者脂联素水平低,而脂联素基因疗法可以减轻炎症反应,提高胰岛素的敏感性。本研究结果初步提示脂联素水平的降低在β1⁃AA 诱导糖尿病的发生中具有重要作用。但是β1⁃AA 是通过怎样的信号通路诱导脂联素降低进而导致血糖升高尚不清楚。
由于本研究在主动免疫8 周时发现小鼠血糖升高,不能确定8 周是否是血糖升高的峰值时间,因此下一步计划延长主动免疫的时间,寻找血糖升高的峰值时间,并探究β1⁃AA 诱导脂联素下降的机制。
