VEGF、HIF-1α表达对食管鳞癌患者放疗疗效的影响
2020-10-19彭明尧周雪宇蒋利华
彭明尧 周雪宇 蒋利华
食管癌是目前临床常见的消化道恶性肿瘤,组织分型以食管鳞癌为主,恶性程度高且预后差,据统计90%食管鳞癌患者确诊时病情已进展至中晚期,患者5年生存率低于20%[1-2]。放疗治疗为局部晚期、无法进行手术或拒绝手术的食管鳞癌患者主要治疗手段。研究显示放疗效果与患者癌组织内生物学行为密切相关[3]。血管内皮生长因子(vascular endothelial growth factor,VEGF)可诱导癌组织血管新生,缺氧诱导因子1 α(hypoxia inducible factor 1 α,HIF-1 α)可提高癌组织代谢功能,两者均可提高癌细胞增殖能力及侵袭性[4-6]。目前研究食管鳞癌组织VEGF、HIF-1 α表达对食管鳞癌患者放疗疗效的影响的研究较少。因此本次对食管鳞癌患者进行研究,旨在为食管癌患者治疗及预后判断提供新的依据,现整理报告如下。
1 资料与方法
1.1 一般资料
选取2014年1月至2019年1月我院收治的80例食管鳞癌患者为研究对象,所有患者均接受放疗治疗,以其活检病理癌组织标本作为观察组(n=80),癌旁组织标本作为对照组(n=80)。男性53例,女性27例;年龄<60岁26例,年龄≥60岁54例;高分化食管鳞癌13例,中分化食管鳞癌21例,低分化食管鳞癌46例;浸润深度T1~T222例,浸润深度T3~T458例;有淋巴结转移59例,无淋巴结转移21例。本研究通过我院医学伦理委员会批准同意,所有患者均对研究知情同意,并签署相关文件。
1.2 纳入与排除标准
1.2.1 纳入标准 ①经组织病理学检测确诊为食管鳞癌的患者;②无法进行或拒绝手术治疗,自愿选择放疗且无放疗禁忌证;③无精神或意识障碍的患者;④患者知情同意并签署知情同意书。
1.2.2 排除标准 ①合并严重心、脑、肝、肾等器官疾病患者;②卡氏评分[7],预计生存期≤3个月的患者;③临床资料及问卷资料不完整者;④长期使用免疫抑制剂者。
1.3 治疗方案
两组患者入院后完善全面体格检查、血常规、尿常规、血生化以及影像学检查后进行三维适形放疗治疗。放疗方法:患者取仰卧位,先通过热塑体膜固定,再通过CT增强对患者进行扫描定位,利用扫描所得图像进行三维重建,根据造影检查、CT图像等影像学检查规划放疗靶区,放疗靶区勾画参考《肿瘤放射治疗学》规定[8]。采用Varian Clinac 21EX型直线加速器进行放疗治疗,射线为6 MV-X,治疗总剂量控制在60~70 Gy,计划分割剂量为2 Gy/次,5次/周[9]。
1.4 观察指标
1.4.1 VEGF、HIF-1 α表达情况 采用链霉菌抗生物素蛋白-过氧化物酶连接法对癌组织及癌旁组织CXCR4表达情况进行检测,鼠抗人HIF-1 α单克隆抗体购自武汉艾美捷科技有限公司,兔抗人VEGF单克隆抗体及免疫试剂盒购自北京中杉金桥生物技术有限公司,严格按照试剂盒说明书进行操作。随机抽取5个高倍镜视野进行观察,综合细胞染色数目及强度判断VEGF及HIF-1 α表达情况,HIF-1 α主要在细胞质和部分细胞中表达,VEGF主要在细胞质中表达。细胞染色强度计分分为4级:0分为无色,1分为淡黄色,2分为棕黄色,3分为棕褐色。细胞染色数目分计分分为5级:0分为阳性细胞<5%,1分为5%阳性细胞数<25%,2分为25%阳性细胞数<50%,3分为50%阳性细胞数<75%,4分为75%阳性细胞数。两项得分之和<2分则为阴性,反之则为阳性[10-11]。
1.4.2 临床特征 通过问卷调查收集两组患者性别、年龄、组织分化程度、浸润深度、淋巴结转移以及化疗效果等临床特征资料。
1.4.3 放疗近期疗效 放疗结束后,采用常规CT扫描检查食管鳞癌患者病灶体积大小,根据病灶体积将放疗近期治疗效果分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)以及疾病进展(progressive disease,PD)。CR为病灶体积缩小75%以上,时间超过1个月;PR为病灶体积缩小50%以上,且维持4周以上;SD为病灶体积缩小不足50%,或增大不超过25%;PD为出现新病灶或病灶增大不超过25%。有效=CR+PR,无效=SD+PD[12]。
1.5 统计学分析
应用SPSS 17.0统计软件进行分析。本组数据均为计数资料,以例数(百分率)表示[n(%)]表示,使用χ2检验进行比较,并采用Logistic 回归分析筛选食管癌疗效的影响因素;VEGF和HIF-1 α相关分析采用Spearman秩相关分析,P<0.05,表示差异具有统计学意义。
2 结果
2.1 两组组织间VEGF、HIF-1 α表达情况比较
VEGF、HIF-1 α在观察组中的阳性表达率分别为67.5%和76.25%,均显著高于对照组的7.5%和11.25%,P<0.05,差异有统计学意义,见表1。
2.2 放疗近期疗效有效和无效患者的临床特征比较
放疗结束后近期疗效有效和无效患者的临床特征比较,性别、年龄、组织分化程度、浸润深度的差异无统计学意义(P>0.05),VEGF、HIF-1 α表达及淋巴结转移的差异有统计学意义(P<0.05),见表2。

表1 两组VEGF、HIF-1 α表达情况比较(例,%)
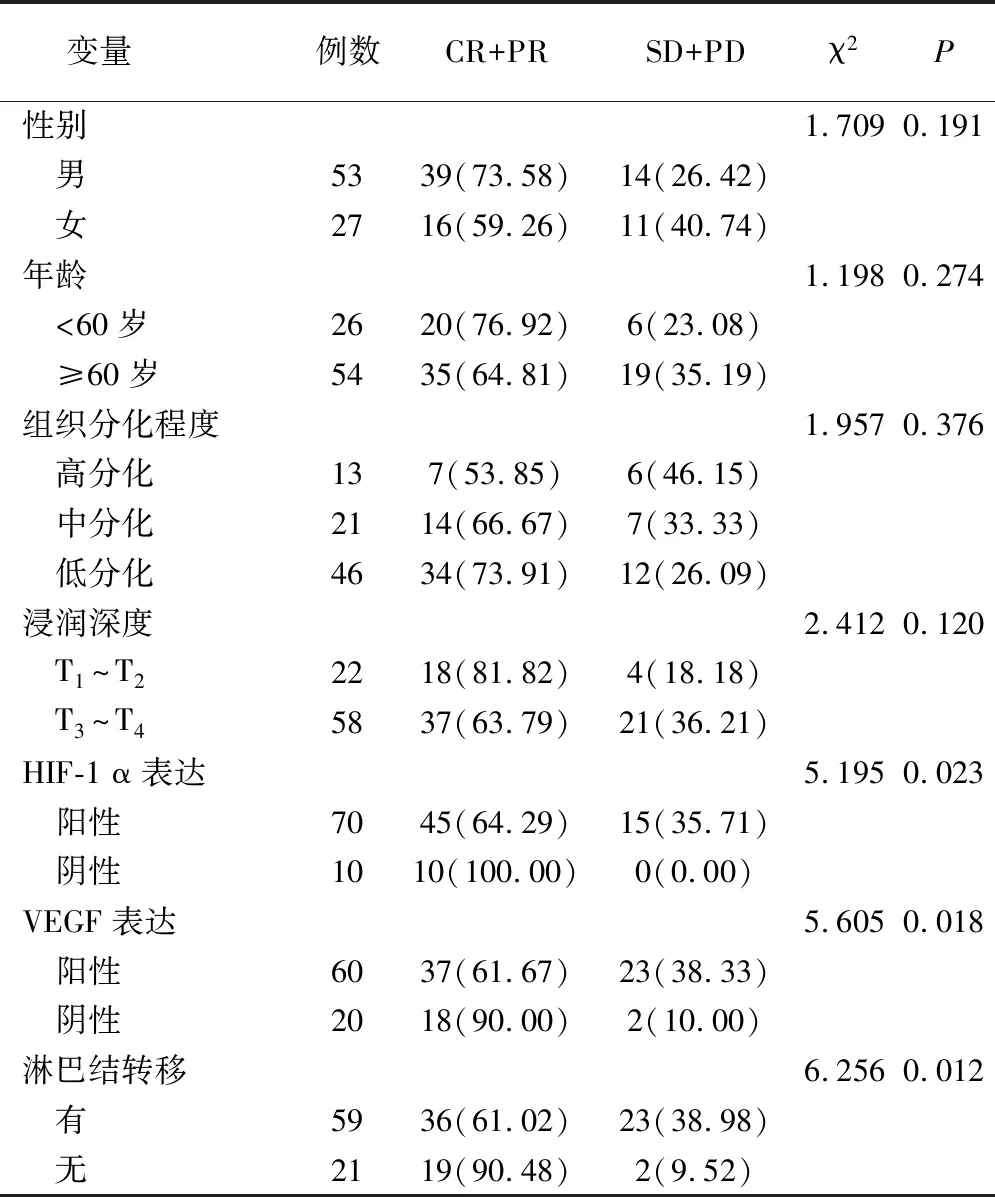
表2 放疗结束后近期疗效有效和无效患者的临床特征比较(例,%)
2.3 影响食管鳞癌患者放疗疗效的多因素Logistic 回归分析
经多因素Logistic回归分析,VEGF、HIF-1 α阳性表达和淋巴结转移为影响食管鳞癌患者放疗疗效的独立危险因素(P<0.05),见表3。
2.4 VEGF和HIF-1 α表达的相关性
在观察组中,VEGF和HIF-1 α表达呈正相关,相关系数为0.367(P<0.05),见表4。
3 讨论
由于大多数食管鳞癌患者早期无明显症状,发现并确诊时大多已进行至中晚期[8],其防控及治疗仍是临床研究的重点及难点,因此探索食管鳞癌发生、发展及接受治疗过程中分子生物学机制具有重要意义。
近年来研究显示食管鳞癌细胞所在的肿瘤微环境具有可通过抑制免疫监视、释放细胞因子、促进血管新生以及孕育肿瘤干细胞改善等多种增进食管鳞癌细胞生长,加强其侵袭和转移能力[13-14]。本研究结果显示VEGF、HIF-1 α在观察组中的阳性表达率分别为67.5%和76.25%,均显著大于对照组的7.5%和11.25%,差异有统计学意义,且VEGF和HIF-1 α的表达呈正相关。VEGF为血管内皮细胞的特异性有丝分裂原,可诱导内皮细胞增生并提高血管通透性,从而促进血管生成,并参与多种生理病理过程,炎症反应、缺氧等条件可诱导其大量合成[15]。HIF-1为异源二聚体核转录因子,普遍存在于人和哺乳动物细胞内,常氧下也有表达,但很快即被细胞内氧依赖性泛素蛋白酶降解途径所降解,而在缺氧条件下HIF-1可稳定存在[16]。HIF-1 α为HIF-1氧调节亚单位,可发挥调节丝裂原激活蛋白激酶通路的作用,进而促进缺氧细胞的糖代谢,提高细胞增殖活性,帮助细胞适应缺氧环境[17]。癌细胞具有无限增殖能力,当癌组织扩张过快,组织需氧就会超过血管的供氧能力,形成缺氧微环境,导致HIF-1 α及VEGF合成增加。此外还有研究显示HIF-1 α可上调VEGF的表达[18],因此HIF-1 α及VEGF的表达呈正相关。

表3 影响食管鳞癌患者放疗疗效的多因素Logistic回归分析

表4 在观察组中,VEGF、HIF-1 α表达的相关性(例,%)
放疗可通过直接杀伤肿瘤细胞并促进其凋亡,到达治疗肿瘤的效果,本研究所有食管鳞癌患者均采用三维适形放疗进行治疗,但治疗效果不尽相同。本研究结果显示,放疗结束后近期疗效有效和无效患者的临床特征比较,性别、年龄、组织分化程度、浸润深度的差异无统计学意义,VEGF、HIF-1 α的表达以及淋巴结是否有转移的差异有统计学意义,且经多因素Logistic 回归分析,VEGF、HIF-1 α的阳性表达和淋巴结的转移为影响食管鳞癌患者放疗疗效的独立危险因素。说明VEGF、HIF-1 α的表达以及淋巴结转移对放疗效果影响较大。分析其原因可能为发生淋巴结的转移的患者食管鳞癌恶性程度更高,放疗治疗根治的可能性低,治疗后癌细胞可能继续增殖,与既往研究一致[19]。VEGF可通过促进内皮细胞分裂及转移,促进血管生成,为肿瘤提供充足支持,并通过新生血管及淋巴管进行转移,增加肿瘤细胞对放疗的抵抗作用。此外孔泽等研究认为VEGF可诱导肿瘤干细胞的生成,并通过促进其自我更新,提高肿瘤的生长、复发能力[20]。HIF-1 α可通过增加肿瘤细胞对缺氧环境的适应能力,降低氧分子对放疗的增敏作用,缓解放疗造成的损伤,此外HIF-1 α介导的一系类下游基因表达(糖代谢的各种酶、胰岛素样生长因子等)亦可增加癌组织放疗抵抗能力。综上所述,食管鳞癌患者癌组织中VEGF、HIF-1 α表达水平较高,且VEGF、HIF-1 α的阳性表达与食管鳞癌患者近期放疗疗效密切相关,可作为临床治疗及预后判断的靶点。
