H446和H1688细胞系中ZFAS1的表达研究
2020-10-19潘喜峰马艳菊赵舣航于淼淼
潘喜峰 马艳菊 唐 域 赵舣航 王 贺 于淼淼
小细胞肺癌属于神经内分泌肿瘤,可伴有内分泌异常或类癌综合征,其恶性程度高,预后较差,患者的5年生存率可能不足5%[1-2]。目前对于非小细胞肺癌的研究较多,抗肿瘤药物的不断出现,显著提高了非小细胞肺癌的治疗效果[3-5],但是由于小细胞肺癌独特的生物学性质,目前对小细胞肺癌的相关研究较少。因此,研究小细胞肺癌发生侵袭转移的机制,将有助于寻找小细胞肺癌潜在的治疗靶点,提高小细胞肺癌患者的生存时间。肿瘤细胞发生侵袭转移是恶性肿瘤的主要特征之一,是1个涉及多种因素的复杂的调控过程[6-7]。研究发现,长链非编码RNA可以调节基因表达,影响细胞生长和分化,参与肿瘤的发生与发展[8]。ZFAS1是1种在多种器官组织中表达的长链非编码RNA[9-11]。相比于邻近正常肺组织,非小细胞肺癌组织中ZFAS1的表达明显升高。此外,沉默ZFAS1可以抑制非小细胞肺癌肿瘤细胞的增殖,提示ZFAS1可能是非小细胞肺癌的潜在治疗靶点[12]。但是相关研究在小细胞肺癌患者中较少。本文拟通过比较ZFAS1在小细胞肺癌细胞系H446和H1688,及非小细胞肺癌细胞系A549中的表达情况,初步探讨ZFAS1与小细胞肺癌发病之间的关系,为提高小细胞肺癌的治疗效果提供新的思路。
1 材料与方法
1.1 材料
1.1.1 细胞及试剂 H446细胞系,H1688细胞系和A549细胞系均购自于中国科学院典型培养物保藏委员会细胞库,RPMI-1640培养基购自于美国Gibco公司,F12K培养基购自于美国Gibco公司,胎牛血清购自于美国Gibco公司,胰蛋白酶,青链霉素购自于美国Sigma-Aldrich公司,PrimeScriptTMRT Master Mix,TB Green Premix Ex TaqTMII及引物购自于Takara公司。
1.1.2 仪器 高速冷冻离心机(德国Eppendorf,5804R),超微量分光光度计(美国Denovix,DS-11FX+),实时荧光定量PCR仪(美国BIO-RAD,CFX96 Touch),多功能酶标仪(德国BMG,LABTECH PHERAstar FS)等。
1.2 方法
1.2.1 细胞培养 H446:培养基和添加剂:RPMI-1640(Gibco,添加NaHCO31.5 g/l,glucose 2.5 g/l,Sodium Pyruvate 0.11 g/l),90%;优质胎牛血清,10%。气相:空气,95%;二氧化碳,5%。温度:37 ℃。
H1688:培养基和添加剂:RPMI-1640(Gibco,添加NaHCO31.5 g/l,glucose 2.5 g/l,Sodium Pyruvate 0.11 g/l),90%;优质胎牛血清,10%。气相:空气,95%;二氧化碳,5%。温度:37 ℃。
A549:培养基和添加剂:F12K培养基(Gibco,添加NaHCO32.5 g/l),90%;优质胎牛血清,10%。气相:空气,95%;二氧化碳,5%。温度:37 ℃。
1.2.2 引物设计 参考ZFAS1和β-actin在Genebank中的基因序列,由Takara生物公司合成引物。
1.2.3 总RNA提取和cDNA逆转录 Trizol试剂分别提取H446,H1688及A549细胞系的总RNA后,使用逆转录试剂盒合成cDNA,操作步骤严格按照试剂盒说明书进行,零下20 ℃保存备用。
1.2.4 实时荧光定量PCR反应 以cDNA为模板,进行实时荧光定量PCR扩增。第一步:在含有引物,dNTP及DNA聚合酶的反应液中,使双链DNA热变性。第二步:引物与热变性生成的单链DNA退火。第三步:在DNA聚合酶作用下合成互补链。返回步骤一,称为1个循环,每个循环后采集荧光生成扩增曲线。
1.2.5 检测H446,H1688和A549细胞系中ZFAS1的表达 应用实时荧光定量PCR方法检测H446,H1688和A549细胞系中ZFAS1和β-actin的表达情况,以ZFAS1与β-actin的表达量之比作为ZFAS1的相对表达量。
1.3 统计学分析
应用SPSS 21.0对数据进行统计学分析。Kolmogorov-Smirnov检验用于评估数据是否符合正态分布。基于检验结果,符合正态分布的连续变量用均数±标准差表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,并进行两两多重比较,当P<0.05时,认为具有统计学意义。
2 结果
2.1 引物序列
选择同源性高的区域设计引物,具体结果见表1。

表1 ZFAS1和β-actin的实时荧光定量PCR引物序列
2.2 实时荧光定量PCR反应的特异性分析
ZFAS1和β-actin的溶解曲线见图1。溶解曲线为特异单峰,无其他杂峰。
2.3 实时荧光定量PCR反应的敏感性分析
以cDNA为模板进行实时荧光定量PCR扩增,ZFAS1和β-actin的扩增曲线见图2。
2.4 不同肺癌细胞系中ZFAS1的表达情况
ZFAS1与β-actin的表达量之比作为ZFAS1的相对表达量,具体结果见表2。结果显示相比于A549细胞系,H446和H1688细胞系中,ZFAS1的相对表达量明显升高,具有统计学意义(P<0.001,P=0.001);此外,ZFAS1的相对表达量,在H446细胞系中,显著高于H1688细胞系(P<0.001),也具有统计学意义,见图3。

图1 ZFAS1和β-actin的溶解曲线

图2 ZFAS1和β-actin的扩增曲线

图3 不同肺癌细胞系中ZFAS1的表达情况
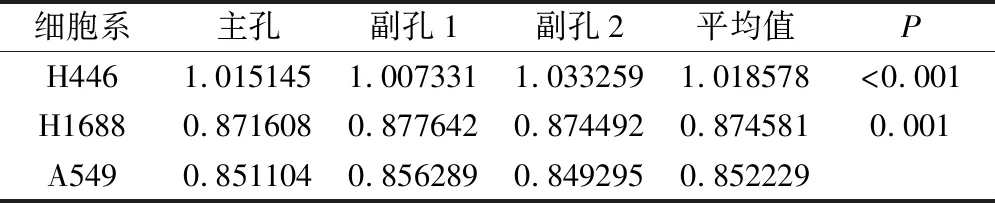
表2 H446,H1688和A549细胞系中ZFAS1的相对表达量
3 讨论
ZFAS1在不同组织中的表达存在差异,研究发现,ZFAS1在小鼠正常乳腺组织中的表达高于乳腺癌组织,此外,在乳腺上皮细胞系中抑制ZFAS1的表达会促进细胞增殖,提示ZFAS1可能为乳腺癌的抑癌基因[13]。而在胃癌[14],肠癌[15]及神经胶质瘤[16]的肿瘤组织中,ZFAS1的表达则高于周围正常组织,并且与患者预后不良相关,提示ZFAS1可能发挥了促癌作用。上述研究表明,ZFAS1在不同组织中的调控作用并不相同。
ZFAS1的作用机制目前尚不明确,有研究认为,ZFAS1可能是通过EMT或P53参与了肿瘤的侵袭和转移。EMT是指上皮细胞向间质细胞的转化过程,存在于多种肿瘤的侵袭转移过程中。研究发现,沉默ZFAS1会引起E-钙黏蛋白和N-钙黏蛋白的表达发生变化,抑制EMT及肿瘤细胞的增殖侵袭[17]。P53作为一种重要的肿瘤抑制因子,参与细胞凋亡等多个生理过程。研究表明,抑制ZFAS1的表达,可引起PARP,MDM2等相关蛋白表达下调,促进细胞凋亡,但其具体作用机制需要进一步的研究[18]。
在非小细胞肺癌中,研究报道ZFAS1在肿瘤组织中的表达明显高于邻近正常肺组织,并且,在晚期非小细胞肺癌组织中,ZFAS1的升高更为显著。此外,研究发现ZFAS1与非小细胞肺癌患者的病理学特征及预后有关,提示ZFAS1可能是非小细胞肺癌患者的一个独立预后因素[19]。ZFAS1参与非小细胞肺癌发病过程的可能机制为:通过抑制miR-193a-3p,调节KRAS的表达水平,促进非小细胞肺癌的发生。研究表明上调ZFAS1可以抑制miR-193a-3p的表达,同时下调ZFAS1则促进了miR-193a-3p的表达[20],而miR-193a-3p可通过调节KRAS信号通路发挥抑癌作用[21]。
上述研究提示ZFAS1在多种肿瘤的侵袭和转移过程中发挥了重要作用,但目前在小细胞肺癌中相关研究较少。本研究应用实时荧光定量PCR方法,检测ZFAS1在小细胞肺癌细胞系H446和H1688,及非小细胞肺癌细胞系A549中的表达情况。实验结果显示ZFAS1的相对表达量,在H446小细胞肺癌细胞系中,明显高于H1688小细胞肺癌细胞系,提示不同来源的小细胞肺癌细胞系,其生物学特征存在差异。更为重要的是,ZFAS1在小细胞肺癌细胞系中也存在高表达现象,提示ZFAS1可能同样参与了小细胞肺癌的发生发展过程。
为了判定实时荧光定量PCR方法的可信性,根据PCR扩增的标准曲线,我们分析了E值,R2值和斜率;重复进行5次实时荧光定量PCR扩增实验,以判定实验结果的稳定性和可重复性。总体而言,本实验具有较高的敏感性,以及较好的可重复性,实验结果稳定可信。但是本实验也存在一些局限性,第一,由于部分仪器和试剂供应商之间缺少一致的生产和检验标准,因此不同供应商生产的仪器和试剂可能对实验结果产生影响。第二,关于非小细胞肺癌细胞系,本研究只检测了A549细胞系,因此,本实验结果可能不足以代表非小细胞肺癌细胞系的真实状况。第三,本研究的数据来源于对小细胞肺癌细胞系和非小细胞肺癌细胞系的检测,而不是肺癌患者的肿瘤组织,因此需要基于患者肺癌组织的实时荧光定量PCR实验,进一步验证本研究的结果。鉴于上述局限性,本研究得到的数据应该被审慎地解读。
综上所述,本研究应用实时荧光定量PCR方法分别检测ZFAS1在小细胞肺癌细胞系H446和H1688,及非小细胞肺癌细胞系A549中的表达情况,研究结果显示ZFAS1在H446和H1688两种小细胞肺癌细胞系中的表达存在差异,提示不同来源的小细胞肺癌细胞系,其生物学特征不完全一致。更为重要的是,ZFAS1在小细胞肺癌细胞系中也存在高表达现象,提示ZFAS1可能同样参与了小细胞肺癌的侵袭和转移,本研究有助于探讨ZFAS1在小细胞肺癌发病过程中的作用及相关机制,对寻找小细胞肺癌潜在的治疗靶点具有积极意义。
