玻璃体切割联合视网膜睫状体光凝术与内窥镜睫状体光凝术治疗新生血管性青光眼疗效对比
2020-10-17王楠叶游志鹏李国栋宋映
王楠叶 游志鹏 李国栋 宋映
新生血管性青光眼(neovascular glaucoma,NVG)是临床上常见的致盲性、难治性青光眼,最大的危害是导致不可逆性视力丧失,并伴有持续严重的眼球胀痛[1]。近年来提出的联合抗血管内皮生长因子(vascular endothelial growth factor,VEGF)的玻璃体切割联合视网膜睫状体光凝手术,是以保存视功能为核心治疗目标,完成全视网膜光凝术(panretinal photocoagulation,PRP)为主要途径,抗VEGF治疗和抗青光眼治疗为关键手段的联合治疗方案[2]。内窥镜睫状体光凝术(endoscopic cyclophotocoagulation,ECP)有别于传统的睫状体冷冻术和经巩膜外睫状体光凝术,因其可在直视下光凝,激光能量低、术后炎症反应轻、并发症少,对于需要行白内障手术患者,可同一切口联合行白内障超声乳化术和房角分离手术,是临床治疗NVG的常见手术[3]。本研究对玻璃体切割联合视网膜睫状体光凝术和ECP治疗NVG进行对比,以期为NVG的临床治疗提供参考。
1 资料与方法
1.1 一般资料回顾性病例分析。收集本院收治的NVG患者49例(49眼),按其手术方式分为玻璃体切割联合视网膜睫状体光凝组(A组)和ECP组(B组)。入选标准:(1)临床确诊为NVG,有不同程度虹膜或房角新生血管,用最大剂量药物治疗后眼压>21 mmHg(1 kPa=7.5 mmHg);(2)同意行玻璃体切割联合视网膜睫状体光凝术或ECP;(3)白内障混浊程度需要手术治疗,角膜内皮细胞数≥800个·mm-2;(4)随访时间至少6个月。排除标准:(1)NVG Ⅰ期患者;(2)透明晶状体不适合行睫状体光凝术患者;(3)近3个月内行玻璃体内注药术(抗VEGF药物或激素)者;(4)有严重系统性疾病及手术禁忌证患者。本研究通过南昌大学第二附属医院伦理委员会批准。
1.2 方法
1.2.1 手术器械手术中所用眼内窥镜为Endo Optiks E4,激光型号SLX810,眼内探头直径23 G,视野范围140°,波长810 nm。
1.2.2 手术方法(1)玻璃体内注药术:A组患者取仰卧位,使用表面麻醉剂滴术眼3次,冲洗结膜囊,常规消毒铺巾,距离角膜缘3.5 mm处穿刺巩膜,注入康柏西普或雷珠单抗0.05 mL,拔针后按压1 min。高眼压患者先行角膜缘穿刺放出少量房水,术毕涂妥布霉素地塞米松眼膏后包眼。(2)玻璃体切割联合视网膜睫状体光凝术:A组所有患眼内注射抗VEGF药物3~7 d后,虹膜表面及前房角新生血管明显减少甚至消失,然后接受玻璃体切割术。充分散瞳联合常规球后阻滞麻醉,消毒铺巾,行23 G标准睫状体平坦部三通道玻璃体切割术,白内障患者联合行晶状体超声乳化吸出术,并依据术前屈光状态及视功能情况联合人工晶状体植入术,充分清除周边玻璃体,再行PRP。术中睫状体光凝术:采用巩膜顶压器在角膜缘后顶压,使睫状体周边部的睫状突充分暴露于视野内,采用810 nm激光机及23 G激光光纤对睫状突进行光凝,激光能量以使睫状突呈现白色萎缩为度,光凝范围90°~270°(术前眼压为>40 mmHg者光凝180°~270°,眼压为35~40 mmHg者光凝120°~180°,眼压为<35 mmHg者光凝90°~120°)。(3)ECP:有白内障的患者采用透明角膜切口超声乳化白内障摘出、人工晶状体植入联合房角分离术与ECP。用3.2 mm穿刺刀做角膜切口,先行超声乳化白内障吸出,再将人工晶状体植入囊袋中,行房角分离后用黏弹剂维持前房,同时在虹膜后注入黏弹剂,加宽睫状沟的空间,使睫状突更易见,最后通过角膜切口行ECP。23 G弯形探针从角膜切口进入虹膜后行ECP,术中按顺时针方向行睫状体光凝。光凝完毕后吸净前房黏弹剂并尽量吸净虹膜后黏弹剂,灌注液形成前房并使切口水密。人工晶状体眼患者亦可经睫状体平坦部巩膜切口进入眼球。
1.2.3 术后处理术后局部滴皮质类固醇和抗生素滴眼液,每天4~6次,持续4~6周,全身给予口服强的松30 mg,每天一次,持续1周。术后眼压如果仍高则使用降眼压药物。术后2个月若眼压用药后仍不能控制,可考虑再次手术。
1.2.4 观察项目手术前后常规进行眼部裂隙灯检查及UBM检查了解眼前节、睫状体。术中、术后观察患者对手术的耐受和并发症。术后2 d、7 d、1个月、3个月、6个月随访患者眼压、视力,利用裂隙灯检查虹膜新生血管等。
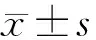
2 结果
2.1 基线资料比较纳入本研究的49例49眼NVG患者中男27例、女22例;A组25例(25眼)中男15例15眼、女10例10眼,年龄(49.16±5.71)岁;术前 BCVA为(1.21±0.46)logMAR,眼压为(46.32±3.52)mmHg。B组24例(24眼)中男12例12眼、女12例12眼,年龄(48.17±4.60)岁;术前 BCVA为(1.22±0.45)logMAR,眼压为(48.38±4.20)mmHg。两组患者性别(P=0.57)、年龄(P=0.51)、术前BCVA(P=0.95)、术前眼压(P=0.069)、NVG分期(P=0.21)及病因构成(P=0.68)比较,差异均无统计学意义,具有可比性。见表1。

表1 受试者基线资料
2.2 眼压术后两组患者各随访时间点眼压均较术前明显下降,差异均有统计学意义(均为P=0.00);术后相同时间点比较,术后2 d、7 d及1个月两组患者眼压差异均有统计学意义(P=0.00、0.04、0.00),术后3个月、6个月两组患者眼压差异均无统计学意义(P=0.68、0.59)(见表2)。

表2 两组患者手术前后眼压比较
2.3 视力A组患者术后6个月BCVA为(0.96±0.38)logMAR;B组患者术后6个月BCVA为(0.89±0.57)logMAR。两组患者术后6个月BCVA比较,差异无统计学意义(P=0.64),两组患者术后6个月BCVA分别与术前相比,差异均有统计学意义(P=0.04、0.03)。
2.4 虹膜新生血管术后两组患者随访6个月,A组新生血管完全消失5眼,部分消失、残留部分血管者17眼,未见明显改善者3眼;B组术后新生血管完全消失2眼,部分消失残留部分血管者4眼,未见明显改善者18眼。两组患者虹膜新生血管消退情况比较,差异有统计学意义(P=0.00)。
2.5 并发症
2.5.1 术中患者耐受情况及并发症A组患者术中因巩膜顶压器在角膜缘后顶压,2例患者诉疼痛。B组患者白内障超声乳化手术中出现前房出血2眼。
2.5.2 术后并发症术后1~2周A组患者2眼瞳孔区可见纤维性渗出、3眼前房积血;术后2个月1眼眼压仍高,为30 mmHg,再次光凝,随访6个月时眼压正常。B组患者中3眼术后1周内出现反应性高眼压,1眼是由于前房内黏弹剂未冲洗干净致高眼压;5眼角膜水肿于1周内消失;术后1~2周,4眼瞳孔区可见纤维性渗出,前房积血11眼,手术后自然吸收9眼,1眼给予YAG激光,1眼给予前房冲洗。术后2个月2眼眼压仍为30 mmHg,行PRP联合再次光凝,随访6个月时眼压正常。两组患者末次随访时均未见眼压过低、持续性低眼压、视网膜脱离、脉络膜脱离及眼球萎缩者。
3 讨论
本研究中两组患者术后眼压均明显下降,表明两组手术方式均能降低NVG患者的眼压;A组患者术后1个月眼压下降较B组更低、更快,是由于A组联合了抗VEGF治疗。在NVG治疗中,抗VEGF药物眼内注射能够很快穿透至虹膜、睫状体及前房角[4],短期内快速消退新生血管,有效降低术前眼压、减少术中及术后出血的发生率和手术并发症,提高手术成功率[5],但其作用时间短暂,新生血管可重新出现,临床观察发现亦存在部分患者眼压并不能随着新生血管的消退而有效下降,且在NVG 治疗的远期观察中降眼压效果与未行眼内注射者并无差异[6],这与本研究结论一致,因此单纯应用抗VEGF药物并不能有效治疗NVG,仍需要进一步行激光及手术治疗[7]。
睫状体光凝术只适用于无视力的近绝对期青光眼,这大大缩小了手术适应证。本研究实施的睫状体光凝术可直视下光凝、能量较以往的透巩膜光凝更低,在进行睫状体光凝术的同时也可对混浊的屈光间质进行清理,视力得到进一步提高,亦为完成PRP创造了条件。A组联合白内障超声乳化术、微创玻璃体切割手术、眼内视网膜激光和直视下睫状体光凝,有效解除了视网膜的缺血缺氧状态,减少了虹膜新生血管的生成,同时镜下行睫状体光凝能更精确评估手术范围,减少并发症的发生,有效保存甚至提高患者术后视力。B组采用同切口联合白内障超声乳化术、房角分离术及ECP,无需打开结膜与制作巩膜瓣,术后角膜切口与白内障超声乳化手术一样仅需水密闭合,手术时间相对缩短。术后没有滤过泡,不存在滤过泡相关并发症,如伤口渗漏、浅前房、脉络膜脱离等[8],术后随访与伤口维护相对简单,患者舒适度更好,对于无法定期随访的患者,更适合选择这一术式。对于闭角型青光眼患者,用内窥镜观察能更充分地分离房角,联合白内障摘出与人工晶状体植入,前房明显加深,分离后的房角开放,可以发挥一部分内引流的功能,更有利于眼压的下降[9]。本研究中两组患者的视功能均能有效保存,甚至部分患者的视力得到了提高。
A组患者术后虹膜新生血管消退情况优于B组,显示了PRP在抗NVG中的作用。PRP是改善视网膜缺血的根本方法[10],当屈光介质不清无法行PRP时,应尽快行恢复屈光间质透明的手术,包括白内障摘出手术或玻璃体切割术,以创造条件完成PRP。视网膜激光可分为眼外和眼内光凝,眼内光凝因为在直视下操作,光凝效果更确切,术中顶压巩膜较容易,联合充分的玻璃体切除和白内障手术,远周边视网膜光凝范围相对更全[11]。
本研究中B组患者2眼出现术中出血,为减少此类并发症,建议分步骤降低术前眼压,减少手术中出血风险,无禁忌证患者术前辅助全身脱水及碳酸酐酶抑制剂应用[12],高出血风险患者行3.2 mm角膜主切口前先行侧切口,并注入足量黏弹剂以维持前房及眼压稳定。B组术后短期高眼压患者1眼由于黏弹剂未冲洗干净,手术结束前应注意充分吸出虹膜后和人工晶状体后的黏弹剂。两组患者均未见眼压过低、持续性低眼压、视网膜脱离、脉络膜脱离及眼球萎缩者,两种手术方式均具有结膜损伤小、屈光间质无混浊的特点,对需再次行PRP和睫状体光凝的患者可重复性好[13]。
综上所述,NVG病情复杂,往往需要多次手术或联合手术,联合抗VEGF的玻璃体切割、视网膜睫状体光凝和ECP均为有效的治疗手段,临床工作中应总结各类手术的利弊,互相补充,提前预判可能出现的并发症并进行及时处理,可达到更加有效治疗的目的。
