不同屈光状态儿童应用盐酸环喷托酯滴眼后1 h内等效球镜度与瞳孔直径达到稳定所需时间及变化幅度的相关影响因素△
2020-10-17金成成裴茹霞杜蓓王希莲刘桂华金楠韩丁刘琳魏瑞华
金成成 裴茹霞 杜蓓 王希莲 刘桂华 金楠 韩丁 刘琳 魏瑞华
睫状肌麻痹验光是临床上诊断屈光不正的金标准[1-4]。目前国内临床常用的儿童睫状肌麻痹剂包括阿托品、托品酰胺和盐酸环喷托酯(cyclopentolate hydrochloride,CH)等。CH的睫状肌麻痹作用强度介于阿托品和托品酰胺之间[5-7],药物副作用发生率仅为阿托品的1/7[8],为国内外临床上用于儿童睫状肌麻痹的首选药物[3-4,9]。2019年国内儿童睫状肌麻痹安全用药专家共识[9]建议6岁以上无内斜视儿童初次验光时使用10 g·L-1CH滴眼液,在表面麻醉后连续滴眼3次,每次间隔5 min,并在最后1次滴眼至少30 min(即第1次滴眼40 min)后验光。然而,在临床中或临床研究中,很多医师在应用CH时因无法直接判断睫状肌麻痹药效,而选择等到瞳孔充分散大时再进行睫状肌麻痹验光,这有可能会增加患者不必要的等待时间进而降低诊疗效率。国外研究报道[10-11],CH的睫状肌麻痹作用和瞳孔散大作用受虹膜色素和种族因素影响。然而,国内相关研究报道指出,中国深色素虹膜儿童在CH滴眼后最大睫状肌麻痹时间为45~60 min不等[12-14],不同研究可能由于屈光状态分布或滴药方法差异导致结果不尽相同。在应用最新专家共识给出的滴药方案时,CH对不同屈光状态下中国棕色虹膜儿童等效球镜度(spherical equivalent,SE)和瞳孔直径(pupil diameter,PD)的影响尚缺乏细致的研究报道。本研究探讨不同屈光状态儿童应用CH滴眼后1 h内SE与PD达到稳定所需时间及变化幅度的相关影响因素,从而指导临床合理选择CH的适用人群与睫状肌麻痹验光时机。
1 资料与方法
1.1 研究对象与分组选取2019年9月首次于天津医科大学眼科医院视光门诊就诊,年龄在6~15岁,拟诊断为屈光不正,需要进行睫状肌麻痹验光的患儿56例100眼,其中男32例,女24例,眼压10.00~21.00 mmHg(1 kPa=7.5 mmHg),眼轴长度21.22~26.40 mm,初始SE范围为 +1.13~-6.25 D,末次SE范围为+2.25~-6.00 D,初始PD 范围为4.35~8.46 mm,末次PD范围为5.95~8.69 mm。根据末次测量的SE将患儿分为3组:(1)近视组(40眼):SE<-0.50 D;(2)正视组(29眼):-0.50 D ≤ SE ≤ +0.50 D;(3)远视组(31眼):SE > +0.50 D。各组间除了眼轴长度、初始SE、末次SE差异均有统计学意义(均为P<0.05)外,年龄、性别构成、眼压、初始PD,差异均无统计意义(均为P>0.05)。本研究遵从《赫尔辛基宣言》,并得到天津医科大学眼科医院伦理委员会批准,全部受试者监护人均签署知情同意书。
1.2 排除标准排除标准包括:(1)存在影响检查或不宜应用CH的眼部疾病,如显斜视、弱视、眼球震颤、重度上睑下垂、角膜瘢痕、白内障、青光眼、眼底病变等[9];(2)眼压高于21 mmHg和(或)伴有浅前房;(3)高度近视(睫状肌麻痹后SE<-6.00 D)和中高度远视(睫状肌麻痹后SE > +3.00 D),单眼散光超过1.50 D,双眼屈光参差超过2.00 D;(4)任何影响瞳孔和眼调节功能的用药史,如使用低浓度阿托品等;(5)角膜接触镜配戴史,如角膜塑形镜等;(6)眼部手术史和外伤史;(7)其他原因无法完成全部检查者。
1.3 检测试剂与仪器10 g·L-1CH滴眼液(比利时s.a.ALCON-COUVREUR n.v.公司),4 g·L-1盐酸奥布卡因滴眼液(日本参天制药株式会社),标准对数远视力表XK100-01(5 M)(温州星康医学科技有限公司),裂隙灯显微镜YZ5F1(威海鼎新光学有限公司),带状光检影镜YZ24、直接眼底镜YZ6E(苏州六六视觉科技有限公司),医用笔灯KZ0003(瑞安康正医疗器械有限公司),自动电脑验光仪KR-800、非接触式电脑眼压计CT-1(日本Topcon公司),光学生物测量仪LS-900(瑞士Haag-Streit AG公司),红外瞳孔计VIP-300(美国NeurOptics公司),验光镜片箱JP-266(丹阳华辉光学仪器有限公司),照度计TASI-600(苏州特安斯电子科技有限公司)。
1.4 临床处理方法对纳入研究的患儿双眼结膜囊内先滴1滴表面麻醉剂(4 g·L-1盐酸奥布卡因滴眼液),2 min后再应用10 g·L-1CH滴眼液进行睫状肌麻痹,每5 min滴眼1次,每次1滴,共计3次。每次滴眼后要求患儿仰头、闭眼,并用医用消毒棉签按压内眦部减少药物全身吸收。在第一滴CH滴眼前和滴眼后1 h内,由同一名研究人员分别应用自动电脑验光仪(精度0.13 D)和红外瞳孔计(精度0.01 mm)监测SE和PD的动态变化,每5 min监测1次,共计13次。每次至少测量3组数据并记录SE和PD的平均值,确保任意两组SE偏差不超过0.25 D,PD偏差不超过0.10 mm,否则重复测量3组数据直至满足要求。末次SE由另一名经验丰富的验光师检影复核。在滴药前,每例患儿均接受常规眼科检查以排除相关眼部疾病并获取眼部屈光发育基础数据,包括视力、裂隙灯及眼底镜检查、角膜映光点检查及遮盖试验、非接触式眼压测量、眼轴长度检测等。
1.5 统计学方法应用SPSS 23.0统计软件进行统计学分析,全部计量资料使用均值±标准差表示。比较分类资料时,应用卡方检验。比较多组计量资料时,若不满足正态分布,应用Kruskal-Wallis检验;若满足正态分布且方差齐性,应用单因素方差分析,组间两两比较应用LSD事后检验;若满足正态分布但不满足方差齐性,应用Welch方差分析,组间两两比较应用Games-Howell事后检验。应用重复测量方差分析比较CH滴眼后1 h内SE和PD在各观察时间点测量值之间的差异,组间两两比较应用Bonferroni事后检验。应用Pearson双变量线性相关分析SE和PD变化幅度的相关影响因素。检验水准:α=0.05。
2 结果
2.1 各组患者SE稳定时间各组患者SE在第一滴CH滴眼后1 h内各个观察时间点测量值见表1。在第一滴CH滴眼后1 h内,重复测量方差分析结果显示,近视组SE随时间显著增大(F=12.232,P<0.001),SE峰值为(-2.29±1.74)D,出现在1 h;正视组SE随时间也显著增大(F=16.692,P<0.001),SE峰值为(-0.09±0.28)D,也出现在1 h;远视组SE随时间也显著增大(F= 57.570,P<0.001),SE峰值为(+1.14±0.48)D,出现在55 min。通过Bonferroni检验进行组间两两比较,结果显示,近视组在第一滴CH滴眼30 min之后(包括30 min),SE峰值与各观察时间点SE测量值之间的差异均无统计学意义(均为P>0.05),差值均不超过0.04 D;正视组在第一滴CH滴眼30 min之后(包括30 min),SE峰值与各观察时间点SE测量值之间的差异均无统计学意义(均为P>0.05),差值均不超过0.13 D;远视组在第一滴CH滴眼35 min之后(包括35 min),SE峰值与各观察时间点SE测量值之间的差异均无统计学意义(均为P>0.05),差值均不超过0.07 D。总体上,95眼(95%)在第一滴CH滴眼后1 h内SE峰值与SE在第一滴CH滴眼后35 min时的测量值之间差异不超过0.25 D。
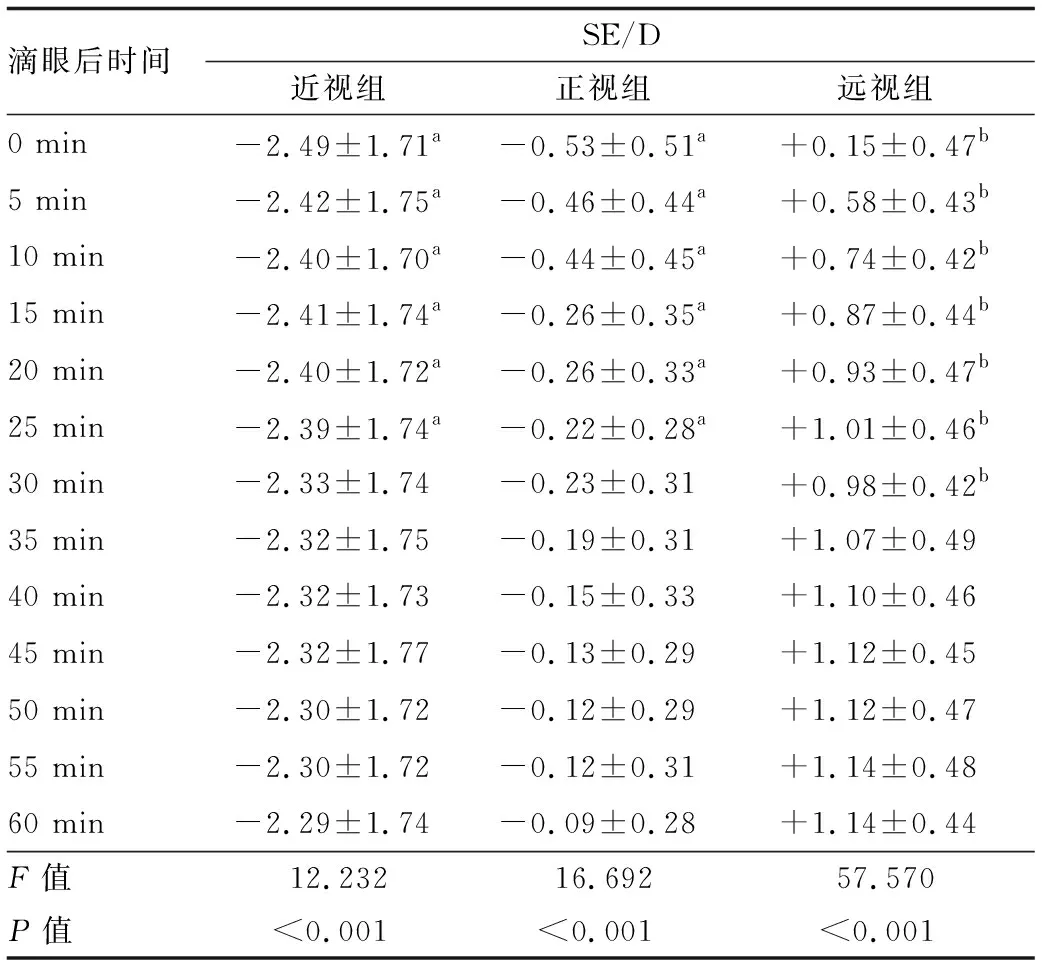
表1 各组患者SE在第一滴CH滴眼后1 h内变化情况
2.2 各组患者PD稳定时间各组患者PD在第一滴CH滴眼后1 h内各个观察时间点测量值见表2。在第一滴CH滴眼后1 h内,重复测量方差分析结果显示,近视组PD随时间显著增大(F=124.392,P<0.001),PD峰值为(7.52±0.69) mm,出现在滴眼后1 h;正视组PD随时间也显著增大(F=68.530,P<0.001),PD峰值为(7.24±0.58) mm,出现在滴眼后1 h;远视组PD随时间也显著增大(F=49.902,P<0.001),PD峰值为(7.33±0.47) mm,出现在滴眼后1 h。通过Bonferroni检验进行组间两两比较,结果显示,近视组在第一滴CH滴眼后55 min内(包括55 min),PD峰值与各观察时间点PD测量值之间的差异均有统计学意义(均为P<0.05),但在55 min时差异(0.07 mm)无临床意义;正视组在第一滴CH滴眼后55 min内(包括55 min),PD峰值与各观察时间点PD测量值差异均有统计学意义(均为P<0.05),但在55 min时差异(0.05 mm)无临床意义;远视组在第一滴CH滴眼后55 min内(包括55 min),PD峰值与各观察时间点PD测量值差异均有统计学意义(均为P<0.05),但在55 min时差异(0.06 mm)无临床意义。总体上,86眼(86%)在第一滴CH滴眼后1 h内PD峰值与PD在第一滴CH滴眼后55 min时的测量值之间差异不超过0.10 mm。
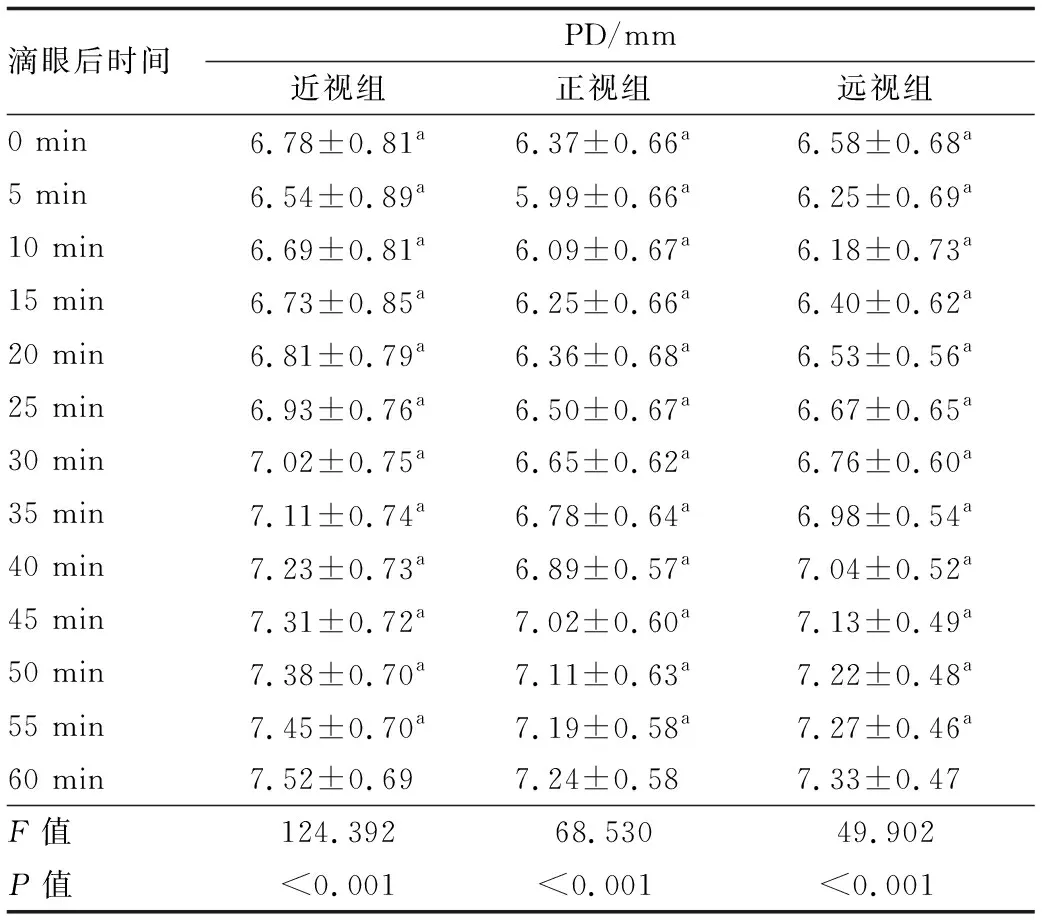
表2 各组患者PD在第一滴CH滴眼后1 h内变化情况
2.3 各组患者SE变化幅度及相关影响因素不同屈光状态组SE在第一滴CH滴眼1 h前后变化幅度见表3。在第一滴CH滴眼后1 h,近视组、正视组和远视组的SE与各组滴药前初始SE相比均增加,增加幅度组间差异有统计学意义(F=29.603,P<0.001)。其中,远视组SE变化幅度显著高于正视组和近视组,差异均有统计学意义(均为P<0.001);正视组SE变化幅度略高于近视组,差异有统计学意义(P<0.05)。Pearson双变量线性相关分析显示,SE变化幅度与眼轴长度(r=-0.445,P<0.001)、年龄(r=-0.225,P=0.024)均呈显著负相关,与末次SE(r=0.543,P<0.001)、初始SE(r=0.297,P=0.003)均呈显著正相关,与性别(r=0.113,P=0.262)、眼压(r=-0.142,P=0.158)均无相关性。

表3 各组患者SE和PD在第一滴CH滴眼1 h前后变化幅度
2.4 各组患者PD变化幅度及相关影响因素不同屈光状态组PD在第一滴CH滴眼1 h前后变化幅度见表3。在第一滴CH滴眼1 h后,近视组、正视组和远视组的PD与各组滴药前初始PD相比均增加,增加幅度组间差异无统计学意义(F=1.756,P=0.182)。Pearson双变量线性相关分析显示,PD变化幅度与初始PD(r=-0.583,P<0.001)呈显著负相关,与年龄(r=-0.008,P=0.933)、性别(r=0.005,P=0.957)、眼压(r=-0.139,P=0.167)、眼轴长度(r=-0.020,P=0.843)、末次PD(r=-0.003,P=0.979)均无相关性。
2.5 不良反应本研究全程未观察到严重不良反应发生。
3 讨论
CH是人工合成的M型胆碱能受体阻滞剂,是目前国内外临床上儿童睫状肌麻痹的常规用药。本研究依据国内专家共识建议的滴药方案应用CH进行儿童睫状肌麻痹验光[9],结果显示在第一滴CH滴眼后1 h内,SE均先于PD达到稳定,绝大多数受试者SE在第一滴CH滴眼后35 min时已达到临床稳定(与峰值之间差值小于0.25 D),但PD至少在第一滴CH滴眼后55 min达到临床稳定(与峰值之间差值小于0.10 mm)。CH滴眼后1 h内SE的变化幅度在不同屈光状态组之间存在显著差异,其中远视组SE变化幅度显著高于正视组和近视组,CH滴眼后1 h内PD的变化幅度在不同屈光状态组之间无显著差异。
在SE稳定时间方面,远视组达到屈光稳定时间为第一滴CH滴眼后35 min,略迟于正视组(30 min)和近视组(30 min),这和远视眼在睫状肌麻痹前后晶状体调节状态变化较大有关。Laojaroenwanit等[15]对60例5~14岁泰国儿童应用CH后发现,近视组(50 min)需要比正视组(30 min)和远视组(30 min)达到屈光稳定的时间更久,且近视组SE数据在30 min和40 min出现不确定的“波动”,这可能和研究者将部分高度近视眼甚至超高度近视眼(高达-15.00 D)和中低度近视眼一并纳入研究有关。高度近视眼或超高度近视眼可伴有后巩膜葡萄肿,这将增加电脑验光结果的不确定性,本研究出于这一考虑未纳入高度近视眼。国内其他研究结果显示,CH滴眼后SE峰值出现在45~60 min不等[12-14],和本研究SE峰值出现时间(55~60 min)接近。然而,临床上仅仅依据SE峰值确定睫状肌麻痹验光时机而不考虑峰值与其相邻时间点测量值之间的统计学差异容易得到过于保守的结论,故本研究采取5 min的时间梯度对峰值SE与不同时间点SE进行两两比较发现,近视组、正视组和远视组SE峰值与刚好达到屈光稳定时SE测量值差值均无统计学意义和临床意义,此时即可进行睫状肌麻痹验光而无需等到SE达到峰值,在保证验光结果准确性的同时缩短患者等待时间、提高临床诊疗效率。
在PD稳定时间方面,不同屈光状态组PD达到稳定的时间一致,且均明显晚于SE达到稳定的时间。本研究发现,在第一滴CH滴眼后35 min时,95眼(95%)SE达到临床稳定,此时近视组、正视组和远视组的PD分别为(7.11±0.74)mm、(6.78±0.64)mm、(6.98±0.54)mm。若按照Manny等[10]提出的PD ≥ 7 mm作为屈光稳定的指征,则在第一滴CH滴眼后35 min时达到屈光稳定的95眼中仅有50眼(53%)符合条件,灵敏度不高,原因在于中国儿童虹膜色素深,瞳孔不容易散大;如果把标准降低到PD≥ 6 mm,在第一滴CH滴眼后35 min时达到屈光稳定的95眼中符合条件的数量增加到91眼(96%),但第一滴CH滴眼后25 min时已有83眼(83%)PD ≥ 6 mm,特异度不高。此外,本研究结果显示,CH滴眼后PD变化幅度与初始PD呈负相关,即CH滴眼前初始PD越小者滴药后瞳孔散大更明显,这也提示根据瞳孔散大情况判断睫状肌麻痹不能普遍适用。因此,临床上将CH用于儿童睫状肌麻痹时,不宜将“瞳孔充分散大”作为判定屈光稳定的依据,否则会增加患者不必要的等待时间。
在SE变化幅度方面,本研究发现不同屈光状态组在CH滴眼后SE变化幅度存在显著差异,远视组SE变化幅度为(0.99±0.54) D,显著高于正视组(0.44±0.45) D和近视组(0.21±0.20) D,且SE变化幅度与近视程度和年龄呈负相关,这与国内外相关研究结论一致[16-18]。但也有部分研究认为,年龄只是作为SE变化幅度与眼压[19]或屈光状态[20]相关的中间变量,和SE变化幅度并不直接相关。文惠园等[18]将894例2~15岁儿童青少年分为4个年龄组及5个屈光状态水平组,结果证实了年龄独立于屈光状态之外对睫状肌麻痹前后SE变化幅度会产生影响,这与本研究结果相符。
在PD变化幅度方面,本研究发现,与初始PD相比,各组在第一滴CH滴眼1 h后PD相比于滴药前平均增加幅度均未超过1.0 mm,低于国内其他研究报道[12-13,21],这和本研究瞳孔测量环境为半暗室导致初始PD较大有关。本研究结果显示,CH滴眼后PD变化幅度与初始PD呈负相关(r=-0.583,P<0.001),初始PD较大者在CH滴眼后PD的变化幅度更小。此外,在第一滴CH滴眼1 h时,各组平均PD在7.2~7.5 mm,高于Manny等[10]报道的深色素虹膜黑人在CH滴眼后1 h的平均PD(7.0 mm),且低于相同条件下的深色素虹膜白人平均PD(8.0 mm)和浅色素虹膜白人平均PD(8.5 mm),这一结果符合种族和虹膜色素影响药物发挥散瞳作用的规律。
另外,本研究发现,在第一滴CH滴眼后5~10 min,不同屈光状态组PD出现不同程度的一过性下降。我们推测,这和用药早期CH散大瞳孔药效尚未充分发挥有关。随着药效的充分发挥,各组PD在20 min左右恢复或超过初始水平,这与既往研究报道CH的散瞳作用在滴眼后10~15 min起效相接近[12,22]。
综上所述,CH可安全、有效应用于6~15岁儿童进行睫状肌麻痹验光。CH滴眼后SE早于PD达到稳定。临床诊疗时,要注意CH麻痹睫状肌和散大瞳孔两方面作用相对独立的药效特点,不宜等到瞳孔充分散大再进行睫状肌麻痹验光,否则将增加患者不必要的等待时间、降低诊疗效率。按照专家共识给出的滴药方案并规范操作下,大多数中国棕色虹膜儿童最早可在第一滴CH滴眼35 min后进行睫状肌麻痹验光。CH对远视和低龄儿童屈光不正度影响更显著,对初始瞳孔小的儿童瞳孔散大作用更明显。
