血管生成素对脂多糖诱导的急性葡萄膜炎小鼠的抗炎作用△
2020-10-17王燕云张栋彦耿园园吴鹏程
王燕云 张栋彦 耿园园 吴鹏程
葡萄膜炎是一种眼内炎症性疾病,葡萄膜炎患者占全世界失明人数的10%~25%。它主要影响葡萄膜,但也可能涉及邻近的结构,如视网膜和玻璃体。尽管自身免疫性疾病和感染是主要病因,但确切的发病机制仍未完全清楚[1]。脂多糖(lipopolysaccharide,LPS)是革兰阴性菌细胞壁的主要成分,可在动物玻璃体内产生急性炎症反应。LPS可诱导促炎因子的释放,包括一氧化氮(NO)、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)和单核细胞趋化蛋白-1等[2]。LPS的炎症反应也可引起氧化应激[3]。血管生成素(angiogenin,ANG)又称核糖核酸酶5,含有123个氨基酸,是泪液的天然成分。有研究指出,ANG与先天免疫及杀菌作用相关[4]。最近,有研究报道ANG在眼表具有抗炎作用[5]。因此,本研究旨在评估ANG 在LPS诱导的小鼠急性葡萄膜炎模型中的抗炎作用。
1 材料与方法
1.1 主要试剂与仪器手术显微镜(德国蔡司公司);裂隙灯数码图像处理系统(美国晴乐公司);分光光度计(北京世纪科信科学仪器有限公司);ANG(上海赛默选择生物发展有限公司);LPS(美国Sigma公司);NO、TNF-α、IL-6、总氧化状态(total oxidant status,TOS)和总抗氧化状态(total oxidant status,TAS)ELISA试剂盒(上海内含子生物科技有限公司)。
1.2 实验动物及分组雄性BALB/c小鼠(体质量22~28 g),购于兰州大学实验动物中心。室温下自由饮食和饮水。将BALB/c小鼠随机分成对照组、模型组和ANG组,每组各10只。ANG组小鼠给予ANG滴眼液(ANG溶于生理盐水,100 mg·L-1·d-1),对照组和模型组均给予等体积生理盐水。连续给药3 d后,模型组和ANG组小鼠在玻璃体内注射125 mg·L-1的LPS 2 μL建立急性葡萄膜炎模型。LPS给药24 h后,各组小鼠分别在显微镜下用30号针头前房穿刺,收集双眼房水(15~25 μL)。其中一眼在室温下用40 g·L-1多聚甲醛液固定进行组织病理学评价,另一眼在-80 ℃下保存进行生物化学分析。
1.3 裂隙灯观察及评分造模 24 h 后,对各组小鼠采用裂隙灯显微镜观察炎症反应,拍照并记录临床体征。临床分级如下:0级定义为没有明显的炎症反应;1级为虹膜血管轻度扩张;2级为虹膜血管中度扩张,伴轻度前房闪辉;3级为虹膜血管显著扩张伴重度前房闪辉;4级为3级的临床表现伴纤维性渗出。
1.4 生物化学检测将房水样本悬浮在等量的Turk染色液中,并在光学显微镜下用血细胞仪进行浸润细胞检测。细胞数量是从每个样本中随机选择4个视野的平均计数。用Lowry法测定微蛋白水平。用ELISA试剂盒测定NO、TNF-α和IL-6的浓度。
1.5 房水和眼组织氧化应激标志物分析造模 24 h 后,每组随机麻醉并处死 5只小鼠,立即取出双眼眼球,其中一眼用于测量氧化应激标志物。由于晶状体中有高浓度谷胱甘肽,所以从摘除的眼球中移除。测量眼部虹膜组织的质量,将其分解成小的碎片,放入空的玻璃管中,然后每克组织加入140 mmol·L-1KCL溶液1 mL,混合均匀,离心(12 000 r·min-1)10 min。采用相应的检测试剂盒在上清液和眼部组织样本中测量TOS、TAS,并计算氧化应激指数(oxidant stress index,OSI)。
1.6 病理学检查将取出的另一眼球固定于40 g·L-1多聚甲醛液中过夜。然后进行蔗糖梯度脱水包埋,制作眼球石蜡组织切片,厚度为 4 μm,进行 HE 染色。病理分级如下:0级为正常组织;1级为虹膜血管扩张、虹膜基质增厚、渗出物、蛋白和(或)前房散在少量炎症细胞;2级为炎症细胞浸润到虹膜和(或)睫状体基质,前房有中等数量炎症细胞;3级为虹膜基质、睫状体和前房内炎症细胞大量浸润;4级为细胞大量渗出,前房蛋白密集聚集,角膜内皮炎症细胞沉积[6]。
1.7 统计学处理采用SPSS 20.0统计学软件进行分析,数据以均数±标准差表示,多组间比较采用单因素方差分析,然后进行Tukey多重比较。检验水准:α=0.05。
2 结果
2.1 各组小鼠眼内炎症临床评分对照组未观察到炎症反应,模型组显示炎症反应包括充血和水肿,伴有瞳孔缩小,ANG组可抑制炎症反应(见图1)。与对照组临床评分(0分)比较, 模型组注射LPS后24 h临床评分[(3.5±0.5)分]显著增高(P<0.05)。而ANG组[(2.3±0.3)分]较模型组降低(P<0.05)。
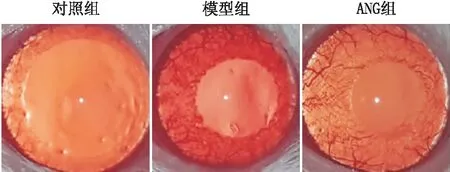
图1 注射LPS后24 h裂隙灯显微镜下观察各组炎症情况
2.2 各组小鼠房水浸润细胞数和蛋白浓度与对照组相比,模型组小鼠LPS注射24 h后房水浸润细胞数增加(P<0.05)。与模型组相比,ANG组小鼠细胞数减少(P<0.05)。与对照组相比,模型组小鼠房水蛋白浓度升高(P<0.05)。与模型组相比,ANG组蛋白浓度降低(P<0.05)(见表1)。

表1 3组小鼠房水浸润细胞数和蛋白浓度比较(n=5)
2.3 各组小鼠房水中炎症细胞因子模型组小鼠房水中NO、TNF-α和IL-6浓度均明显高于对照组(均为P<0.05)(见表2)。而ANG组小鼠房水中NO、TNF-α和IL-6浓度均较模型组显著降低(均为P<0.05)。
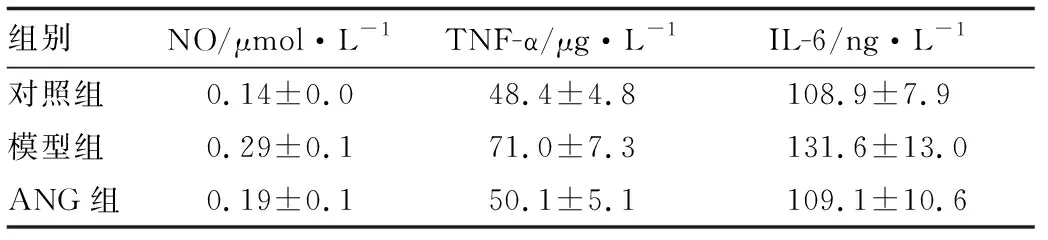
表2 3组小鼠房水中炎症细胞因子比较(n=5)
2.4 各组小鼠房水及眼组织OSI模型组小鼠房水及眼组织OSI均高于对照组(均为P<0.05),而ANG组小鼠房水及眼组织OSI均较模型组降低(均为P<0.05)(见表3)。

表3 3组小鼠房水及眼组织OSI比较(n=5)
2.5 各组小鼠眼内炎症组织病理学评分对照组小鼠眼组织切片未见浸润的炎症细胞,模型组大量炎症细胞(黑箭头)浸润葡萄膜组织,ANG组炎症细胞浸润减少(见图2)。与对照组组织病理学评分(0分)比较,模型组组织病理学评分[(2.0±0.2)分]显著增高(P<0.05)。而ANG组组织病理学评分[(0.8±0.1)分]较模型组降低(P<0.05)。
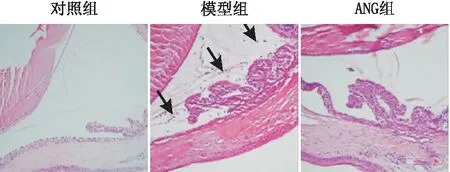
图2 注射LPS后24 h 各组HE染色(×200) 黑箭头示炎症细胞
3 讨论
以往研究证实,ANG在血管生成、细胞增殖、迁移和分化中起重要作用[7]。尽管近年来的研究多关注ANG在癌症治疗方面的潜力,但ANG也以其抗菌活性与多种炎症疾病和先天性免疫有关[8]。至今,还没有证据来阐明ANG与炎症的关系。以往研究证实,ANG通过降低TNF-α和NF-κB核转运在角膜成纤维细胞中具有抗炎作用[5]。葡萄膜炎是一种炎症性眼内疾病,主要损伤葡萄膜。由于自身免疫性葡萄膜炎的形成和发展的病因尚未完全清楚,目前尚无明确的治疗方法。目前临床上主要治疗药物是皮质类固醇,但类固醇可能导致严重并发症,如青光眼和白内障[9]。因此,为了减少皮质类固醇引起的并发症,需要寻找新的抗炎化合物,评估葡萄膜炎的非类固醇治疗策略已成为热点。LPS通过激活TNF-α、IL-6、单核细胞趋化蛋白-1和NO等炎症细胞因子表达和释放,刺激炎症反应[10]。除了LPS直接激活炎症细胞因子外,由此产生的氧化应激还可以调节炎症信号[11]。此外,NO会加剧氧化损伤。因此,我们假设ANG可能抑制葡萄膜炎,本研究首次证明了ANG在小鼠急性葡萄膜炎模型中具有显著的抗炎作用。房水细胞计数和蛋白浓度是急性葡萄膜炎模型血-房水屏障完整性的有用指标,LPS可使两者升高。与以往的葡萄膜炎研究[2]一致,LPS诱导的急性葡萄膜炎小鼠房水中NO、TNF-α和IL-6浓度升高,ANG组这3种炎症因子的水平降低了。与抑制炎症因子一致,ANG也显著改善了急性葡萄膜炎模型的临床严重程度和组织病理学征象。ANG组房水和眼组织的OSI也降低了,但这种效果在房水中表现更显著,可能是由于眼组织接触受限。鉴于氧化应激有助于LPS诱导炎症反应,氧化应激减少可能解释急性葡萄膜炎模型炎症的临床和组织病理学症状改善。ANG对LPS刺激的抗炎作用依赖于抑制NO和IL-6产生,以及抑制NF-κB转录活性及其下游途径[12]。本研究与这些研究结果一致,证实ANG的抗炎活性是通过抑制TNF-α、NO和IL-6的产生来介导的,从而减轻葡萄膜炎症。
综上所述,本研究首次证明,ANG预处理可以缓解LPS诱导的小鼠急性葡萄膜炎模型的炎症和氧化应激。因此,ANG可能有助于葡萄膜炎的治疗,同时消除类固醇治疗的不良影响。
