复合香辛料提取物结合真空包装抑制风干肠贮藏过程中生物胺积累及品质劣变
2020-10-16孙钦秀杜洪振刘昊天刁新平孔保华
孙钦秀 杜洪振 刘昊天 刁新平 孔保华*
(1 广东海洋大学食品科技学院 广东湛江524088 2 东北农业大学食品科技学院 哈尔滨150030 3 东北农业大学动物科技学院 哈尔滨150030)
近年来,随着消费水平的提高,人们对健康安全食品的需求日益增长。发酵肉制品的安全性也引起人们的关注。发酵肉制品中含有一定量的生物胺。生物胺是低分子质量有机碱性化合物,广泛存在于多种食品中,如鱼和鱼制品、肉类制品、乳制品、葡萄酒以及其它发酵食品[1]。生物胺主要是由氨基酸的脱羧作用或醛类和酮类物质的胺化反应生成,前者为生物胺生成的主要途径,富含蛋白质的发酵肉制品中经常含有大量的生物胺[1]。生物胺在活细胞中具有重要的生物活性功能,部分生物胺为神经系统生长所必不可少的物质。然而,当生物胺摄入过量时会导致恶心、头痛、皮疹、头晕、心悸、脑出血甚至死亡。此外,一些二元胺还是致癌物质——亚硝胺类物质的前体物质[2]。食品中高浓度的生物胺也是食品被微生物污染的一个重要标志[3]。国内外一些学者的研究表明,发酵肉制品中生物胺超标已经成为重要的食品安全问题[4-5]。
香辛料是一种天然植物提取物,添加香辛料提取物不仅能赋予食物特定的风味、颜色及香味,而且对多种微生物生长具有很好的抑制作用,是一种有效的非化学抑菌剂[6]。食品中生物胺主要是由一些微生物(主要是腐败微生物)产生的氨基酸脱羧酶对氨基酸脱羧后产生、积累的,可通过添加香辛料提取物抑制食品中腐败菌的生长,间接抑制食品中生物胺的积累。目前国内外相关研究较少,大多数研究集中在鱼肉产品,而对风干肠贮藏过程中生物胺的积累研究较少。作者前期研究表明:肉桂、丁香和八角复合香辛料提取物可有效抑制风干肠发酵过程中生物胺的积累。在此研究基础上,本文研究复合香辛料提取物(肉桂、丁香和八角)结合真空包装对哈尔滨风干肠贮藏过程中生物胺积累的影响,同时考察其对风干肠pH 值、水分含量、水分活度、挥发性盐基氮(TVB-N)值、硫代巴比妥酸(TBARS)值、微生物菌数以及感官品质的影响。
1 材料与方法
1.1 材料与试剂
猪臀肉、猪肥膘、盐、酒、味素、八角、肉桂、丁香,哈尔滨香坊大润发超市。
生物胺标品(酪胺、尸胺、色胺、组胺二盐酸盐、腐胺二盐酸盐和2-苯乙胺盐酸盐),美国Sigma 公司;乙腈,德国Merck 公司;盐酸、高氯、酸邻苯二甲醛、乙醇、甲醇、氧化镁、辛烷磺酸钠、冰乙酸、硼酸、氢氧化钾、无水乙酸钠、硼酸、β-巯基乙醇、三氯甲烷、三氯乙酸、硫代巴比妥酸、氢氧化钠、亚硝、葡萄糖,哈尔滨道外区盛达化验仪器销售公司。
1.2 仪器与设备
Agilent1100 高效液相色谱仪,美国Agilent 公司;PHS-3C 精密pH 计,上海雷磁仪器厂;721 型可见分光光度计,上海元析仪器有限公司;高压蒸汽灭菌锅,上海申安医用仪器厂;GC-3L 小型灌肠机,瑞安市鸿飞机械有限公司;摇床培养箱,哈尔滨东联电子技术开发有限公司。
1.3 试验方法
1.3.1 香辛料提取物的制备 香辛料提取物的制备参考孙钦秀等[7]的方法。将肉桂、八角和丁香在60 ℃下干燥24 h,然后用超细粉碎机粉碎。将50 g 香辛料粉末浸泡在400 mL 95%食用酒精中搅拌12 h,并保持水浴温度为55 ℃。对溶液抽滤,并将滤渣重复提取2 次,合并滤液。将滤液用旋转蒸发器在55 ℃下去除乙醇。将浓缩液冻干并研磨成粉末,置于-20 ℃冰箱保存待用。
1.3.2 哈尔滨风干肠的制作 哈尔滨干香肠的制作参考Sun等[8]的方法,将质量比为9∶1 的瘦猪肉与肥猪膘用1.5 cm 孔板的绞肉机绞碎,加入辅料(质量分数分别为2.5%,5%,0.01%,0.3%,1%的氯化钠、葡萄糖、亚硝酸钠、味素和45 度曲酒)。将肉馅混合均匀后分成均等的2 份,1 份不添加复合香辛料提取物为对照组,另一份添加复合香辛料提取物(肉桂∶八角∶丁香=1∶1∶1;复合香辛料/肉糜,0.3 g/kg),将肉馅充分混匀后灌入天然猪肠衣(直径约3 cm),每根风干肠重约0.15 kg。将灌好的风干肠将在温度为(25±2)℃下风干24 h(相对湿度为30%~50%),然后转移到(25±2)℃,相对湿度为75%~80%的恒温恒湿箱中发酵9 d。发酵结束后将2 组风干肠分别用真空包装和普通保鲜袋包装(PE),于4 ℃冰箱保藏,分别在贮藏第0,10,25,45 天取样检测,感官评价是在贮藏第45 天后检测。
1.3.3 生物胺的测定 生物胺的测定采用高效液相色谱法,参考Sun等[8]的方法测定。取10 g 切碎的风干肠样品加入0.4 mmol/L 高氯酸均质。将混合液在离心力为9 000×g 条件下离心10 min。将上清液过滤,重复提取滤渣1 次。将所得上清液混合并用0.4 mmol/L 高氯酸定容50 mL。将溶液经0.22 μm 膜过滤。采用高效液相色谱法测量溶液中生物胺含量,液相色谱条件与Sun等[8]的测定条件相同。
1.3.4 pH 值、水分含量和水分活度的测定 pH值的测定参照GB 5009.237-2016 《食品pH 值的测定》[9]测定。水分含量的测定参照GB 5009.3-2016《食品中水分的测定》[10]测定。将样品切碎,铺满样品盒底部,使用水分活度仪测定水分活度。
1.3.5 挥发性盐基氮值的测定 挥发性盐基氮值的测定Sun等[8]的方法测定。将样品切碎,取10.0 g 样品加100 mL 水置于锥形瓶中,浸渍30 min 后过滤,滤液冷藏备用。
将10 mL 硼酸吸收液(20 g/L)及2~3 滴甲基红-乙醇溶液(2 g/L)与次甲基蓝溶液(1 g/L)体积比为1∶1 的混合指示剂加到接收瓶中,冷凝管的下端置于混合液液面以下。准确吸取5.0 mL 过滤好的滤液加到蒸馏器反应室,加入等体积氧化镁混悬液(10 g/L),迅速盖塞,通蒸汽进行蒸馏,直到锥形瓶中液面上升到150 mL 时停止反应(约5 min 左右)。用盐酸标准滴定溶液(0.01 mol/L)滴定吸收液,蓝紫色为终点,挥发性盐基氮值按照式(1)计算:

式中,V1——样液消耗盐酸标准溶液的体积,mL;V2——对照组消耗盐酸标准溶液的体积,mL;c——盐酸标准溶液的浓度,mol/L;m——试样质量,g。
1.3.6 硫代巴比妥酸值的测定 TBARS 值的测定参照Wang等[12]方法并略作修改。准确称取2.0 g 切碎的样品放入试管中,分别加入3 mL 硫代巴比妥酸溶液和17 mL 三氯乙酸-盐酸溶液,混匀后沸水浴中加热30 min,迅速冷却至室温,吸取5 mL 反应后的样品加入等体积的三氯甲烷,于1 000 g 下离心10 min,并在波长532 nm 处测定上清液的吸光度。TBARS 以每千克脂质氧化样品中丙二醛的质量表示,按照式(2)计算:

式中,A532——样品的吸光度;M——样品的质量,g。
1.3.7 微生物的测定 微生物的测定参考Wang等[13]的方法并略作改动。无菌条件下,取切碎的已去除脂肪和结缔组织的肠10.0 g,加入90 mL 生理盐水,均质2 min,10 倍梯度稀释溶液,每个溶液做3 个平行板。在营养琼脂固体培养基上于37℃培养48 h 后进行好氧菌的计数;在乳酸菌培养基(De man rogosa sharpe,MRS)上于30 ℃培养48 h 后进行乳酸菌的计数;在结晶紫中性红胆盐葡萄糖琼脂固体培养基上37 ℃培养48 h 后进行肠杆菌的计数。
1.3.8 感官评价 感官评价参考Sun等[8]的方法。将风干香肠在100 ℃下煮15 min,对样品进行随机编号,由10 名经过感官评价培训的人员进行感官评价。要求每名成员对风干肠的颜色、滋味、风味、酸味、咀嚼性以及整体可接受性方面进行评价。评分原则采用7 分制。每项总分通过平均分计算获得。
1.4 统计分析
所有数据采用分析软件Statistix 8.1 的一般线性模型程序分析。采用单因素方差分析(ANOVA)确定显著性,置信区间设置为95%(P<0.05),结果表示为±s,每个试验重复3 次(微生物计数重复6 次)。主成分分析采用SPSS 22.0 软件,作图采用Sigmaplot 12.5 软件。
2 结果与分析
2.1 风干肠贮藏过程中生物胺含量的变化
各组风干肠在贮藏过程中6种生物胺含量的变化情况如图1所示。由图1a可知,贮藏第0 天,对照组酪胺含量显著高于复合辛料提取物组(P<0.05),随着贮藏时间的延长,各组风干肠中酪胺含量呈逐渐上升的趋势。对于贮藏时间和种类相同的风干肠,PE 包装组中酪胺含量显著高于真空包装组(P<0.05),这说明真空包装可以有效抑制风干肠中酪胺的积累。对于贮藏时间和包装相同的风干肠,对照组风干肠中酪胺含量显著高于添加复合香辛料提取物组(P<0.05),说明贮藏过程中,添加复合香辛料提取物可以有效抑制风干肠中酪胺的积累,至贮藏末期(45 d),真空复合香辛料提取物组酪胺含量最低,较PE 对照组低44.85%(P<0.05)。Lu等[3]研究表明向熏马肠中加入植物提取物(茶多酚、肉桂、丁香、姜和八角茴香精油),可以有效抑制其贮藏过程中生物胺的积累。
图1b 和图1c 分别为风干肠贮藏过程中腐胺和尸胺含量的变化,腐胺和尸胺含量变化相似。贮藏第0 天,PE 对照,真空对照,PE 复合香辛料提取物和真空复合香辛料提取物组的腐胺和尸胺含量分别为52.04,51.66,39.93,39.633 mg/kg 和55.00,55.01,41.26,41.927 mg/kg,未添加复合香辛料提取物的2 个处理组腐胺和尸胺含量显著高于添加复合香辛料提取物的2 个处理组,这可能是因为添加复合香辛料提取物可以有效抑制风干肠中一些腐败菌(包括生物胺阳性菌)的生长,从而抑制了腐胺和尸胺的积累。贮藏初期(0~10 d)各组风干肠腐胺和尸胺含量迅速上升,贮藏第10~45 天,风干肠腐胺和尸胺含量上升速度缓慢,这可能是随着贮藏时间的延长,风干肠水分含量下降,微生物的生长活动受到抑制,使生物胺的积累速度减慢。贮藏后期,真空包装组腐胺和尸胺含量显著低于PE 包装组,真空包装复合香辛料提取物组腐胺和尸胺的含量最低,分别比PE 包装对照组低26.88%和31.87%。这可能是因为真空包装可以有效抑制贮藏过程中腐败菌的生长,从而抑制了腐胺和尸胺的积累。
组胺是发酵肉制品中毒性最大的生物胺[14]。随着贮藏时间的增加,PE 包装对照组风干肠中组胺含量呈直线上升趋势,增加速率显著高于其它各组(P<0.05),贮藏期间由最初的28.39 mg/kg 增加到最终的53.35 mg/kg,至贮藏第45 天,真空包装复合香辛料提取物组的组胺含量显著低于其它各组(P<0.05),说明添加复合香辛料提取物结合真空包装可以有效抑制风干肠贮藏期间组胺的积累。与作者的研究相似。Dani等[15]研究表明真空包装在一定条件下可以有效抑制玉梭鱼冷鲜保藏时组胺的积累。
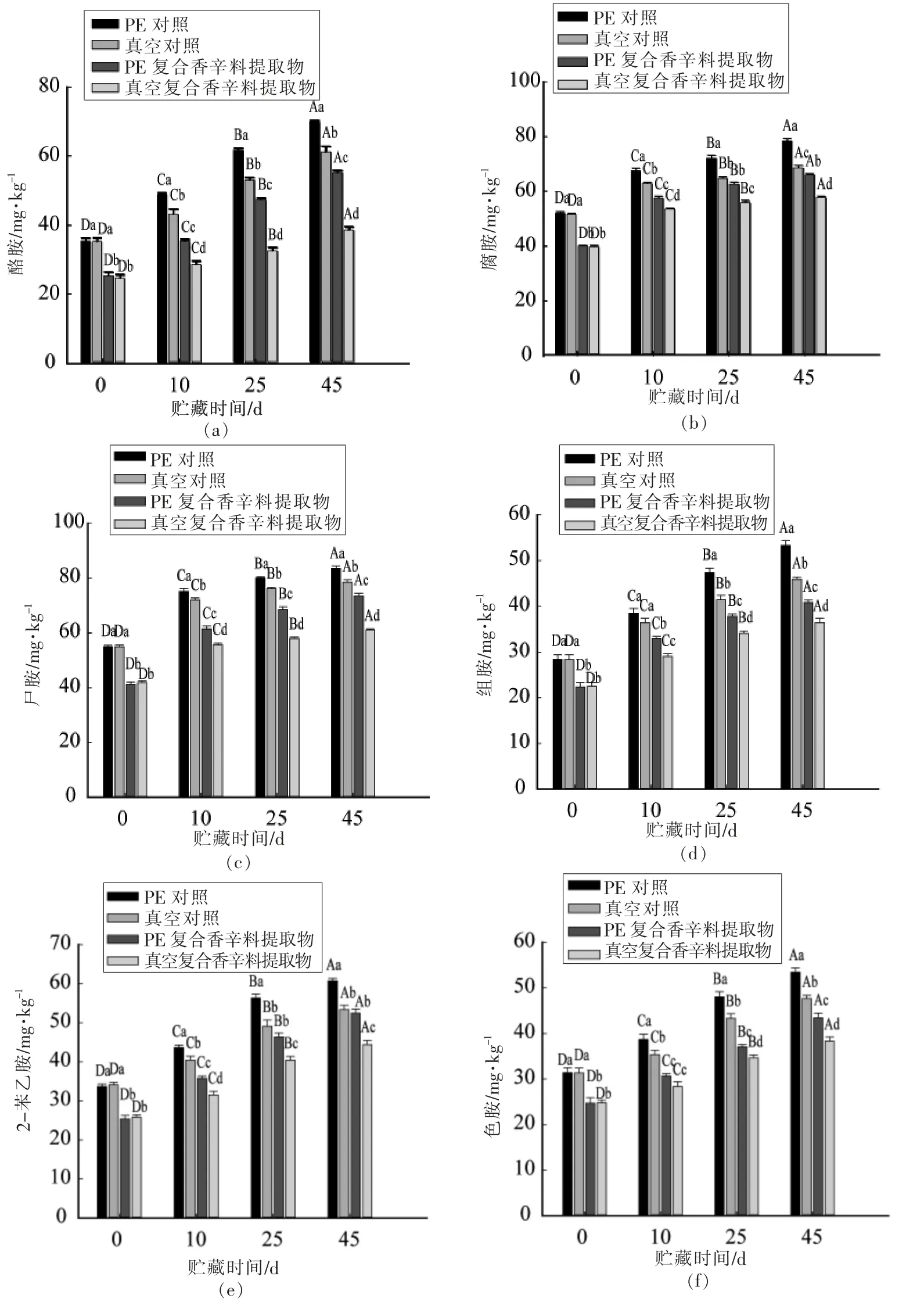
图1 风干肠贮藏过程中生物胺含量的变化Fig.1 Changes of biogenic amines in dry sausage during storage
不同包装方式风干肠贮藏过程中2-苯乙胺和色胺的含量变化分别如图1e 和图1f所示。贮藏0~25 d,各组风干肠中2-苯乙胺和色胺迅速积累;贮藏第25~45 天,2-苯乙胺和色胺的积累速度变慢。真空包装各组风干肠2-苯乙胺和色胺含量显著低于PE 包装的(P<0.05)。同种包装条件,对照组2-苯乙胺和色胺含量显著高于添加复合香辛料提取物组。这表明真空包装和添加复合香辛料提取物都是抑制风干肠贮藏过程中2-苯乙胺和色胺积累的有效手段。
2.2 风干肠贮藏过程中pH 值的变化
不同风干肠在贮藏过程中pH 值变化如图2所示。贮藏开始时,PE 对照组、真空对照组、PE 复合香辛料提取物组和真空复合香辛料提取物组的pH 值分别为5.42,5.39,5.12,5.12。随着贮藏时间的延长,各组风干肠pH 呈逐渐上升趋势,这可能是由于贮藏过程中,腐败菌分解蛋白质产生碱性物质(氨和胺等)积累造成的。贮藏第0 天,对照组风干肠pH 值比添加香辛料提取物组高5.53%,这可能随是因为添加复合香辛料提取物可以有效抑制腐败菌生长,减少其碱性代谢产物的产生[8],从而使风干肠具有相对较低的pH 值。贮藏末期,真空包装组的pH 值显著低于PE 包装组,这是因为真空包装条件下,环境中缺乏氧气,使得一些好氧腐败菌的生长受到抑制,从而减缓风干肠pH 值的回升。
2.3 风干肠贮藏过程中水分含量和水分活度的变化

图2 风干肠贮藏过程中pH 值的变化Fig.2 Changes of pH in dry sausage during storage
风干肠在贮藏过程中水分含量的变化如图3a所示。贮藏第0 天,各组风干肠间水分含量差异性不显著(P>0.05)。随着贮藏时间的延长,各组风干肠中水分含量呈逐渐下降趋势。PE 包装的各组风干肠,由于透气性较好,风干肠中的水分可以挥发到空气中,而真空包装的透气透水性均较差,因此PE 包装组风干肠水分含量下降速度显著高于真空包装的各组风干肠(P<0.05)。至贮藏第45 天时,PE 包装的各组风干肠水分含量均显著低于真空包装的各组风干肠。与本研究相似,杜敏等[16]的研究表明真空包装可以防止水分的过分损失,抑制腐败菌的生长。

图3 风干肠贮藏过程中水分含量和水分活度的变化Fig.3 Changes of miosture content and water activity in dry sausage during storage
不同包装方式风干肠在贮藏过程中水分活度的变化如图3b所示。水分活度随贮藏时间的变化趋势与水分含量相似,然而水分活度降低速度较慢,这可能与各组风干肠pH 值上升有关。随着贮藏时间的延长,真空包装水分活度降低速度显著低于PE 包装各组风干肠水分降低速度(P<0.05)。
2.4 风干肠贮藏过程中TVB-N 值的变化
风干肠贮藏过程中TVB-N 值的变化如图4所示。随着贮藏时间的延长,各组风干肠的TVBN 值呈上升趋势,这可能与贮藏期间腐败菌内源酶的活性有关[17]。贮藏初期,各组风干肠TVB-N值增加较慢,这有可能是由于产酸菌产生的有机酸中和了具有挥发性的碱性物质造成的。而贮藏后期,风干肠TVB-N 值增加速度变快。对于同种风干肠真空包装组TVB-N 值比PE 包装组增加慢,说明真空包装可以抑制风干肠的腐败变质。贮藏末期真空复合香辛料提取物组的TVB-N 值最低为49.97 g/100 g,比PE 对照组低17.71%,这是因为复合香辛料提取物和真空包装对风干肠贮藏过程中腐败菌生长的抑制具有协同作用,从而有效抑制了风干肠贮藏过程中TVB-N 值的增加。
2.5 风干肠贮藏过程中TBARS 值的变化
风干肠在贮藏过程中TBARS 值变化如图5所示。贮藏第0 天,对照组风干肠TBARS 值显著高于添加复合香辛料提取物组(P<0.05),这表明发酵过程中添加复合香辛料提取物可以抑制风干肠的氧化。贮藏前期,各组风干肠的TBARS 值呈逐渐上升趋势,说明此时各组风干肠的氧化程度加大。贮藏后期,各组风干肠TBARS 值呈缓慢下降趋势,至贮藏第45 天,各组风干肠TABRS 值显著不同(P<0.05),PE 包装对照组最高,其次为真空包装对照组和PE 包装复合香辛料提取物组,而真空包装复合香辛料提取物组的TBARS 值最低,说明真空包装由于氧气的缺乏可有效抑制一些腐败菌的生长,从而降低风干肠脂肪氧化程度。贮藏后期TBARS 值呈下降趋势,这可能是由于脂肪氧化后期,一些过氧化物逐步分解生成低级的醛、酮、醇、羧酸及杂环化合物等[18],也有可能与丙二醛与蛋白质发生反应有关[19],与本研究结果相似。綦菁华等[20]研究表明,添加植物提取物茶多酚可有效抑制猪肉糜中的脂肪氧化。

图4 风干肠贮藏过程中TVB-N 值的变化Fig.4 Changes of TVB-N in dry sausage during storage

图5 风干肠贮藏过程中TBARS 值得变化Fig.5 Changes of TBARS in dry sausage during storage
2.6 风干肠贮藏过程中微生物的变化
不同包装方式的风干肠贮藏过程中微生物含量变化如图6所示。贮藏第0 天,复合香辛料提取物组好氧菌数为7.52 lg(CFU/g),显著低于对照组(P<0.05,图6a)。随着贮藏时间的延长,各组风干肠总菌数呈逐渐上升趋势。对于同种包装,对照组风干肠好氧菌数上升速度显著高于复合香辛料提取物组(P<0.05),这是因为香辛料提取物具有一定的抑菌作用[21],可以有效抑制一些杂菌的生长,从而使好氧菌总数降低。对于同种风干肠,真空包装组好氧菌数增长显著低于PE 包装组风干肠(P<0.05),这是因真空包装可以有效抑制风干肠好氧菌数的增长。由图6b可知,乳酸菌是风干肠中主要的微生物,这与胡萍[22]发现乳酸菌是真空包装烟熏火腿切片中主要微生物的结果相似。风干肠贮藏过程中乳酸菌数变化趋势与好氧菌数类似,均呈上升趋势。同一贮藏时间,对于同种风干肠,真空包装组风干肠乳酸菌数显著低于PE 包装组(P<0.05)。至贮藏末期,真空复合香辛料提取物组乳酸菌数显著低于其它各组(P<0.05),而其它3组间差异性不显著(P>0.05)。如图6c所示,随着贮藏时间的延长,各组风干肠中肠杆菌数呈逐渐上升的趋势。贮藏第0 天,对照组、添加复合香辛料提取物组风干肠中肠杆菌数分别为2.04 lg(CFU/g)和1.34 lg(CFU/g);至贮藏第45 天,肠杆菌数分别增加到1.88 lg(CFU/g)和2.98 lg(CFU/g)。对于同种风干肠,真空包装组肠杆菌数比PE 包装组增加缓慢。对于同种包装组风干肠,对照组肠杆菌数增加最快,而添加复合香辛料提取物组肠杆菌数增加最慢。与本研究相似,赵丽华等[23]研究表明,添加天然香辛料可有效抑制羊肉发酵香肠贮藏过程中腐败菌和致病菌的生长。钟赛意等[24]研究表明罗非鱼冷藏过程中微生物的生长与腐胺、尸胺、组胺的积累具有显著的相关性(P<0.05),可以通过抑制一些生物胺阳性微生物的生长控制肉制品中生物胺的含量,保障肉制品的安全生产。
2.7 风干肠感官评价

图6 风干肠贮藏过程中微生物的变化Fig.6 Changes of microorganisms in dry sausage during storage
不同包装方式贮藏45 d 后风干肠的感官评价如表1所示。对于颜色而言,真空包装组获得了较高的得分,这可能是因为真空包装组水分损失少,氧化程度小,导致风干肠的色泽损失较小;而PE 包装组风干肠由于氧化过度呈现较暗的红褐色。对于滋味和气味而言,同种包装风干肠中,添加复合香辛料提取物组得分最高,对照组得分最低(P<0.05),这主要与香辛料提取物本身具有调味作用有关;而对于同种风干肠,真空包装组得分较高,这可能是由于PE 包装组中腐败菌的生长以及脂肪的过度氧化等改变了风干肠原有的风味。对于酸味而言,真空包装组风干肠在酸味方面获得较高的得分,这主要是由于PE 包装组风干肠腐败菌的生长,导致pH 回升较快。对于整体可接受性而言,真空包装复合植物提取物组风干肠获得了最高的得分(P<0.05);而对于同种风干肠,真空包装组获得了较高的分,说明添加复合香辛料提取物结合真空包装可以有效抑制风干肠贮藏过程中感官品质的降低。

表1 风干肠贮藏45 d 后感官评定结果Table 1 The yesult of sensory evaluation of dry sausages after storage for 45 d
2.8 主成分分析
本文对发酵风干肠贮藏第45 天的理化指标、微生物指标及感官品质间进行了主成分分析(PCA)。通过PCA 提取了2 个主成分,解释了总方差的98.47%(PC1 78.08%和PC2 20.39%)。PCA的载荷图如图7所示,可以看出表征风干肠特征的指标位于第1 和第2 象限。4 个不同处理组分别位于第1,2,3,4 象限,表明贮藏45 d 后,4 个处理组的理化性质、微生物性质及感官品质间有显著的差异。对比载荷图和得分图可以发现,PE 对照与酪胺、腐胺、尸胺、组胺、2-苯乙胺、色胺、总好氧菌、乳酸菌、肠杆菌、pH 值、TVB-N 和TBARS在同一象限且距离较近,表明在PE 对照组中这些指标具有较高的数值,同时真空复合植物提取物距离指标最远,表明其在这些指标中具有较低的数值。这也表明生物胺与总好氧菌数、乳酸菌数、肠 杆 菌 数、pH 值、TVB-N 值 和TBARS 之 间 的 高度相关,同时添加复合香辛料和真空包装结合可以有效抑制风干肠中生物胺的积累。由图7可知,真空包装处理组在生物胺的相反象限,距离水分含量、水分活度及感官评价指标较近,进一步表明真空包装可以有效抑制风干肠中生物胺的积累,同时减少风干肠水分的损失及抑制感官品质的劣变。

3 结论
本文研究了添加复合香辛料提取物结合真空包装对风干肠贮藏过程中生物胺积累的抑制作用。研究结果发现,添加复合香辛料提取物结合真空包装可以有效抑制风干肠贮藏过程中6种生物胺(酪胺、腐胺、尸胺、组胺、2-苯乙胺和色胺)的积累,抑制pH 值和TVB-N 值的增加,减少风干肠的脂肪氧化程度。同时,二者结合还可以有效抑制风干肠中总好氧菌数、乳酸菌数和肠杆菌数的增长,减少风干肠的水分损失,抑制感官品质的劣变。主成分分析表明风干肠中生物胺的积累与总好氧菌数、乳酸菌数、肠杆菌数、pH 值、TVB-N 值和TBARS 的变化密切相关。添加复合香辛料提取物结合真空包装是抑制风干肠贮藏过程中生物胺积累的有效方法,同时还可以抑制风干肠贮藏过程中的品质劣变。
