细点圆趾蟹含肉下脚料酶解物中抗氧化肽的分离与鉴定
2020-10-16陈小娥曾茂茂何志勇方旭波
余 辉 陈小娥 曾茂茂 何志勇 张 爽 方旭波 陈 洁*
(1 江南大学食品科学与技术国家重点实验室 江苏无锡214122 2 浙江海洋大学食品与医药学院 浙江舟山316022)
近年来,随着海洋资源的衰退与快餐业的高速发展,新的蛋白质资源开发迫在眉睫,低值细点圆趾蟹(Ovalipes punctatus)开发利用逐渐进入水产加工者的视野。细点圆趾蟹经蒸煮,人工挑取蟹螯和头胸部的大块蟹肉,再加工成冷冻蟹肉罐头和蟹肉糜[1]。由于细点圆趾蟹具有个头小、肌肉组织松散等特点,所以加工过程中产生许多含肉下脚料,包括蟹螯、头胸部和腹部残留蟹肉以及难以加工的附肢和小蟹等。这些下脚料中残留的蟹肉若不回收利用,不仅严重浪费蛋白质资源,而且也会污染环境。如何回收利用这些残留的蟹肉,是当前加工企业急需解决的问题。
目前,从蟹下脚料中回收残留的蟹肉有2种方法:一种是机械挤压与离心分离的方法[2],该方法获得的蟹肉具有颜色灰暗、有碎蟹壳等缺点,使其市场化应用受到一定的限制;另一种是提取/水解蛋白回收方法,该方法是当前研究的热点,如丝氨酸胶原蛋白酶的提取[3],蛋白水解回收[4-6],抗菌肽[7-9],抗肿瘤肽[10]以及抗氧化肽的酶法制备[11]。然而,有关细点圆趾蟹下脚料的利用研究很少,仅有李晶等[12]采用酶法制备海鲜调味基料的报道。尽管胡小超等[13]利用细点圆趾蟹肉制备金属锌螯合肽,以锌的螯合率为指标,通过正交试验优化获得最适酶解工艺,但其目的是采用蟹肉制备新型生物态锌,而非对下脚料进行综合利用,更未对细点圆趾蟹金属锌螯合肽进行分离纯化与结构鉴定。
多肽结构与其活性有着密切关系,明确多肽的氨基酸组成对揭示其构效关系有着重要的意义[14-15]。本研究拟采用胰蛋白酶水解细点圆趾蟹含肉下脚料制备抗氧化肽,通过超滤、离子交换和凝胶层析初步分离纯化,并利用半制备型RP-HPLC进一步纯化,采用超高效液相色谱-电喷雾飞行时间串联质谱(UPLC-ESI-TOF-MS/MS)鉴定其结构,最后通过合成多肽进一步验证其抗氧化性,旨在为细点圆趾蟹含肉下脚料的抗氧化肽开发利用提供参考。
1 材料与方法
1.1 材料与试剂
细点圆趾蟹含肉下脚料(OPW),舟山市常青海洋食品公司提供。
胰蛋白酶(2 500 U/mg),上海阿拉丁生化科技股份有限公司;Sephadex G-15 填料,美国GE 公司;HPLC 级乙腈,美国天地公司;L-还原型谷胱甘肽(GSH)和2,2-连氮-双-(3-乙基苯并噻唑啉-6-磺酸)铵盐[2,2′-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)diammonium salt, ABTS],美国sigma 公司;其它试剂均为分析纯级,国药集团化学试剂有限公司。
1.2 仪器与设备
板式超滤设备,美国Minipore 公司;MA99-3自动核酸蛋白分离层析仪,上海沪西分析仪器厂有限公司;Evolution60 紫外可见分光光度计,美国热电公司;Waters 1525 型半制备液相色谱仪、Waters Synapt 超高压液相色谱串联四级杆飞行时间质谱仪,美国Waters 公司。
1.3 试验方法
1.3.1 OPW 酶解物(OPWTPs)的制备 蟹下脚料剔除蟹背甲、斩拌,用甲醇:氯仿体积比1∶2 进行脱脂(料液比为0.333 kg OPW/L 混合溶剂),抽滤,滤渣70 ℃干燥5 h。滤渣粉碎后,按料液比为0.2 kg OPW 干基/L 纯水、加酶量为4 000 U/g OPW 干基、温度50 ℃、pH 7.5 的条件水解3 h。待反应结束后,12 000×g 离心20 min,上清液真空浓缩至原体积的1/3,冻干后即为OPWTPs。
1.3.2 抗氧化肽的分离与鉴定
1.3.2.1 超滤 OPWTPs 溶于超纯水中制成粗肽溶液(500 mg/mL),12 000×g 离心5 min,上清液依次通过3种超滤膜(截留相对分子质量5,3,1 ku)进行分离,分别获得相对分子质量>5 ku、3~5 ku、1~3 ku、<1 ku 的4 个肽段,其中<1 ku 的肽段经Hitrap Desalting 预装柱脱盐。真空浓缩后冷冻干燥,测其各肽段的ABTS+·清除率。
1.3.2.2 凝胶过滤层析 上述抗氧化活性最高的肽段溶于超纯水中制成多肽溶液(100 mg/mL),12 000 ×g 离心5 min,上清液采用已平衡的Sephadex G-15 凝胶柱(Ø1.6 cm×120 cm)进行分离纯化。柱层析条件:上样量20 mL、流速1 mL/min、洗脱液为超纯水,分步收集,2 mL/管,每隔1 管在波长220 nm 下测其吸光值,收集洗脱峰。多次重复上样,合并收集各洗脱峰,真空浓缩冻干后测其各洗脱峰的ABTS+·清除率并计算IC50值。
1.3.2.3 RP-HPLC 制备色谱 上述抗氧化活性最高的肽段溶于超纯水中制成多肽溶液(10 mg/mL),12 000×g 离心5 min,上清液用RPHPLC 制备色谱进行分离纯化。色谱条件:SunfireTMPre C18制备柱(Ø19 mm×250 mm,5 μm),检测波长214 nm,柱温25 ℃,流动相为乙腈和水,流速6 mL/min,上样量0.5 mL;梯度洗脱模式,30 min 内乙腈体积分数从0%升至50%。多次重复分离,合并收集各洗脱峰,真空浓缩冻干后测其各洗脱峰ABTS+·清除率。
1.3.2.4 UPLC-ESI-TOF-MS/MS 结构鉴定 上述抗氧化活性最高的洗脱峰溶于超纯水中制成多肽溶液(1 mg/mL),12 000 ×g 离心5 min,上清液中多肽采用UPLC-TOF-MS/MS 进行结构分析。液相色谱条件:Acquity UPLC BEH C18 色谱柱(Ø2.1 mm×120 mm,1.7 μm),流动相为0.1%甲酸溶液和乙腈,流速为0.3 mL/min,梯度洗脱,20 min 内乙腈含量由0 变到20%。质谱条件:ESI 电离源,毛细管电压为3.5 kV,锥孔电压为30 V,离子源温度为100 ℃。多肽结构通过MassLynx 软件中Protein/Peptide sequence 程序进行分析。
1.3.2.5 多肽合成及活性测定 以获得的抗氧化肽为目标肽,委托吉尔生化(上海)有限公司采用固相合成方法进行合成,并对脱盐合成肽的纯度与一级结构进行分析。同时测定合成肽和GSH 溶液的ABTS+·清除率。
1.3.2.6 多肽含量及ABTS+·清除率的测定 多肽含量测定按照余冰宾[16]的Folin-酚试剂法方法测定。ABTS+·清除率按照Zhu等[17]的方法测定,ABTS+·清除率(%)=(Ab-As)/Ab×100,式中Ab为空白样吸光值,As为样品吸光值。IC50值为ABTS+·清除率达50%的多肽溶液质量浓度,单位为mg/mL。
2 结果与分析
2.1 超滤分离
目前,大部分抗氧化肽的分子质量在500~1 800 u 范围内[18],因此本文采用1,3,5 ku 的超滤膜对OPWTPs 进行分离,获得了4 个组分(图1),分别为OPWTPs-Ⅰ(分子质量>5 ku),OPWTPs-Ⅱ(3~5 ku),OPWTPs-Ⅲ(1~3 ku)和OPWTPs-Ⅳ(<1 ku)的肽段,且OPWTPs,OPWTPs-Ⅰ,OPWTPs-Ⅱ,OPWTPs-Ⅲ和OPWTPs-Ⅳ的清除ABTS+·的IC50值分别为2.47,10.21,36.16,3.36 和1.43 mg/mL。其中,OPWTPs-Ⅳ肽段清除ABTS+·能力比其它3 个肽段强,表明OPWTPs-Ⅳ肽段中含有更多ABTS+·清除能力强的抗氧化肽,与鲣鱼籽和褐牙鲆肌肉酶解液中低分子质量的肽段具有最高抗氧化活性的结论相似[19-20]。因此,推断OPWTPs-Ⅳ肽段含有高ABTS+·清除率的小分子质量的多肽。

图1 超滤组分ABTS+·清除率Fig.1 ABTS+·scavenging rates of ultrafiltration fractions

图2 OPWTPs-Ⅳ组分的Sephadex G-15 凝胶柱层析曲线(a)及各分离峰的ABTS+·清除率(b)Fig.2 Column chromatogram of fraction OPWTPs-Ⅳon Sephadex G-15(a)and ABTS+·scavenging rates of separate peaks(b)
2.2 Sephadex G-15 分离
凝胶排阻色谱是一种根据分子大小分离生物活性物质的有效方法[21-22]。从图2可看出,OPWTPs-Ⅳ经Sephadex G-15 分离得到3 个组分,分别命名为P1,P2 和P3,且其IC50值分别为4.02,1.39 和1.90 mg/mL,表明分子质量小的多肽确实具有较高的ABTS+·清除能力,与Yan等[23]的结果相似。因此,P2 组分含有高ABTS+·清除率的小肽。
2.3 半制备型RP-HPLC 分离
图3 表明,P2 组分经RP-HPLC 分离后其分离度较好且分离出7 个组分,依次命名为P2-1,P2-2,P2-3,P2-4,P2-5,P2-6 和P2-7。由图可知,在1 mg/mL 时,只有P2-3 和P2-5 组分的ABTS+·清除率均在90%以上,且其IC50值分别为0.488 mg/mL 和0.201 mg/mL,而其它组分的ABTS+·清除率均低于40%以下,表明多肽抗氧能力不仅与其疏水性有关[24],更与其氨基酸的组成和肽的序列有关[25-26]。
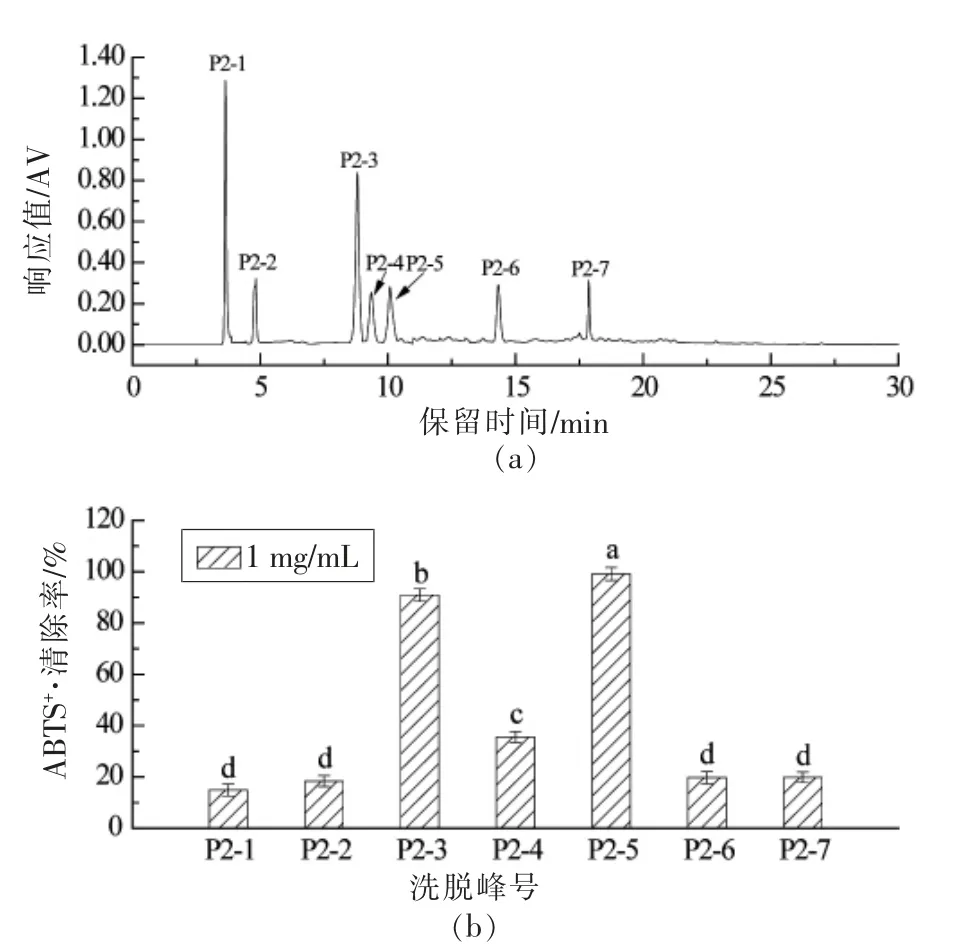
图3 P2 组分的半制备型RP-HPLC 的色谱图(a)及各分离峰的ABTS+·清除率(b)Fig.3 Semi-preparative RP-HPLC chromatogram of fraction P2 on C18 preparative column(a)and ABTS+·scavenging rates of separate peaks(b)
2.4 质谱鉴定结果
UPLC-ESI-TOF-MS/MS 已成功应用于多肽结构鉴定[27]。组分P2-3 和P2-5 经TOF-MS/MS 分析,获得片段的质荷比(m/z)(图4 和图5)。根据肽键断裂过程中形成的bi和yn-i系列离子的信息,采用Masslynx 软件中Protein/Peptide Editor 程序对获得的bi和yn-i系列离子的质量碎片进行预测,并与质谱图上的碎片进行匹配,各获得1 个可靠性在99%及以上的多肽序列,其氨基酸序列分别为Tyr-Glu-Gly(YEG)和Tyr-Glu(YE)。食源性抗氧化肽通常在N-端含有疏水性的氨基酸残基,如Pro,His,Tyr,Met 和Cys[18],本文所获得的2种小肽均符合上述特征。

图4 组分P2-3 中主成分的二级质谱图Fig.4 TOF-MS/MS spectra of main constituent in fraction P2-3

图5 组分P2-5 中主成分的二级质谱图Fig.5 TOF-MS/MS spectra of main constituent in fraction P2-5
2.5 多肽合成及活性测定
合成肽YEG 和YE 由吉尔生化(上海)有限公司合成,其纯度分别为98.04%和98.52%(图6和图7),分子质量分别为367.35 u 和310.30 u(图8 和图9)。同时,对合成肽YEG 和YE 以及谷胱甘肽(GSH)的清除ABTS+·的IC50值进行测定(图10),结果显示,合成肽YEG 和YE 的清除ABTS+·的IC50值分别0.456 mg/mL 和0.184 mg/mL,且YE 的IC50值比GSH(IC50值为0.264 mg/mL)高出30.30%,与已报道类似小肽的结果相似[28-29]。

图6 合成肽YEG 的RP-HPLC 色谱图Fig.6 RP-HPLC chromatogram of synthetic peptides YEG
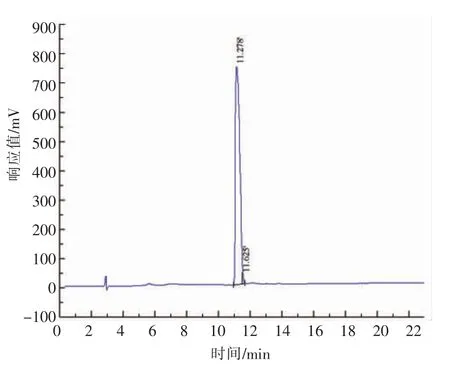
图7 合成肽YE 的RP-HPLC 色谱图Fig.7 RP-HPLC chromatogram of synthetic peptides YE

图8 合成肽YEG 的质谱图Fig.8 Mass spectra of synthetic peptides YEG

图9 合成肽YE 的质谱图Fig.9 Mass spectra of synthetic peptides YE

图10 合成肽YEG 和YE 以及GSH清除ABTS+·的IC50 值Fig.10 IC50 values for ABTS+·scavenging of synthetic peptide YEG and YE as well as reduced L-Glutathione
3 结论
本文采用胰蛋白酶对细点圆趾蟹含肉下脚料进行酶解,利用超虑系统、Sephadex G15 和半制备型RP-HPLC 分离纯化获得2 个ABTS+·清除率较高的组分P2-3 和P2-5。应用UPLC-TOF-MS/MS对这2 个组分进行结构鉴定,最终鉴定出2种小肽的氨基酸序列为Tyr-Glu-Gly 和Tyr-Glu。经固相合成,合成肽YEG 和YE 的分子质量分别为310.30 u 和367.35 u,纯度分别为98.52%和98.04%。同时,合成肽YEG 和YE 的清除ABTS+·的IC50值分别0.456 mg/mL 和0.184 mg/mL,且YE 的IC50值比GSH 高出30.30%。本研究明确了细点圆趾蟹含肉下脚料酶解产物的抗氧化活性,并对其含有的抗氧化肽进行了分离纯化与结构鉴定,为细点圆趾蟹含肉下脚料的开发与利用提供了理论依据。
