微泡菌ALW1昆布多糖酶的酶学性质及其酶解产物的抗氧化活性
2020-10-16银小倩梁梅芳李鹤宾姜泽东朱艳冰
银小倩 梁梅芳 李鹤宾 姜泽东,2,3 倪 辉,2,3 朱艳冰,2,3*
(1 集美大学食品与生物工程学院 福建厦门361021 2 福建省食品微生物与酶工程重点实验室 福建厦门361021 3 厦门南方海洋研究中心经济海藻资源化利用与深加工重点实验室 福建厦门361021 4 厦门医学院 福建厦门361023)
昆布多糖又称海带多糖、褐藻淀粉,为海洋褐藻的重要贮藏多糖,约占褐藻干重35%[1-2]。昆布多糖是一种水溶性多糖,是自然界常见的β-1,3-葡聚糖之一,含有部分β-1,6 支链[3]。昆布多糖及其衍生物具有广泛的生物学活性,是一种功能性多糖,在抗肿瘤,改善血脂浓度,早中期肾衰竭防治等方面均有研究报道[4-5]。
β-1,3-葡寡糖可以提高机体免疫力[6],调节肠道菌群[7],用于糖尿病治疗[8],具有抗肿瘤活性[9]。酶解法生产β-1,3-葡寡糖特异性强,无副产物生成,被认为是有效、安全的低聚寡糖生产方法。昆布多糖酶(EC 3.2.1.39)是一种专一性水解β-1,3-葡聚糖中的β-1,3 糖苷键的酶类[10],它能够将聚糖水解生成寡糖。除了用于制备寡糖,β-1,3-葡聚糖酶还可作为添加剂或生物活性多糖的改良剂应用于饲料和酿酒工业中[11-13]。作为处理酵母细胞的工具酶,应用于原生质体制备、细胞融合、基因导入和蛋白质提取等方面[14-15]。β-1,3-葡聚糖酶可有效提高植物的抗病能力[16]。除此之外,β-1,3-葡聚糖酶在植物生物质降解中发挥重要作用[17]。
昆布多糖酶来源于广泛,包括细菌、真菌、植物等,其中微生物是该酶的重要来源。目前报道的产昆布多糖酶的微生物主要包括强烈炽热球菌(Pyrococcus furiosus)[18]、拟诺卡氏菌属(Nocardiopsis sp.)[19]、海洋红嗜热菌(Rhodothermus marinus)[20]、盐屋链霉菌(Streptomyces sioyaensis)[21]、海栖热袍菌(Thermotoga maritima)[22]、食半乳聚糖卓贝尔氏黄杆菌(Zobellia galactanivorans)[2]、马氏链霉菌(Streptomyces matensis)[23]、米黑根毛霉(Rhizomucor miehei)[24]等。作者以腐烂海带为样品,从中筛选分离出1 株微泡菌(Microbulbifer sp.ALW1)[25],该菌株为产昆布多糖酶微生物。本文研究微泡菌ALW1 昆布多糖酶粗酶的酶学性质及酶解产物的抗氧化活性,为昆布多糖酶和昆布低聚糖的进一步开发利用提供理论基础。
1 材料与方法
1.1 材料与试剂
细菌学蛋白胨、LB 琼脂,广东环凯微生物科技有限公司;酵母粉,生工生物工程(上海)股份有限公司;昆布多糖,源叶生物;其它试剂均为分析纯产品。
培养基:(1)种子培养基:0.5% 蛋白胨,0.1%酵母粉,0.2% K2HPO4·3H2O,0.1% MgSO4·7H2O,3% NaCl,0.5%(NH4)2SO4,0.001% FeSO4·7H2O,pH 7.5;(2)发酵培养基:0.5% 昆布多糖,0.2%K2HPO4·3H2O,0.1% MgSO4·7H2O,3% NaCl,0.5%(NH4)2SO4,0.001% FeSO4·7H2O,pH 7.5。
1.2 仪器与设备
SW-CJ-2FD 型双人单面净化工作台,苏州净化设备有限公司;ALP 全自动灭菌锅,上海博迅实业有限公司医疗设备厂;ZHWY-2102/ZWY-200D双层全温度培养摇床,上海智城分析仪器制造有限公司;冷冻高速离心机,德国Eppendorf 公司;FE20 pH 计,梅特勒-托利多称重设备系统有限公司;恒温水浴锅,上海精宏实验设备有限公司;PS301F 电子天平,赛多利斯科学仪器;Epoch2T 微量酶标仪,美国伯腾公司;MLX201 小型台式高速离心机,美国精骐公司。
1.3 试验方法
1.3.1 昆布多糖酶粗酶液的制备 菌株接种于种子培养基,25 ℃、180 r/min 摇动培养30 h。以2%的接种量接种至发酵培养基,25 ℃、180 r/min 发酵72 h。发酵液于4 ℃、6 000 r/min 离心10 min,取上清液,获得昆布多糖粗酶液,用于后续的酶学性质研究及酶解产物制备。
1.3.2 昆布多糖酶的活力测定 取5 μL 含0.5%昆布多糖的50 mmol/L Na2HPO4-NaH2PO4缓冲液(pH 8.0),加入395 μL 昆布多糖酶,35 ℃反应15 min 后,沸水浴中灭活2 min,加入400 μL DNS 试剂,沸水浴10 min,流水冷却至室温后于波长540 nm 处测定反应液的吸光值。通过制作葡萄糖标准曲线确定还原糖含量,由此计算昆布多糖酶的活力。昆布多糖酶活力定义为:在上述条件下,每分钟水解底物产生1 μmol 还原糖(以葡萄糖计)所需的酶量为1 个酶活力单位(U)。
1.3.3 昆布多糖酶的酶学性质研究
1.3.3.1 温度对昆布多糖酶活性的影响 分别在不同温度下测定昆布多糖酶酶活力,将最高酶活力定义为100%,研究酶的最适反应温度。将昆布多糖酶分别在不同温度中温浴1 h 后,测定酶的残余活力,以未经处理的酶活力为100%,研究酶的温度稳定性。
1.3.3.2 pH 对昆布多糖酶活性的影响 在不同pH 缓冲液中测定昆布多糖酶的活力,将最高酶活力定义为100%,研究酶的最适反应pH。所用缓冲液为50 mmol/L Na2HPO4-NaH2PO4缓冲液(pH 6.0~8.0),50 mmol/L Tris-HCl 缓冲液(pH 8.0~9.0),50 mmol/L Gly-NaOH 缓冲液(pH 9.0~11.0)。将昆布多糖酶分别置于不同pH 缓冲液中25 ℃温浴1 h 后,测定酶的残余活力,以未经处理的酶活力为100%,研究酶的pH 稳定性。
1.3.3.3 金属离子对昆布多糖酶活性的影响 分别添加终浓度为1 mmol/L 和10 mmol/L 的不同金属离子,25 ℃温浴1 h 后,测定昆布多糖酶的活力,以不加金属离子的酶活力为100%,研究金属离子对酶活性的影响。
1.3.3.4 昆布多糖酶动力学参数测定 分别配制质量浓度为0.5,1.0,2.0,3.0,4.0,5.0 mg/mL 的昆布多糖溶液,将5 μL 的酶液与395 μL 不同底物浓度的昆布多糖溶液混合,分别于最适温度35 ℃下温浴15 min 后取出,于沸水浴灭活2 min,加400 μL DNS,沸水浴10 min,测定酶活力。
1.3.4 昆布多糖酶酶解产物的制备 在50 mmol/L Na2HPO4-NaH2PO4缓冲液(pH 8.0)中配制含2 mg/mL 昆布多糖的底物溶液,每100 mL 底物溶液中加入650 U 昆布多糖酶,混匀,在35 ℃条件下进行反应,每隔1 h 取样一次,测定其还原糖的释放量,反应10 h 后,将100 U 昆布多糖酶加入到反应混合物中,并在相同温度下反应2 h,经测定,此时还原糖的含量没有改变。沸水浴加热10 min 灭活酶蛋白,完全冷却沉降,10 000 r/min 离心15 min,除去不溶物,将酶解产物冷冻干燥至粉末后备用。
1.3.5 酶解产物的抗氧化活性 参考Wu等[26]的方法,对酶解产物清除ABTS 自由基、·OH 自由基的能力以及酶解产物的还原能力进行测定。
1.4 统计分析
每组试验数据设置3 次平行试验,应用Excel软件计算平均值,SPSS Statistics17.0 软件对结果进行差异显著性分析(P<0.05)。
2 结果与分析
2.1 温度对昆布多糖酶活性的影响
在不同温度下测定菌株ALW1 昆布多糖酶的活力,结果(图1a)显示,昆布多糖酶的最适反应温度为45 ℃。酶的温度稳定性分析(图1b)显示,昆布多糖酶在35 ℃下较为稳定,温浴1 h 仍具有约80%的相对酶活力;在40 ℃下温浴1 h,酶仍具有70%以上的相对酶活力;在50 ℃下处理1 h,酶活力基本丧失,说明高温对该酶的稳定性影响较大。
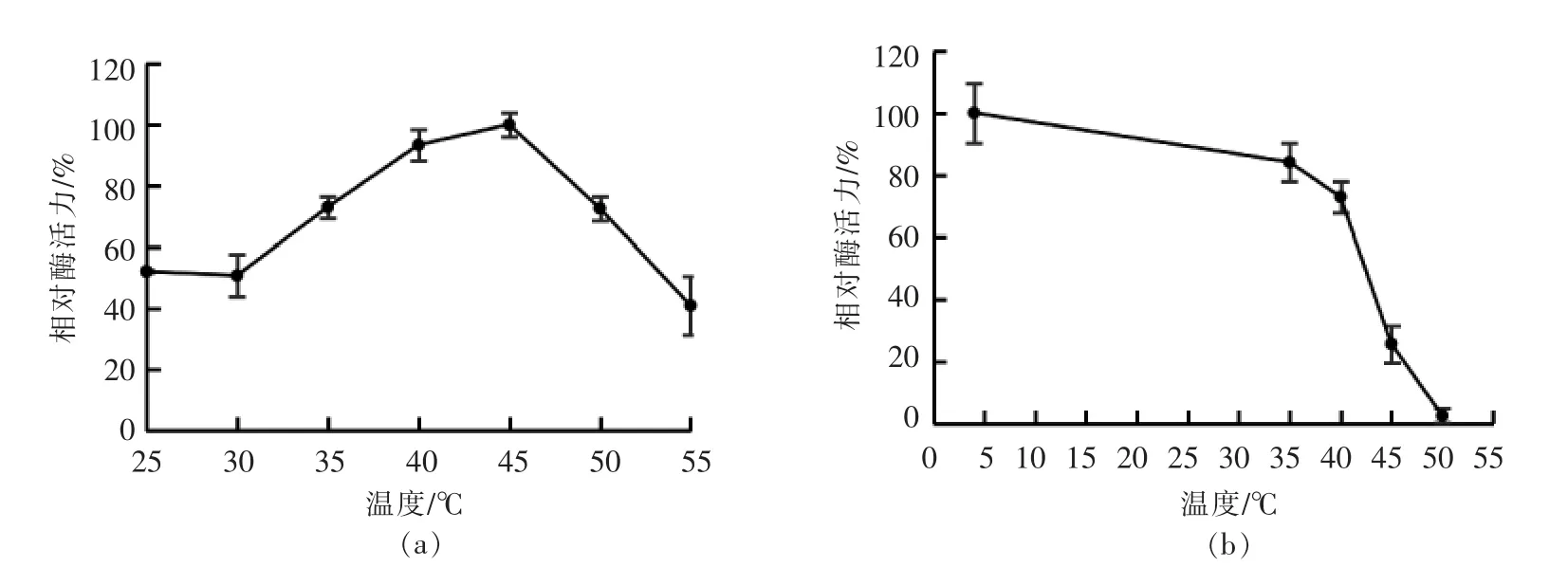
图1 温度对昆布多糖酶活性(a)及热稳定性(b)的影响Fig.1 Effects of temperature on activity(a)and thermostability(b)of laminarinase
2.2 pH 对昆布多糖酶活性的影响

图2 pH 对昆布多糖酶活性(a)及pH 稳定性(b)的影响Fig.2 Effects of pH on activity(a)and thermostability(b)of laminarinase
在不同pH 条件下测定昆布多糖酶的活力,结果(图2a)显示,昆布多糖酶在pH=5.5 时,酶的活性最高,因此昆布多糖酶的最适pH 为5.5。酶的pH 稳定性分析(图2b)显示,昆布多糖酶在pH 6.0~8.0 条件下较为稳定,处理1 h 仍然具有60%以上的相对酶活力;当pH<6.0,以及pH>8.0 时,酶活力损失较大,较不稳定;当pH<4.0,以及pH>10.0 时,酶几乎完全失活,说明偏酸或偏碱的环境都不利于酶活力的保持。
2.3 金属离子对昆布多糖酶活性的影响
金属离子对昆布多糖酶活性的影响结果如表1所示,Na+对酶活力起促进作用;K+,Fe2+,Cu2+,Co2+,Mn2+,Ba2+,Cd2+和Zn2+对昆布多糖酶具有不同程度的抑制作用,其中Zn2+的抑制作用最强;Ca2+和Mg2+在低浓度(1 mmol/L)时对酶活力没有影响,在高浓度(10 mmol/L)时对酶有抑制作用。

表1 金属离子对昆布多糖酶活性的影响Table 1 Effects of metal ions on the activity of laminarinase
2.4 昆布多糖酶的动力学参数
通过测定不同底物浓度下的反应速度,可以确定酶催化最大反应速率Vmax、米氏方程底物亲和常数Km。如图3所示,以1/V 为纵坐标,1/[S]为横坐标,采用Linewaeaver-Burk 作图法,可得:酶的Km为0.612 mg/mL,Vmax为4.902 U/mg。

图3 昆布多糖酶Linewaeaver-Burk 双倒数拟合曲线Fig.3 Linewaeaver-Burk plot of laminarinase
2.5 昆布多糖酶酶解产物的抗氧化活性
2.5.1 酶解产物对ABTS 自由基的清除能力 菌株ALW1 昆布多糖酶的酶解产物对ABTS 自由基的清除结果如图4所示,在分析的质量浓度范围内,酶解产物对ABTS 自由基的清除能力随其质量浓度的增加而增强,当质量浓度为15 mg/mL时,其清除率约为50%。由此可见,菌株ALW1 昆布多糖酶的酶解产物对ABTS 自由基具有一定的清除能力,对该自由基的半抑制剂量IC50为15.2 mg/mL。

图4 酶解产物对ABTS 自由基的清除作用Fig.4 ABTS radical scavenging activity of enzymatic hydrolysates
2.5.2 酶解产物对·OH 自由基的清除能力 菌株ALW1 昆布多糖酶的酶解产物对·OH 自由基的清除结果如图5所示,酶解产物对·OH 自由基的清除能力随着其质量浓度的增大而增强。当质量浓度大于3 mg/mL 时,清除能力增强变缓,当质量浓度为5 mg/mL 时,清除率达到了80%。由此可见,菌株ALW1 昆布多糖酶的酶解产物对·OH 自由基具有一定的清除能力,对该自由基的半抑制剂量IC50为1.7 mg/mL。
2.5.3 酶解产物的还原能力 菌株ALW1 昆布多糖酶的酶解产物的还原能力如图6所示,在分析的质量浓度范围内,酶解产物的还原能力随其质量浓度的增大而增强,其还原能力与质量浓度基本成正比关系,表明菌株ALW1 昆布多糖酶的酶解产物具有一定的还原能力。

图5 酶解产物对·OH 自由基的清除作用Fig.5 ·OH radical scavenging activity of enzymatic hydrolysates

图6 酶解产物的还原能力Fig.6 Reducing capacity of enzymatic hydrolysates
3 结论
通过对微泡菌ALW1 昆布多糖酶一系列酶学性质的研究可得:昆布多糖酶的最适反应温度为45 ℃,在35 ℃下较为稳定;酶的最适反应pH 为5.5,在pH 6.0~8.0 范围内较为稳定。金属离子Na+对酶活力起促进作用,随着Na+浓度的增大,对酶活力的促进作用增强;Fe2+,Cd2+和Zn2+对昆布多糖酶有强烈的抑制作用。昆布多糖酶的酶解产物对ABTS 自由基和·OH 自由基的半抑制剂量IC50分别为15.2 mg/mL 和1.7 mg/mL,此外酶解产物具有较强的还原能力。因此,海洋细菌ALW1 昆布多糖酶的酶解产物具有抗氧化活性。
