miR-328-5p靶向SPON2介导FAK/Src信号调控胃癌细胞迁移和侵袭的机制研究
2020-10-16马君陈洋牟一平
马君 陈洋 牟一平
胃癌是世界上第二大癌症死亡的原因,在包括中国和日本在内的亚洲国家中,胃癌的发病率特别高。据报道,全球范围内尽管胃癌的发病率在逐年下降,但每年仍有超过100万的新诊断病例和85万的死亡病例[1]。胃癌高病死率的主要原因在于其早期无明显临床症状,多数患者确诊时已处于晚期,导致临床治疗效果不佳,预后差[2]。大量文献表明,异常miRNA表达与胃癌的发生和发展密切相关[3-4]。近年来有研究显示,miRNA可通过干扰肿瘤抑制因子和促进癌基因的表达导致功能异常,这与胃癌的发生密切相关[5]。此外,miRNA的功能障碍还可导致下游表型的变化,包括细胞迁移、侵袭、增殖和凋亡等过程[5]。miRNA可通过与靶基因完全或不完全结合导致靶mRNA降解。多项研究发现长链非编码RNA或者环状RNA通过调控miR-328-5p的表达参与非小细胞肺癌、卵巢癌等多种肿瘤的恶性进展,并有希望成为临床诊断的标志物[6-7]。然而其在胃癌中的作用尚未见报道,基于此,本研究将探讨miR-328-5p对胃癌细胞迁移和侵袭的作用及其具体的分子机制。
1 材料和方法
1.1 材料 30只雄性C57BL/6J小鼠(体重:22~25g,年龄:6~7周龄)购自北京维通利华实验动物技术有限公司,实验动物使用许可证:北京 SYXK(京)2017-0033。小鼠自由饮水进食,昼夜各12 h。人源胃黏膜上皮细胞系GES-1以及胃癌细胞系SGC7901、MKN28均购自上海澳音生物科技有限公司。miR-328-5p和miR-con(批号:121547)均购自上海美轩生物科技有限公司;Transwell小室(批号:845116)购自吴江康宁生命科学有限公司;双荧光素酶报告基因检测试剂盒(批号:215548)购自武汉纯度生物科技有限公司;脊椎蛋白2(SPON2)兔单抗(批号:s1121)、波形蛋白(Vimentin)兔单抗(批号:s87516)、基质金属蛋白酶-9(MMP-9)兔单抗(批号:s8361)均购自武汉三鹰生物技术有限公司,酪氨酸蛋白激酶(Src)兔单抗、磷酸化 Src(p-Src)兔单抗(批号:b2158)、局部黏着斑激酶(FAK)兔单抗(批号:b0542)、磷酸化 FAK(p-FAK)兔单抗(批号:b9564)均购自杭州戴格生物技术有限公司,GAPDH作为内参。
1.2 方法
1.2.1 小鼠分组及胃癌模型构建 将30只小鼠按照随机数字表法分为胃癌组和正常组,每组15只。胃癌组小鼠采用N-甲基-N-亚硝基脲(MNU)化学诱导法构建小鼠胃癌模型,具体操作为:在小鼠饮用水里添加MNU,以120 mg/L浓度持续处理4周,即可诱导小鼠胃组织发生癌变[8]。
1.2.2 小鼠胃组织中miR-328-5p、SPON2相对表达量检测 取两组小鼠胃组织,提取RNA,进一步逆转为cDNA,采用RT-PCR法检测miR-328-5p、SPON2相对表达量。引物购自上海生工生物工程股份有限公司。反应程序:94℃变性 20 s,60℃退火30 s,72℃延伸30 s,循环数32个。其相对表达量采用2-△△Ct法计算。
1.2.3 小鼠胃组织中p-Src、Src、p-FAK、FAK蛋白表达水平检测 采用Western blot法。取小鼠胃癌及正常胃组织,采用强组织蛋白裂解液裂解胃癌及正常胃组织蛋白,采用BCA法检测两组蛋白浓度,定量后取20 μg蛋白进行SDS-PAGE电泳,转膜后利用5%的牛奶室温封闭1 h去除非特异性抗原,随后加入对应配制好的一抗中于4℃孵育过夜,抗体稀释比均为1:1 000。次日利用辣根过氧化物酶化学二抗室温孵育1 h后进行化学曝光,利用化学扫膜仪分析数据。
1.2.4 胃癌细胞分组培养及转染 将胃癌细胞系SGC7901置于1640完全培养基(1640基础培养基+10% FBS+1%双抗)中进行培养,细胞密度达到80%~90%时进行传代铺板。将细胞分为miR-328-5p组、miR-con组、NC组共3组。其中miR-328-5p组细胞转染miR-328-5p,miR-con组细胞转染miR-con,NC组不转染。将SGC7901细胞铺板于6孔板中,按照lipo 2000说明书进行转染,转染6 h后换液,24 h后消化细胞进行后续实验。
1.2.5 3组胃癌细胞miR-328-5p、Vimentin和MMP-9表达水平检测 细胞按照上述分组处理24 h后,提取细胞RNA,采用RT-PCR法检测miR-328-5p、Vimentin、MMP-9相对表达量,其相对表达量采用2-△△Ct法计算,以U6作为内参。每组实验设计6个复孔。
1.2.6 3组胃癌细胞迁移、侵袭数检测 采用Transwell小室实验。细胞按照上述分组处理24 h后,用胰酶消化细胞,经过离心后采用无血清基础1 640培养基重悬计数后,稀释成4×106个/ml的细胞悬液,取100 μl铺板于 Transwell上室,下室加入 600 μl含血清完全培养基。上下室共培养24 h后,采用4%多聚甲醛固定15 min后,用棉签将上室未迁移的细胞擦拭干净,结晶紫染色,拍照计算细胞迁移数。细胞侵袭实验则提前将Transwell上室包被基质胶,后续操作同迁移实验步骤,拍照计算细胞侵袭数。每组实验设计6个复孔。
1.2.7 miR-328-5p、miR-con胃癌细胞SPON2基因野生型(WT)和突变型(MUT)荧光素酶相对活力值检测 采用荧光素酶报告基因实验。Targetscan 7.2软件分析miR-328-5p直接靶向SPON2基因3′UTR序列后,设计该靶点突变报告基因质粒。报告基因实验分为miR-con+SPON2 WT组、miR-328-5p+SPON2 WT组、miR-con+SPON2 MUT组、miR-328-5p+SPON2 MUT组共4组,其中miR-con+SPON2 WT组细胞转染miR-con和SPON2 WT质粒,miR-328-5p+SPON2 WT组细胞转染 miR-328-5p和 SPON2 WT质粒,miR-con+SPON2 MUT组细胞转染miR-con和SPON2 MUT质粒,miR-328-5p+SPON2 MUT组转染miR-328-5p和SPON2 MUT质粒。质粒转染24 h,取出细胞,采用双荧光素酶报告基因检测试剂盒裂解细胞并进行后续实验,最后用酶标仪检测并计算荧光素酶相对活力值。每组实验设计6个复孔。
1.3 统计学处理 采用SPSS 25.0统计软件。计量资料用表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验,两组间比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组小鼠胃组织中miR-328-5p、SPON2相对表达量比较 与正常组比较,胃癌组胃组织中miR-328-5p相对表达量明显降低,SPON2相对表达量明显升高,差异均有统计学意义(均P<0.05)。见表1。
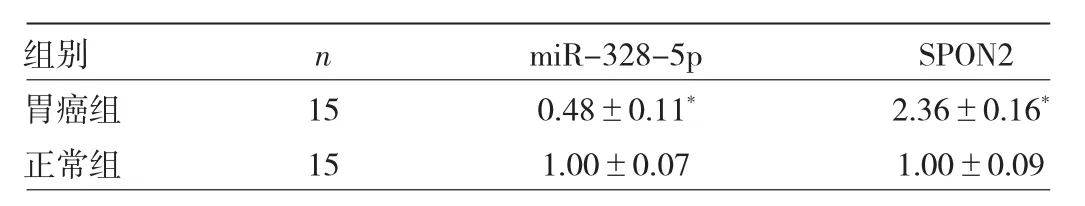
表1 两组小鼠胃组织中miR-328-5p、SPON2相对表达量比较
2.2 两组小鼠胃组织中p-Src、Src、p-FAK、FAK蛋白表达水平比较 与正常组比较,胃癌组胃组织中p-FAK、p-Src蛋白表达水平均明显升高,差异均有统计学意义(均 P<0.05)。见图1、表2。

图1 磷酸化酪氨酸蛋白激酶(p-Src)、酪氨酸蛋白激酶(Src)、磷酸化局部黏着斑激酶(p-FAK)、局部黏着斑激酶(FAK)蛋白表达的电泳图
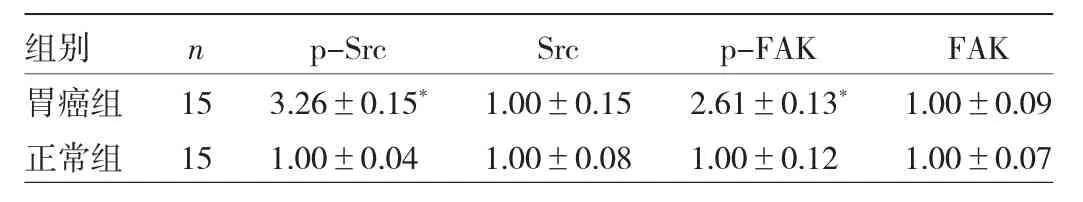
表2 两组细胞p-Src、Src、p-FAK、FAK蛋白表达水平比较
2.3 3组胃癌细胞miR-328-5p、Vimentin和MMP-9相对表达量比较 与NC、miR-con组比较,miR-328-5p组miR-328-5p相对表达量明显升高,同时Vimentin、MMP-9相对表达量均明显降低,差异均有统计学意义(均P<0.05)。见表3。

表3 3组细胞miR-328-5p、Vimentin和MMP-9相对表达量比较
2.4 3组胃癌细胞迁移、侵袭数比较 与NC、miR-con组比较,miR-328-5p组细胞迁移数和侵袭数均明显降低,差异均有统计学意义(均P<0.05)。见表4。

表4 3组细胞迁移、侵袭数比较(个)
2.5 4组胃癌细胞荧光素酶相对活力值比较 与miR-328-5p+SPON2 WT组比较,miR-con+SPON2 WT组、miR-con+SPON2 MUT组、miR-328-5p+SPON2 MUT组荧光素酶相对活力值均明显为高,差异均有统计学意义(均 P<0.05)。见图 2、表 5。

图2 miR-328-5p靶向SPON2基因3'UTR序列

表5 miR-328-5p对SPON2双荧光素酶报告基因荧光素酶相对活力值检测
3 讨论
胃癌是人类最常见的恶性肿瘤之一,其特征是进展迅速、预后差和5年生存率低。迄今为止,早期检测胃癌是降低胃癌病死率的最佳方法。由于内镜检查存在相关的不良反应(包括穿孔,吸入性肺炎或出血),因此内镜检查在社区中并不普及。因此,寻求获取方便、易于检测的生物标志物将有利于胃癌的早期检测[9]。
miRNA参与调控包括细胞增殖、转移、分化、发育等多种生物学过程。越来越多的证据表明,多种miRNA在癌组织和正常组织中差异表达,并对miRNA在各种类型癌症中的分布进行了分析,提出了miRNA在临床应用中的诊断和预后价值[10]。对于miR-328-5p此前已有文章报道miR-328-5p可通过靶向糖基化终产物受体抑制MDA-MB-231乳腺癌细胞增殖[11],此外CircRNA-5692可通过刺激miR-328-5p增强残疾基因同源物2相互作用蛋白表达从而来抑制肝癌的进展[12]。长链非编码RNA TPTEP1竞争性抑制miR-328-5p从而抑制非小细胞肺癌细胞的增殖。本研究通过构建小鼠原位胃癌模型,发现miR-328-5p在胃癌组织中表达明显低于正常胃组织,而SPON2在胃癌组织中表达明显高于正常胃组织。通过迁移和侵袭实验发现过表达miR-328-5p可抑制胃癌细胞迁移和侵袭。通过Targetscan分析发现miR-328-5p可能靶向SPON2 3′UTR序列,该结论进一步通过荧光素酶报告基因得到验证。
SPON2是一种细胞外基质蛋白,由SPON2基因编码,早期研究发现与SPON2相关的疾病包括药物诱导的红斑狼疮,探其致病机制发现SPON2主要影响整合素活化及蛋白质代谢[13-14]。近年来SPON2在肿瘤中的作用越来越得到重视,在大肠癌中,SPON2表达明显上调,并通过缺口受体信号参与肿瘤的恶性进程[15]。本研究发现miR-328-5p靶向SPON2后可能通过调控FAK/Src信号通路的活化,抑制了Vimentin、MMP-9等细胞迁移相关分子的表达。
综上所述,本研究发现miR-328-5p在胃癌中表达下调,过表达miR-328-5p抑制胃癌细胞迁移和侵袭能力,分子机制研究发现miR-328-5p可能通过靶向抑制SPON2的表达,从而抑制了FAK/Src信号的活化及下游细胞迁移相关蛋白Vimentin、MMP-9的表达。因此miR-328-5p有望成为胃癌临床诊断标志物和治疗靶点。
