氧化型低密度脂蛋白刺激小鼠足细胞后的氧化应激效应和机制研究
2020-10-16李铎章建娜尤小寒张骥苏震
李铎 章建娜 尤小寒 张骥 苏震
足细胞损伤在许多肾小球疾病的发病机制中起重要作用,肾病综合征和其他慢性肾脏病患者常出现脂蛋白的代谢异常,肾小球损伤的进展过程中常发现致动脉粥样硬化脂蛋白的沉积[1]。研究表明,氧化型低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)可与转化生长因子-β(transforming growth factor-β,TGF-β)相互作用,增加内皮细胞和系膜细胞的损害,引起细胞外基质的聚集,促进肾小球硬化的发生[2-3]。而氧化应激被认为在糖尿病肾病的发病机制中起重要作用。笔者前期研究发现,2型糖尿病肾病的肾小球内有不同程度的ox-LDL沉积,且沉积程度与足细胞裂孔膜上的重要结构成分nephrin的表达呈负相关,肾小球内超氧化物歧化酶(superoxide dismutase,SOD)的沉积与足细胞裂孔膜蛋白nephrin的表达呈正相关[4]。基于此,本研究拟通过体外实验来探讨足细胞受到ox-LDL氧化损伤刺激后的效应和可能的机制,现报道如下。
1 材料和方法
1.1 试剂和仪器 LDL、无水CuSO4、足细胞培养的所有相关试剂以及鼠抗β-actin抗体均购自美国Sigma公司;PVDF膜(美国BioRad公司);兔抗人Cu2+-ox-LDL抗体(Chemicon International Inc,美国);结合辣根过氧化物酶的山羊抗兔抗体(美国Amersham Biosciences公司);增强型化学发光试剂盒(ECL kit,德国Roche公司);透析袋购自美国Spectrum Medical Industries公司;兔抗鼠nephrin抗体、小鼠抗paxillin抗体购自英国Abcam公司;小鼠抗synaptopodin抗体购自德国Progen公司;荧光标记的phalloidin购自美国Molecular Probe公司;TUNEL检测试剂盒购自德国Roche公司,兔抗丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)多克隆抗体、兔抗p-MAPK多克隆抗体、兔抗糖原合成酶激酶 3β(glycogen synthase kinase-3β,GSK-3β)多克隆抗体、鼠抗 p-GSK-3β(Ser9)单克隆抗体购自美国Cell Signaling公司。
1.2 方法
1.2.1 小鼠足细胞的培养 条件永生性小鼠肾小球足细胞来自原代分离培养所得[5]。在33℃、20 U/ml γ-干扰素的培养条件下促进足细胞增殖以获取足够的细胞数。在37℃、无γ-干扰素的培养条件下,在完全培养基内培养14 d至其分化成熟后用于后续实验[5]。
1.2.2 ox-LDL的制备和鉴定 用30 ml蒸馏水将48 mg无水CuSO4溶解后用一次性无菌滤器过滤,将LDL稀释于无菌PBS溶液,终浓度为1 mg/ml,在分子截流量为6 000~8 000道尔顿的透析袋内将3 ml LDL置于无菌PBS溶液内于4℃透析去除EDTA。参照Jenkins等[6]的方法,3 ml LDL溶液和3 μl CuSO4溶液混匀后置于37℃恒温箱内,在空气中氧化24 h,成为氧化后的LDL溶液,实验之前新鲜配制。采用Western blot法鉴定制备的ox-LDL的特异性。
1.2.3 实验分组 将条件永生性小鼠肾小球足细胞分别接种于面积为25 cm2(T25)的细胞培养瓶、包被胶原的载玻片中。在37℃、无γ-干扰素的培养条件下,采用完全培养基培养14 d后分化成熟。成熟的足细胞分为6组:12 h对照组、12 h LDL 刺激组(终浓度为 50 μg/ml)、12 h ox-LDL 刺激组(终浓度为 50 μg/ml)、24 h 对照组、24 h LDL刺激组、24 h ox-LDL刺激组。单纯用无血清培养基培养的足细胞作为对照组。免疫荧光法和细胞凋亡检测培养于载玻片上的细胞,提取培养瓶内细胞的蛋白做蛋白分析。
1.2.4 nephrin和细胞骨架蛋白paxillin、F-actin表达检测 采用免疫荧光法。将条件永生性小鼠肾小球足细胞接种于包被胶原的载玻片上,用4℃丙酮固定细胞后,Tris盐酸缓冲液冲洗,Triton X-100进行细胞通透后,1% FBS封闭,加入一抗4℃孵育过夜,阴性对照组以TBS代替。加入二抗于室温下孵育1 h,二抗分别为相应的山羊抗小鼠和山羊抗兔抗体,DAPI(1:1 000)染色细胞核。TBS冲洗后封片。在400倍的荧光显微镜下观察并随机选取10个视野,对视野内的细胞总数和阳性细胞数分别计数,计算两者的比值即为阳性率。
1.2.5 细胞凋亡情况检测 采用脱氧核糖核苷酸末端转移酶介导的缺口末端标记(terminal deoxynucleotidyl transferase-mediated UTP nick-end labeling,TUNEL)法。取24 h各实验组接种于包被胶原的载玻片上的足细胞,PBS清洗后,室温下固定细胞1 h,3% H2O2-甲醇溶液封闭10 min,在冰上于0.1% Triton X-100及0.1%柠檬酸钠溶液中通透盖玻片2 min,然后盖上玻片。按照试剂盒说明书进行操作,实验重复3次,光镜下每组至少观察200个细胞,计数阳性细胞数并计算百分率。
1.2.6 细胞SOD活性检测 采用细胞超氧基团介导的烟酰胺腺嘌呤二核苷酸(nicotinaminde adenine dinucleotide,NADH)氧化率来反映SOD活性,若SOD活性高,则NADH的氧化率下降。根据上述原理,参照Paoletti等[7]的方法,提取足细胞细胞质SOD。将12 h对照组及ox-LDL刺激组、24 h对照组及ox-LDL刺激组的细胞分别用冰的无菌PBS清洗后,加入250 μl 25 mmol/L的三乙醇胺-二乙醇胺(Tea-Dea)缓冲液后,收集细胞裂解液,4℃离心后取上清液。分光光度法检测提取的足细胞细胞质SOD活性。依次加入800 μl Tea-Dea缓冲液,5 μl 7.5 mmol/L NADH 溶液,25 μl EDTA/MnCl2,100 μl稀释后的样品至水晶比色杯后,混合均匀,空白对照组以100 μl Tea-Dea缓冲液替代样品。以空水晶比色杯调零点,分别记录各组和空白对照组在340 nm波长下的吸收值,以此作为基线值,同时向各组分别加入 100 μl 10 mmol/L β-巯基乙醇,观察并记录吸光度变化值,共观察24 min,每8 min记录1次。重复实验3次,第8分钟相对基线值的吸光度变化值记为ΔA340。抑制率为各组ΔA340与当次实验中空白对照组ΔA340的比率,通过抑制率来计算SOD的活性。
1.2.7 细胞 nephrin及 MAPK、phosphor-p44/42MAPK(p-MAPK)、GSK-3β、phosphor-GSK-32(p-GSK-3β)表达检测 采用Western blot法。各实验组细胞加入蛋白提取液,于冰上裂解5 min后收集蛋白提取物并定量。变性、电泳、转膜封闭后,加入一抗 nephrin、GSK-3β、p-GSK-3β、MAPK、p-MAPK;使用相应的二抗室温孵育1 h后,用ECL试剂盒发光、曝光、冲片。胶片扫描后,采用Image J软件对条带进行分析。
1.3 统计学处理 采用SPSS19.0统计软件。计量资料以表示,多组比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 ox-LDL特异性的鉴定结果 Western blot结果显示,抗Cu2+-ox-LDL多克隆抗体与阴性对照、LDL、Cu2+-ox-LDL共同孵育后,仅Cu2+-ox-LDL泳道观察到1条160 kd左右的条带,证实Cu2+-ox-LDL制备成功,其特性不同于LDL。兔来源的免疫球蛋白IgG与Cu2+-ox-LDL孵育后,膜上也未观察到任何条带,表明该抗体具有特异性(图1),进一步证实制备的ox-LDL具有特异性。

图1 ox-LDL特异性鉴定电泳图(1:缓冲液,一抗为兔抗Cu2+-ox-LDL;2:Cu2+-ox-LDL,一抗为兔的 IgG;3:LDL,一抗为兔抗Cu2+-ox-LDL;4:配制的 Cu2+-ox-LDL,一抗为兔抗 Cu2+-ox-LDL)
2.2 ox-LDL刺激组、LDL刺激组、对照组足细胞nephrin和paxillin、F-actin表达比较 间接免疫荧光染色后,观察到12 h对照组、LDL刺激组和ox-LDL刺激组的nephrin表达强度及部位未见明显变化(图2,见插页)。24 h对照组的nephrin在细胞膜、足突和细胞的足突间连接上仍有表达,与12 h对照组相比nephrin强度未见明显变化,LDL刺激组在足突上仍可观察到nephrin少量表达,而ox-LDL刺激组在细胞膜、足突上均未观察到nephrin表达(图2,见插页)。表明ox-LDL刺激小鼠肾小球足细胞24 h后导致足细胞正常表达部位nephrin的丧失。

图2 氧化型低密度脂蛋白(ox-LDL)刺激组、LDL刺激组、对照组足细胞nephrin表达比较(免疫荧光染色,×400)
足细胞骨架蛋白的观察结果显示,24 h对照组的paxillin在细胞质和足突均有表达,LDL刺激后足细胞的paxillin强度和分布均未见明显改变,ox-LDL刺激24 h后,足突上paxillin的表达消失,paxillin仅细胞质内有表达(图3,见插页)。异硫氰荧光素标记的phalloidin可染色F-actin。24 h对照组的F-actin沿细胞轮廓和足突有序分布;24 h LDL刺激组的染色强度降低,但F-actin沿细胞轮廓分布仍可见;经ox-LDL刺激24 h后,未见足细胞中F-actin的正常分布,F-actin重新分布,结构紊乱(图3,见插页)。提示此时足突的骨架蛋白发生重构。

图3 氧化型低密度脂蛋白(ox-LDL)刺激组、LDL刺激组、对照组足细胞骨架蛋白paxillin、F-actin表达比较(免疫荧光染色,×250)
2.3 24hox-LDL刺激组、LDL刺激组、对照组足细胞凋亡情况比较 TUNEL检测显示,无论24 h对照组,还是24 h LDL和ox-LDL刺激组,均未观察到足细胞核着色(即发生凋亡)(图4,见插页),阳性对照观察到细胞核染色阳性。说明50 μg/ml的LDL和ox-LDL分别刺激24 h,均不足以完全激活足细胞凋亡通路,只引起足细胞nephrin表达下降等损伤性改变。

图4 24h ox-LDL刺激组、LDL刺激组、对照组足细胞凋亡情况比较(TUNEL法,×100)
2.4 ox-LDL刺激组和对照组足细胞SOD活性比较 12 h ox-LDL刺激组、12 h对照组、24 h ox-LDL刺激组、24 h对照组比较,12 h ox-LDL刺激组的SOD活性最高,NADH的氧化抑制率为(22.77±5.29)%,和其它3组相比均有统计学差异(均P<0.05),24 h ox-LDL刺激组的SOD活性较12 h ox-LDL刺激组下降,抑制率为(14.33±5.36)%,但差异无统计学意义(P >0.05)(图5),表明足细胞受到氧化刺激时会产生抗氧化能力,但若氧化刺激持续存在,抗氧化能力亦会逐渐下降。

图5 氧化型低密度脂蛋白(ox-LDL)刺激组和对照组足细胞超氧化物岐化酶(SOD)活性比较
2.5 ox-LDL刺激组、LDL刺激组、对照组足细胞nephrin及MAPK和GSK-3β信号通路情况比较 与12 h对照组相比,12 h ox-LDL刺激组、LDL刺激组足细胞nephrin表达水平无统计学差异(均P>0.05),提示12 h后的足细胞的nephrin表达暂未受到刺激的影响。p-MAPK/MAPK、p-GSK-3β/GSK-3β两组信号通路中,分别进行比值比较后均未见统计学差异(均P>0.05)(图6-7),说明尽管足细胞受到不同刺激,但是12 h后的MAPK、GSK-3β的活性无明显变化。
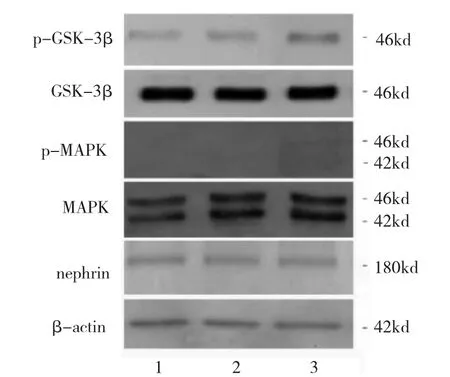
图6 12 h氧化型低密度脂蛋白(ox-LDL)刺激组、LDL刺激组、对照组足细胞nephrin及丝裂原活化蛋白激酶(MAPK)和糖原合成酶激酶3β(GSK-3β)信号通路蛋白表达电泳图(1:对照组;2:12 h LDL刺激组;3:12 h ox-LDL刺激组)
24 h LDL刺激组与24 h对照组相比,nephrin表达水平略有下降,而24 h ox-LDL刺激组和其它两组相比,nephrin表达水平降低(P<0.05),表明足细胞受到ox-LDL造成的氧化刺激24 h可引起严重损伤,导致其正常的裂孔膜蛋白表达下降。同样,与24 h对照组相比,24 h LDL刺激组的p-MAPK和MAPK比值、p-GSK-3β和GSK-3β比值均无统计学差异(均P>0.05);与24 h LDL刺激组和24 h对照组相比,24 h ox-LDL刺激组 p-MAPK和MAPK比值、p-GSK-3β和GSK-3β比值均明显增高(均P<0.05)(图8-9),MAPK和GSK-3β信号通路在ox-LDL刺激24 h后被激活。
3 讨论

图7 12 h氧化型低密度脂蛋白(ox-LDL)刺激组、LDL刺激组、对照组足细胞nephrin及丝裂原活化蛋白激酶(MAPK)和糖原合成激酶3β(GSK-3β)信号通路蛋白表达水平比较(a:nephrin表达水平比较;b:p-MAPK和MAPK比值;c:p-GSK-3β和GSK-3β比值)

图8 24 h氧化型低密度脂蛋白(ox-LDL)刺激组、LDL刺激组、对照组足细胞nephrin及丝裂原活化蛋白激酶(MAPK)和糖原合成酶激酶 3β(GSK-3β)信号通路蛋白表达电泳图(1:对照组;2:24 h LDL刺激组;3:24 h ox-LDL刺激组)
在过量自由基和其他致氧因素作用下,沉积在血管壁上的血浆LDL的多价不饱和脂肪酸发生过氧化,产生多种活性醛类,LDL载脂蛋白B中的赖氨酸残基与活性醛结合发生化学修饰,形成的产物为ox-LDL。高脂血症可以使ox-LDL在肾脏沉积、炎症细胞浸润、肾脏固有细胞增生和损伤、细胞外基质积聚及泡沫细胞形成,直接或间接地导致肾小球硬化。因此,ox-LDL是肾小球硬化进展的主要危险因素之一。近年研究发现,足细胞有摄取ox-LDL的受体[8],对足细胞的损伤可能通过RhoA激酶1介导的脂质自噬障碍[9]。笔者在前期研究中观察到2型糖尿病肾病的肾小球内存在氧化程度较重的ox-LDL沉积,且随着ox-LDL在肾小球内的沉积增加,足细胞的nephrin表达呈下降趋势。在有较多SOD-1表达的肾小球内,nephrin的表达相对增多。因此,本研究利用体外培养成熟的足细胞来观察ox-LDL作用足细胞后造成的损伤及足细胞抗氧化的反应,探讨可能的机制。
免疫荧光和Western blot的结果表明,与LDL刺激组和对照组相比,50 μg/ml的ox-LDL刺激足细胞12 h后,nephrin的蛋白表达强度、在足细胞上的分布,骨架蛋白paxillin和F-actin的活性,MAPK、GSK-3β的活性都未见显著变化,说明在50 μg/ml浓度的LDL、ox-LDL刺激下,12 h可能不足以造成足细胞损伤。以相同浓度的ox-LDL、LDL分别刺激足细胞24 h后,LDL刺激组nephrin表达有所下调,但骨架蛋白的分布未见明显改变,p-MAPK/MAPK、p-GSK-3β/GSK-3β 均略有增加,但与对照组相比未见统计学差异;ox-LDL刺激组的上述指标均发生了显著变化,nephrin表达显著降低,足突上骨架蛋白paxillin的表达消失,足细胞中phalloidin染色的F-actin发生了重构,同时p-MAPK/MAPK、p-GSK-3β/GSK-3β两组比值显著增加,提示这两条通路的激活可能参与足细胞的氧化损伤。TUNEL检测结果显示24 h未见凋亡细胞,证实24 h的50 μg/ml ox-LDL刺激尚不足以引起细胞凋亡,此时足细胞的损伤作用可能主要表现为裂孔膜复合体分子构成的变化和足突结构的重排。而使用80 μg/ml的ox-LDL作用于人的足细胞则可导致足细胞的凋亡和细胞内脂质的蓄积[10]。
MAPK 家族包括 c-Jun N-terminal kinase(JNK)、细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)和p38,是多种细胞外刺激(如生长因子)和周围环境刺激改变细胞功能的通路[11]。MAPK信号通路涉及多种磷酸化级联反应,每一种或者单独介导不同的信号事件或者与其它通路相连。本实验所使用的特异性抗体针对的是MAPK通路中ERK1/ERK2,因此观察的MAPK通路是ERK1/ERK2通路。而Hu等[12]的研究发现ox-LDL通过激活FAK/p38途径引起足细胞损伤。ERK1/p-ERK2和ERK1/ERK2的比值在LDL刺激组无明显变化,而在ox-LDL刺激组增加明显,表明ox-LDL具有激活ERK通路的作用。
GSK-3最早系调节糖原合成酶和磷酸化的激酶而被发现。有两种类型:GSK-3α和GSK-3β,两者结构高度相似,GSK-3可调控糖原代谢,并可调节多种底物的磷酸化。它的活性可被GSK-3α(ser21位点)和GSK-3β(ser9位点)磷酸化所抑制。本研究发现足细胞受ox-LDL刺激24 h后磷酸化的GSK-3β较其它两组增强,GSK-3β活性受到抑制。研究发现,GSK-3β的活性与Fyn酪氨酸激酶的活性相关。Fyn的活性对于nephrin细胞内段酪氨酸磷酸化具有重要调节作用。笔者推测,足细胞受到50 μg/ml的ox-LDL刺激24 h后,p-GSK-3β增加,造成活性下降,并可能导致Fyn的活性也下降,进一步使nephrin磷酸化减少,引起nephrin表达下调。但这一推测仍需进一步的深入研究才可能明确。

图9 24 h氧化型低密度脂蛋白(ox-LDL)刺激组、LDL刺激组、对照组足细胞nephrin及丝裂原活化蛋白激酶(MAPK)和糖原合成酶激酶3β(GSK-3β)信号通路蛋白表达水平比较(a:nephrin表达水平比较;b:p-MAPK和MAPK比值;c:p-GSK-3β和GSK-3β比值)
细胞骨架是维持真核细胞生命活动的重要组成成分。细胞维持正常的形态、保持细胞弹性,在细胞黏着、识别和相互的“交流”中,细胞骨架的正常分布具有重要作用。ox-LDL刺激足细胞24 h后,不同细胞骨架蛋白的分布也发生异常改变,这可能是足细胞损伤后足突结构发生改变、滤过屏障完整性受损的重要原因之一。Paxillin是分子量为68 kd的细胞骨架蛋白,在调节细胞的伸展和移行中起到重要作用。Paxillin的磷酸化依赖于GSK-3和ERK的双重调节作用,而磷酸化对它的生物活性的调节至关重要[13]。本研究发现的ERK1/ERK2通路激活和GSK-3β活性下降,推测可能是造成paxillin磷酸化改变以及细胞骨架蛋白重构的原因。
本研究还发现,暴露于ox-LDL刺激12 h后,足细胞的SOD活性会明显增加,高出同样条件对照组19.94%,而当该刺激持续24 h后,SOD活性仅比对照组高7.3%。结合12、24 h时这两个时间点的nephrin表达变化,再次肯定了笔者前期在2型糖尿病肾病患者肾活检中发现的现象,即SOD活性增加可保护足细胞免受氧化刺激损伤;若氧化刺激持续存在造成SOD耗竭,则会打破抗氧化和氧化之间的平衡,最终导致足细胞受到损伤,并且引发裂孔膜蛋白丧失、细胞骨架蛋白重构等一系列严重病理事件。
总之,本研究结果显示,体外培养的足细胞受到ox-LDL的氧化刺激后,早期可引起抗氧化物质SOD活性明显增加,足细胞并不出现损伤,而随着氧化刺激的持续存在,SOD的活性仅轻度升高,足细胞出现损伤,MAPK、GSK-3β两条信号通路的激活可能参与导致nephrin表达下调和细胞骨架蛋白重构这些病理事件的发生。
