假包膜外切除技术在生长激素型垂体腺瘤神经内镜下经鼻蝶手术中的应用
2020-10-15王西宪曹雷雨李鹏涛张庭荣周凯
王西宪,曹雷雨,李鹏涛,张庭荣,周凯
(新疆医科大学第一附属医院 神经外科,新疆 乌鲁木齐830054)
生长激素(growth hormone,GH)型垂体腺瘤是临床上常见的功能性垂体腺瘤之一,发病率为70/100万,虽然病程进展缓慢,但长期过渡分泌GH导致患者出现鼻翼增大、口唇肥厚等面容改变,并造成高血压、心脏扩大、呼吸暂停综合征等心血管系统和呼吸系统慢性并发症发生,严重危害患者健康,为患者正常工作生活带来了极大的困扰[1]。神经内镜下经鼻蝶手术治疗GH型垂体腺瘤创伤小,手术安全性高,疗效较佳,对改善该病患者的预后有重要意义。假包膜是垂体腺瘤压迫邻近的正常垂体组织形成的一层膜状结构。有学者[2]认为,利用假包膜外切除技术可以明显提高功能性垂体腺瘤的全切率。本研究回顾性分析我科2014年1月-2019年4月收住的接受神经内镜下经鼻蝶手术治疗的GH型垂体腺瘤患者,根据手术过程分为两组,术中可以明显分辨假包膜结构并沿假包膜分离切除瘤体者作为假包膜外切除组,术中无法分辨假包膜结构并采用假包膜内切除瘤体者作为假包膜内切除组。现报道如下:
1 资料与方法
1.1 一般资料
选取2014年1月-2019年4月我科收治的接受神经内镜下经鼻蝶手术治疗的GH型垂体腺瘤患者作为研究对象。入选标准:①符合GH型垂体腺瘤诊断标准;②行神经内镜下经鼻蝶手术治疗。排除标准:①复发GH型垂体腺瘤;②合并严重心、肝、肺等重要脏器疾病、不能耐受全麻手术者;③病理为非GH型垂体腺瘤。本研究共纳入118例患者,其中假包膜结构明显并采用假包膜外切除技术者作为假包膜外切除组(55例),假包膜结构无法辨认并采用假包膜内切除者作为假包膜内切除组(63例)。假包膜外切除组中,男26例,女29例,中位年龄41.5 岁,病程2 个月~6年;表现为肢端肥大48例,头痛32例,视力下降37例,视野缺损35例,四肢关节痛8例;肿瘤直径小于1.0 cm 的微腺瘤16例,肿瘤直径1.1~3.0 cm的大腺瘤29例,肿瘤直径大于3.0 cm的巨大腺瘤10例。假包膜内切除组中,男31例,女32例,中位年龄39.9岁,病程3个月~11年;表现为肢端肥大57例,头痛38例,视力下降40例,视野缺损37例,四肢关节痛11例;肿瘤直径小于1.0 cm 的微腺瘤18例,肿瘤直径1.1~3.0 cm 的大腺瘤32例,肿瘤直径大于3.0 cm的巨大腺瘤13例。118例患者的术者均来自同一手术团队,术后病理诊断均为GH 型垂体腺瘤。两组患者一般情况、肿瘤分级及影响手术效果的相关干扰因素比较,差异均无统计学意义(P>0.05),具有可比性。见表1。

表1 两组患者一般资料比较 例(%)Table 1 Comparison of the general data between the two groups n(%)
1.2 影像学检查
两组患者术前常规行垂体核磁平扫及增强,测量肿瘤直径大小,并根据Knosp分级法做垂体腺瘤侵袭性分级;术前常规行鞍区CT 平扫及三维重建,以评估患者蝶窦及筛窦分隔情况与气化程度;术前常规行头部CT 血管造影(CT angiography,CTA)检查,排除颅内动脉瘤等血管性病变;术后3 d内、术后3及6个月分别复查垂体核磁平扫及增强。
1.3 内分泌学检查
两组患者术前常规行随机GH、胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)水平测定和75 g 葡萄糖生长激素抑制试验(glucose growth hormone inhibition test,OGTT),并行垂体肾上腺轴、垂体甲状腺轴、垂体性腺轴激素水平检查,排除混合瘤可能;术后第1 天、术后第7 天及术后3 个月分别再次行随机GH、IGF-1水平测定和OGTT试验,评估患者是否生化治愈。
1.4 手术方法
采用双侧鼻孔KARL STORZ 0°和/或30°硬性广角内镜,扩张双侧鼻腔后,内镜下寻找蝶筛隐窝及右侧蝶窦开口,使用微型高频针状电极围绕蝶窦开口取倒C 形切口,分离黏膜瓣,于犁状骨根部切开鼻中隔,使用高速磨钻磨开蝶窦各壁,辨认斜坡隐窝和鞍底,类圆形磨开鞍底,切开鞍底硬膜,寻找假包膜。若假包膜结构明显,采用假包膜外切除技术切除瘤体后假包膜,若假包膜结构无法辨认,采用假包膜内切除瘤体。如术中发生脑脊液漏,取自体阔筋膜、脂肪填塞,重建鞍底,黏膜瓣覆盖术区。
1.5 观察指标
生化治愈标准:术后随机GH<1 μg/L或OGTT试验血清GH谷值<0.4 μg/L,并且IGF-1水平处于与患者年龄和性别相符合的范围内[1,3]。肿瘤全切除标准:术中神经内镜下见肿瘤全切,瘤腔周壁光整,无肿瘤团块,且术后3 d内、术后3及6个月复查垂体核磁增强,未见鞍区明显强化占位。尿崩症诊断标准:尿量大于200 mL/h,至少持续3 h[4]。
1.6 统计学方法
使用软件SPSS 20.0 进行统计学分析,计数资料采用例(%)表示,比较用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者肿瘤全切除率比较
两组患者肿瘤全切除率比较,差异有统计学意义(χ2=4.39,P=0.036);进一步分析Knosp分级为2 级和3 级的患者,两组肿瘤全切除率比较,差异有统计学意义(χ2=15.03,P=0.000;χ2=22.13,P=0.000),两组大腺瘤患者肿瘤全切除率比较,差异有统计学意义(χ2=16.50,P=0.000)。见表2。
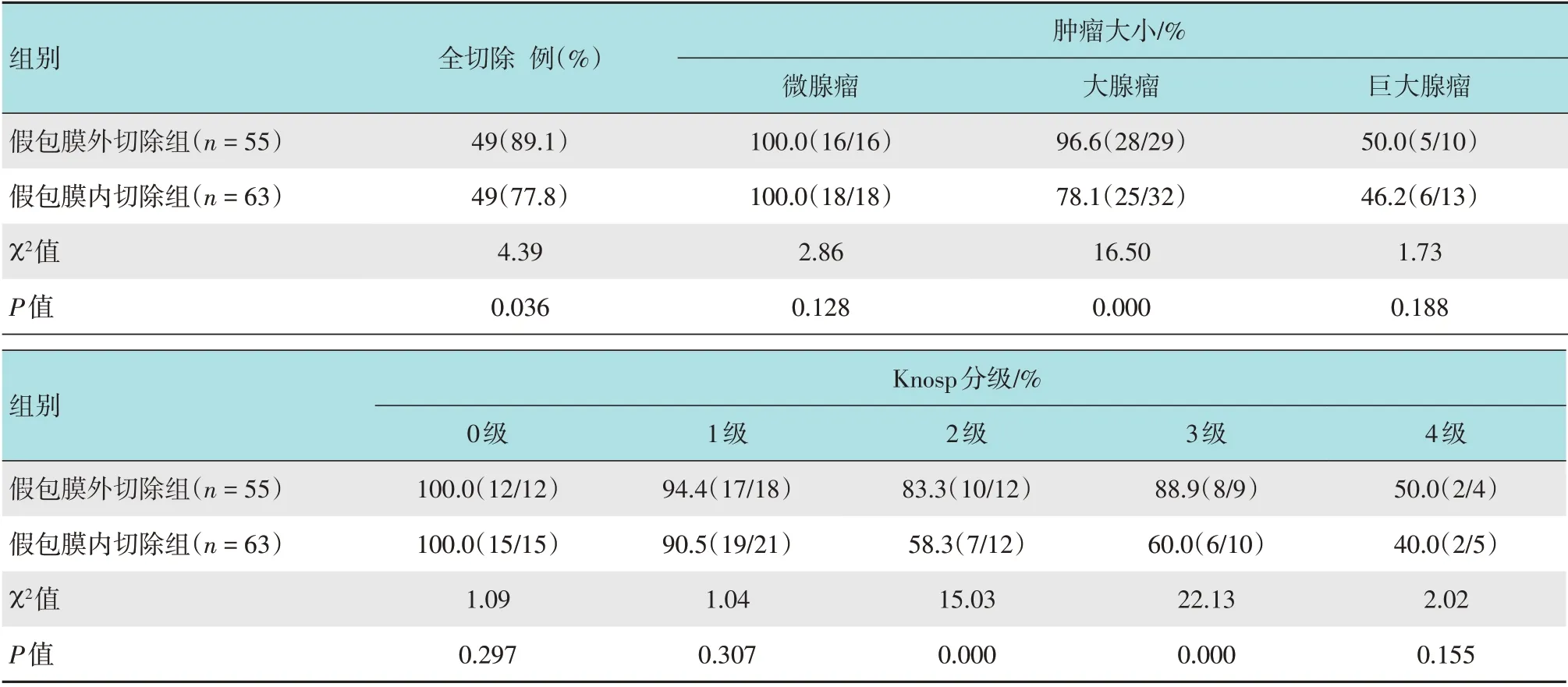
表2 两组患者全切除率比较Table 2 Comparison of the total tumor resection rate between the two groups
2.2 两组患者生化治愈率与并发症比较
术后假包膜外切除组生化治愈率87.3%(48例)明显高于假包膜内切除组55.6%(35例),差异有统计学意义(χ2=23.58,P=0.000)。术后两组患者永久性尿崩、脑脊液鼻漏、颅内感染及鼻腔出血等并发症比较,差异均无统计学意义(P>0.05)。见表3。
2.3 典型病例
术前增强MRI冠状位和矢状位显示腺瘤位于垂体右侧;术中将腺瘤和假包膜完全切除,术后复查MRI示肿瘤全切。见附图。

表3 两组患者手术并发症发生情况比较 例(%)Table 3 Comparison of the operative complications between the two groups n(%)
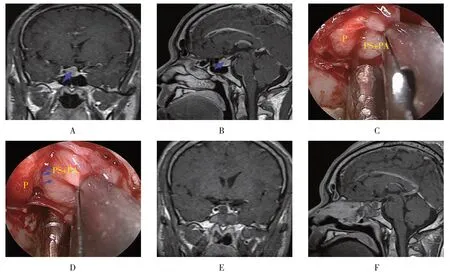
附图 有假包膜的GH型垂体腺瘤Attached fig.GH pituitary adenoma with pseudocapsule
3 讨论
GH 型垂体腺瘤约占垂体腺瘤的20%,多于中年以后起病,男女性发病率无差异,本研究中女性61例(51.7%),两组平均年龄分别为41.5和39.9岁,与相关文献[3]报道一致。GH 型垂体腺瘤长期过渡分泌GH,并导致体内IGF-1 水平病理性升高,使患者出现眉弓、颧骨隆起、下颌增大、手指和足趾增粗等骨骼异常改变;并导致心肌结构改变、心脏肥大,长期可出现心律失常、心功能障碍;同时影响呼吸系统,出现舌体及腺样体肥大,导致呼吸暂停综合征。体内GH 水平过高还会影响正常血糖调节,出现持续高血糖状态。GH型垂体腺瘤通过对体内多个系统的影响,增加患者死亡率[5]。
目前,神经内镜下经鼻蝶手术仍是治疗GH型垂体腺瘤的主要手段之一,能否完整切除肿瘤达到生化治愈,对GH 型垂体腺瘤预后至关重要。有研究[6]报道,神经内镜下利用假包膜外切除技术可以明显提高GH 型垂体腺瘤全切除率和术后生化治愈率。本研究表明,术后假包膜外切除组达到生化治愈48例,假包膜内切除组达到生化治愈35例,假包膜外切除组生化治愈率87.3%明显高于假包膜内切除组生化治愈率55.6%,差异有统计学意义(χ2=23.58,P=0.000)。
随着内镜技术的不断发展和高清内镜设备的出现,术中术者能够正确分辨精细解剖结构,使得假包膜外切除技术越来越成熟。垂体腺瘤假包膜并非腺瘤组织的包膜,而是腺瘤压迫邻近正常垂体组织形成的一层膜状结构,厚度约1.0 mm,由成纤维细胞、胶原纤维以及受压迫的部分垂体细胞构成,可以存在多种形态[7]。有研究[8]表明,垂体腺瘤假包膜与腺瘤类型存在相关性,在GH 型垂体腺瘤中发现比例约为55.0%,在各类腺瘤中位于前列。本研究假包膜外切除组占比为46.7%,略低于相关文献[8]报道,可能和样本量较小有一定关系。
本研究表明,假包膜外切除组肿瘤全切除率89.1%,明显高于假包膜内切除组肿瘤全切除率77.8%,两组比较,差异有统计学意义(χ2=4.39,P=0.036),提示沿假包膜界面钝性分离,可以更加彻底地切除GH 型垂体腺瘤。但术中需注意,GH 型垂体腺瘤假包膜表现为厚薄不一的多种形态,有时瘤体可侵袭假包膜导致假包膜界面不完整,术中分离时可能出现假包膜破碎,需要术者在神经内镜下仔细分辨和精细操作。当术中发现假包膜结构厚韧、完整时,一般可沿假包膜界面完整切除瘤体和假包膜,当发现假包膜结构脆弱或不完整或者瘤体较大时,可先采用包膜内瘤体减压取得一定空间后,再仔细寻找辨认假包膜结构,使用假包膜外切除技术切除残余瘤体和假包膜[9]。本研究显示,Knosp分级为2 级和3 级的患者,两组肿瘤全切除率差异有统计学意义(χ2=15.03,P=0.000;χ2=22.13,P=0.000),提示沿假包膜界面分离,可以及时判断瘤体是否突破假包膜侵袭周围结构,术者可以根据侵袭位置在安全的前提下扩大切除范围,尽可能地避免瘤体残留。有学者[2]认为,腺瘤瘤体直径超过2.0 cm 时,在压迫作用下大多会形成假包膜,但大腺瘤行假包膜外切除技术的要求很高,术中应注意充分磨除鞍底骨质暴露硬膜,切开鞍底硬膜时应仔细分辨,避免磨除过深破坏假包膜结构,小心分离硬膜下粘连,结合术前影像判断正常垂体组织位置,识别瘤体与正常垂体组织之间的关系,将瘤体表面残留的垂体囊和垂体组织向正常垂体方向分离,直至找到假包膜界面,使用明胶海绵或棉片保持假包膜界面,沿假包膜界面小心分离,当肿瘤较大时,可将已分离出的瘤体分块切除,获得空间后再沿假包膜界面继续分离,直至完全切除肿瘤,术中可使用多角度内镜观察术区死角,避免肿瘤残留。笔者在神经内镜下发现瘤体直径为1.0~3.0 cm的GH型垂体大腺瘤,尤其是肿瘤质地较韧者,假包膜界面常常较明显,术中可以做到肿瘤与假包膜的全切除。本研究显示,大腺瘤患者两组肿瘤全切除率比较,差异有统计学意义(χ2=16.50,P=0.000),与文献报道[10]结果相符。本研究术后假包膜外切除组生化治愈率为87.3%,假包膜内切除组为55.6%;假包膜外切除组肿瘤全切除率为89.1%,假包膜内切除组肿瘤全切除率为77.8%,显示术后生化治愈率差异更明显,分析原因可能为假包膜内切除组部分病例在进行肿瘤切除时,虽内镜下可见肿瘤全切,瘤腔周壁光整,无肿瘤团块,但仍残存部分肿瘤细胞,会继续分泌GH 并继发IGF-1 水平升高,术后未能达到生化治愈,而应用假包膜外切除技术的患者肿瘤切除则更彻底。
神经内镜下切除垂体腺瘤常见并发症包括永久性尿崩、脑脊液鼻漏、颅内感染及鼻腔出血等,本研究显示,假包膜外切除组术后脑脊液鼻漏发生率(3.6%)略低于假包膜内切除组术后脑脊液鼻漏发生率(6.3%),但差异无统计学意义,分析原因可能为假包膜外切除组术中操作时术者更谨慎、动作更轻柔,严重损伤鞍膈及蛛网膜导致的高流量脑脊液漏比例较小,故经术中封堵后,发生术后脑脊液漏的概率略低于假包膜内切除组。本研究两组患者共发生永久性尿崩3例,通过口服醋酸去氨加压素片(100~200 μg/次,3次/d,每日总剂量不超过1.2 mg),均可控制尿量;发生术后脑脊液鼻漏6例,2例通过腰大池置管引流脑脊液,4例通过神经内镜下脂肪填塞、阔筋膜修补漏口,均治愈;发生颅内感染21例,通过腰大池置管引流脑脊液,同时静脉滴注抗生素抗炎治疗,均治愈;发生鼻腔出血8例,3例通过鼻腔填塞压迫止血,5例通过血管造影明胶海绵颗粒栓塞出血血管,均治愈。本研究中,术后两组患者并发症发生情况差异无统计学意义(P>0.05),说明假包膜外切除技术的应用并不增加术后脑脊液鼻漏、垂体后叶功能低下等并发症的发生率,但术中操作时应注意仔细分辨瘤体周围膜性解剖结构,避免将垂体包膜误认为假包膜切除,从而损伤正常垂体组织。做假包膜外分离操作时,钳夹力量要始终作用于假包膜或瘤体上,动作需轻柔,应合理控制吸引器吸力,尽量避免损伤垂体柄、垂体后叶等正常垂体组织[11]。
综上所述,假包膜外切除技术可以明显提高GH型垂体腺瘤全切除率和术后生化治愈率,并不增加术后脑脊液鼻漏、垂体后叶功能低下等并发症的发生率,具有重要的临床意义。
