超高效液相色谱-四极杆飞行时间串联质谱测定牦牛肉中5'-肌苷酸和5'-鸟苷酸
2020-10-15任艳娇李伟丽
吴 韬,任艳娇,李伟丽
(西华大学食品与生物工程学院,四川 成都 610039)
超高效液相色谱(ultra performance liquid chromatography,UPLC)与普通高效液相色谱(high performance liquid chromatography,HPLC)方法相比具有更好分离度、更快分析速度和更高峰容量等优点[1-2]。而高分辨飞行时间质谱(high resolution time of flight mass spectrometry,TOF/MS)既可以利用一级质谱及二级碎片的准确质量数、离子丰度和标准品等对化合物进行准确定性分析,也可以采用采用多反应模式对目标离子对进行定量分析[3-4]。因此超高效液相色谱-四极杆飞行时间串联质谱同时具备上述2种方法的优点,具有高效分离、高分辨率和高灵敏度等特点,已经被广泛用于复杂体系中目标化合物的检测。
核苷酸类成分对食物风味增鲜有很大的影响,其主要包括以5'-肌苷酸(ionosine-5'-mono-phosphate,IMP)和5'-鸟苷酸(guanosine-5-monophosphate,GMP)为代表的5'-核苷酸及其衍生物[5]。研究表明,IMP、GMP两种物质在肉类中含量丰富,不仅具有显著的增鲜作用,而且对肉制品的各种风味具有一定的增减作用;因此,测定肉类食品中IMP、GMP含量对研究肉类食品风味及呈味物质之间的相互关系有着重要的意义[6-8]。国内外学者对食品中核苷酸含量进行了大量研究,常用的检测方法包括高效液相色谱法,分光光度法、高效毛细管电泳法等[9-12]。
牦牛肉与普通黄牛、水牛肉相比不仅具有低脂肪、低热量、高蛋白、多种氨基酸、肌肉纤维更丰富等特点。以往研究对牦牛肉中核苷酸研究还不充分,本试验拟采用超高效液相色谱-四级杆飞行时间串联质谱(UHPLC-QTOF-MS)技术,建立对牦牛肉中呈味核苷酸的定性、定量分析方法。
1 材料与方法
1.1 材料与试剂
牦牛肉由四川红原遛遛牛食品有限责任公司提供;三氯乙酸(分析纯),成都市科隆化学品有限公司;IMP标准品、GMP标准品,购自Sigma公司;甲醇(色谱纯级),购自Sigma公司;乙酸铵(分析纯),购自天津市科密欧化学试剂有限公司。
1.2 仪器与设备
超高效液相色谱仪,日本岛津仪器有限公司;X500飞行时间质谱,美国SCIEX公司;BT-25S分析天平,成都世纪方舟科技有限公司;Heto-HSC 500真空冷冻干燥机,上海佰蕾真生物科技有限公司。
1.3 试验方法
1.3.1 标准对照品溶液的配制
分别精确称量IMP、GMP标准品各1 mg(精确到0.01 mg),加水配制成1 mg/mL标准对照品储备液。取适量标准储备液加水逐级稀释为50×10-6、25×10-6、12.5×10-6、6.25×10-6、3.123 ×10-6、0.312 5×10-6系列标准溶液(标准溶液需当天配制)。
1.3.2 样品前制备
取500 g牛霖肉解冻后,切成0.1 cm厚的薄片于超低温冰箱预冻处理5 h后进行真空冷冻干燥,32 h后取出,冻干后的肉片粉碎备用。
1.3.3 样品制备
精确称取2.0 g样品粉末置于15 mL离心管中,加入10 mL 5%三氯乙酸溶液,涡旋震荡,超声波处理5 min,15 000 r/min离心10 min,取上清液过0.22 μm有机滤膜,上机待测。
1.3.4 色谱分析条件
色谱柱:采用C18色谱柱(2.1 mm×100 mm,1.9 μm粒径);色谱柱温度:40 ℃;流动相A为甲醇,流动相B为0.01%乙酸铵-水溶液(V/V);洗脱梯度如下:0~4 min,2%~98%A;4~6 min,100%A;6~8 min,100%~2%A;流速:0.25 mL/min;进样量:2 μL。
1.3.5 质谱分析条件
离子源:电喷雾离子源(electron spray ionization,ESI),负离子模式;扫描方式:多重反应监测(multiple reaction monitoring,MRM);气帘气(air curtain,CUR)241 kPa,离子化压力(ionization pressure,IS)5 500 V,温度(temperature,TEM)400 ℃,喷雾气(spray gas,GS1)310 kPa,辅助加热气(auxiliary heating gas,GS2)345 kPa,去簇电压(de-clustered voltage,DP)80 V,碰撞能量(collision energy,CE)10 V,质量扫描范围m/z 100~600。
1.4 IMP、GMP提取方法的优化
首先采用单因素对提取方法进行初步筛选,试验采用提取温度A(20、40、60、80、100 ℃)、提取时间B(10、20、30、40、50 min)、三氯乙酸体积分数C(1%、3%、5%、7%)对IMP、GMP提取进行研究。根据单因素分析,选取单因素最佳提取温度、时间、三氯乙酸体积分数进行L9(34)正交试验设计,通过正交分析,确定IMP和GMP最佳的提取组合。
1.5 方法学验证
为验证方法的准确性,将1.3.2制备的样品溶液稀释4倍后,选取高(50 μg/mL)、中(25 μg/mL)、低(12.5 μg/mL)质量浓度IMP标准溶液和高(6.25 μg/mL)、中(3.125 μg/mL)、低(0.312 5 μg/mL)质量浓度GMP标准溶液,按照加标体积与样品体积1∶3进行样品加标,在1.3.3与1.3.4方法条件下每个加标样品重复测定6次计算。基质效应以相同物质在基质溶液中标准曲线斜率与纯溶剂中标准曲线斜率来评价基质效应情况,通过公式(1)计算。
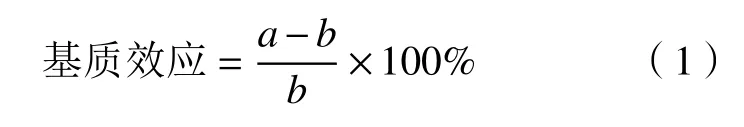
式中:a是基质校准曲线的斜率;b是溶剂校准曲线的斜率。
1.6 数据处理
高分辨质谱数据用Sciex公司的OS软件采集和定性定量处理分析,采用SPASS 17.0统计软件对正交结果数据进行分析。
2 结果与分析
2.1 IMP、GMP提取优化分析
为了准确测定样品中核苷酸的含量,首先采用正交试验对样品中核苷酸的提取工艺进行优化。根据预试验结果,选择提取温度20、40、60 ℃,提取时间10、20、30 min,三氯乙酸体积分数1%、3%、5%进行正交试验设计(L934)。
本次试验选择IMP和GMP两个含量为评价指标,因此需要对这两个指标进行加权综合评分[13-15]。由于IMP在样品中含量远远大于GMP,因此设置IMP权重为70%、GMP权重为30%。由表1可知,根据综合评分确定影响因素顺序为:三氯乙酸体积分数>提取时间>提取温度,说明三氯乙酸体积分数在IMP、GMP提取过程中有着重要作用,最佳理论提取条件组合为A2B2C3。由表2知,三氯乙酸体积分数对IMP、GMP提取具有较大显著性(P<0.05),提取时间和提取温度(P>0.05)对它的影响不明显,所以为了节约试验时间与成本,选取组合A1B1C3为最佳提取组合,即提取时间10 min、提取温度20 ℃、三氯乙酸体积分数5%。
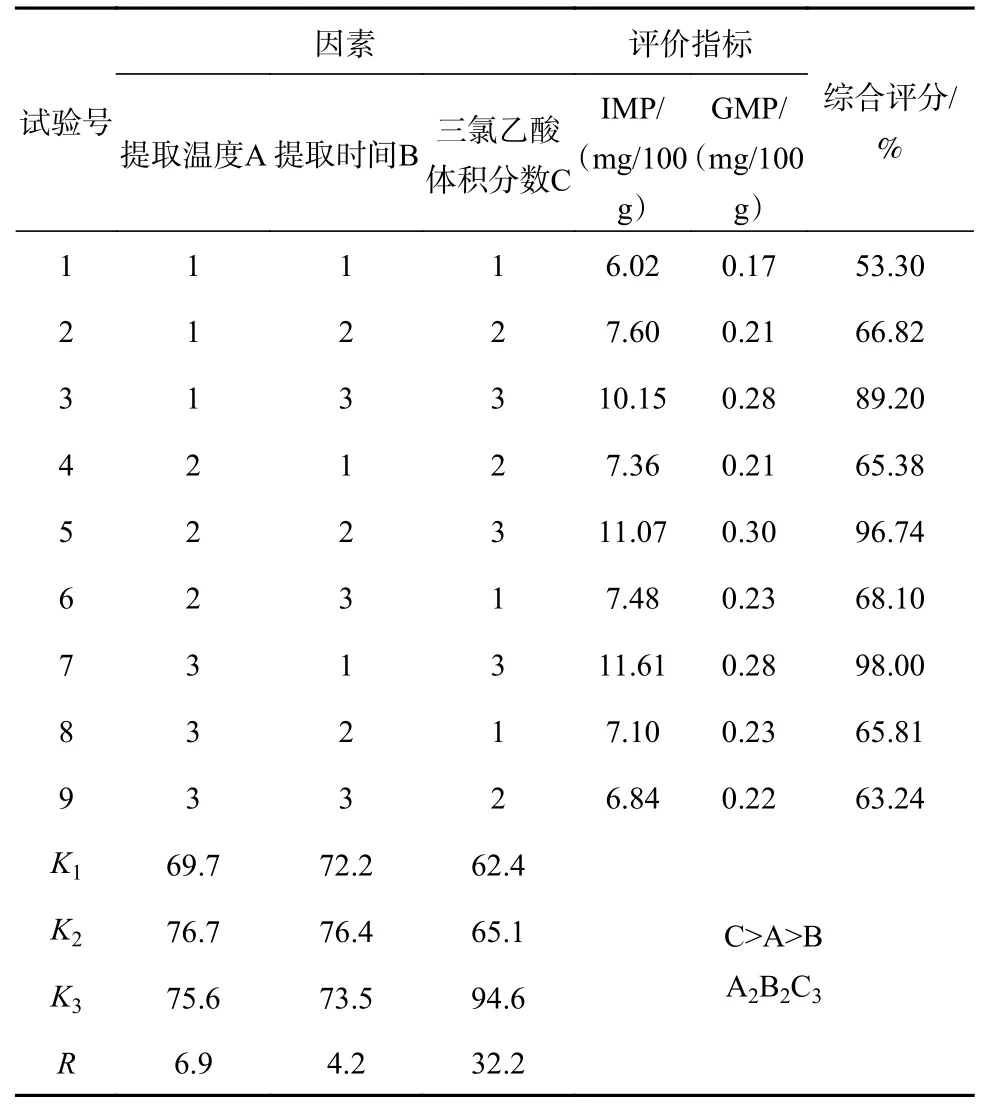
表1 正交试验结果
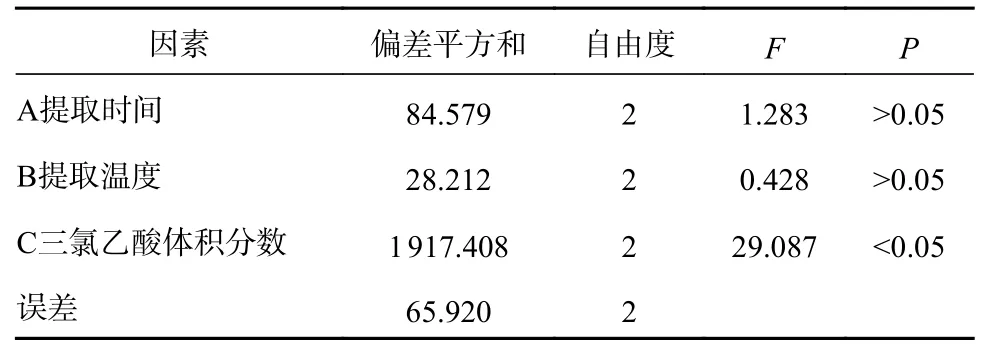
表2 方差分析
2.2 ESI离子源条件下GMP、IMP的定性、定量分析
2.2.1 IMP、GMP裂解机制分析
根据预试验分析得出,GMP和IMP在负离子扫描模式下离子响应值强度高于正离子模式,所以本试验采用负离子扫描模式对它们进行分析。在定量分析之前,首先需要对它们进行裂解机制研究,以便选择可靠、合适的离子对进行定量分析。图1为样品中IMP和GMP的二级色谱图及其可能的裂解途径。由图1(a)可知,IMP母离子m/z 347,产生4个主要碎片离子,分别为m/z 211、m/z 135、m/z 97和m/z 79。其裂解机制为核糖磷酸酯与次黄嘌呤间C—N键发生断裂形成m/z 211核糖磷酸酯和m/z 135次黄嘌呤,核糖磷酸酯间C—O键断裂形成m/z 97的磷酸,磷酸脱去1个水分子形成m/z 79。图1(B)为GMP的二级质谱图,由IMP与GMP分子结构看出,GMP在IMP基础上多了1个氨基,其裂解规律与IMP相似,其中m/z 150是由次黄嘌呤与氨基结合形成的鸟嘌呤。
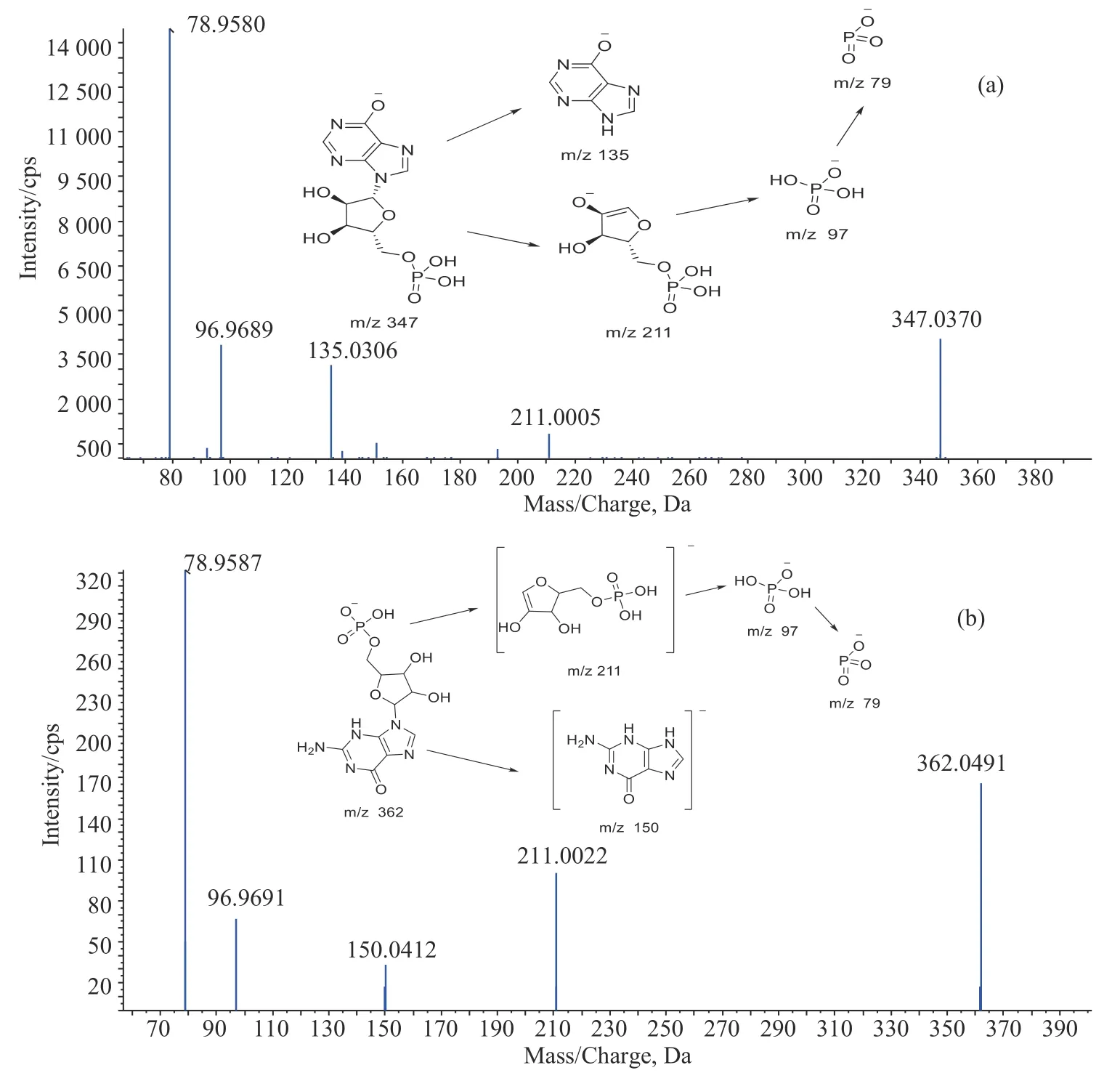
图1 牦牛肉样品中呈味核苷酸二级质谱图:(a)IMP,(b)GMP
2.2.2 IMP、GMP定量分析离子对选择
由图1可知,可以选择m/z 211离子作为定性离子,同时为了降低IMP与GMP的检出限,选择信号峰最强的离子对(362→79;347→79),采用多反映监测模式(MRM)对呈味核苷酸进行定量分析。
2.3 方法学考察
2.3.1 线性关系考察
分别将质量浓度为0.312 5、3.125、6.25、12.5、25、50 μg/mL的IMP、GMP系列标准溶液按照上述色谱、质谱条件进样分析,以峰面积y为纵坐标对核苷酸质量浓度x进行回归计算,绘制标准曲线。表3结果表明,在0.312 5~50 μg/mL质量浓度范围内,IMP和GMP的线性关系良好。IMP的检出限与定量限分别为0.06 和0.16 μg/mL,GMP的检出限与定量限分别为0.03 和0.13 μg/mL,只有高效液相色谱法检出限的1/15[16-19],表明UHPLC-QTOF-MS方法对测定IMP和GMP含量具有较高的灵敏度。RSD值小于或等于20%时,方法的精密度良好[20-22],由测定值可知,IMP与GMP精密度(RSD)分别为3.50%与1.80%,说明该方法符合精密度要求。
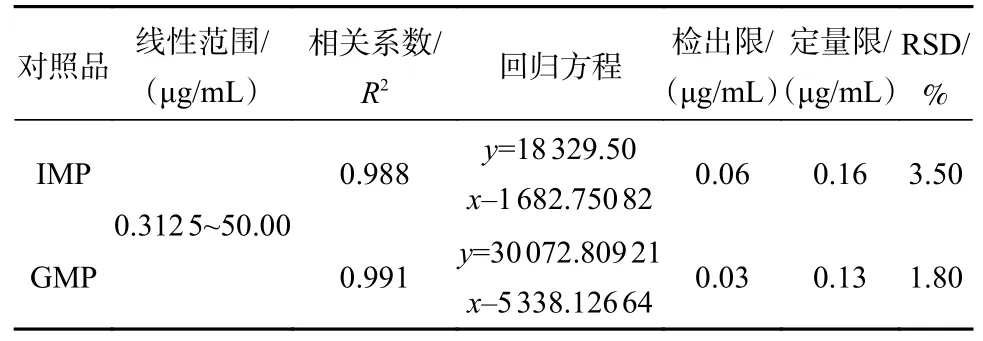
表3 方法学验证结果
2.3.2 方法的加标回收试验
由表4可知,IMP平均回收率为101.53%,标准偏差为3.63%,GMP平均回收率为96.27%,标准偏差为3.45%。根据SANTE/11 945/2015欧盟指南[20-22],回收率在70%~120%的范围内表明回收率良好,由结果可知,该测定方法的准确度符合要求,研究方法可行。
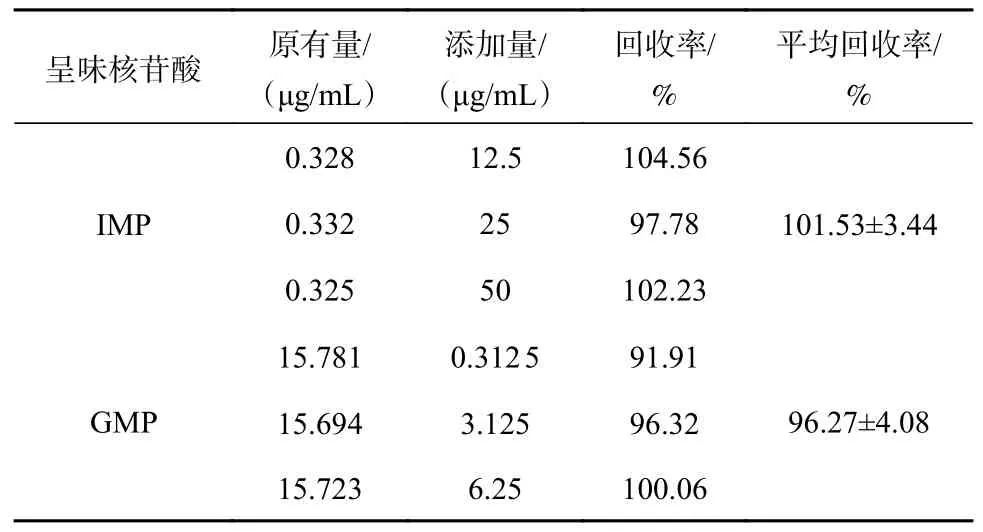
表4 样品中呈味核苷酸的回收率(n=6)
2.3.3 基质效应
基质效应是指样品中目标物以外的组分,与目标物共洗脱出的样品基质对目标物的离子化过程产生影响,造成离子化抑制或增强[23]。本试验基质效应采用样品提取溶液直接溶解IMP和GMP标准品,然后用样品提取溶液对其进行连续稀释。因为样品提取液中IMP含量较高,所以试验中将1.3.2制备的样品溶液稀释4倍后进行标准品的配制及梯度稀释。最终IMP加标质量浓度范围为16.10~65.78 μg/mL,GMP加标质量浓度范围为0.65~50.33 μg/mL。
研究[24-25]表明,|基质效应|≥50%被认为具有强的基质效应,20%≤|基质效应|<50%被认为具有一定的基质效应,|基质效应|<20%可认为无基质效应。同时,当基质效应>0时,表明该样品基质对目标物离子化过程具有增强作用,基质效应<0时认为该样品基质对目标物离子化造成抑制作用。由表5可知,IMP和GMP基质效应均<0,说明该样品基质对IMP和GMP的离子化具有抑制作用。IMP的|基质效应|为26.21%,超过了20%,说明基质对其定量分析有影响,因此采用基质校准曲线对样品中IMP的含量进行计算。而GMP的|基质效应|为16.27%,表明基质对GMP的定量分析影响不显著,因此采用标准曲线直接计算牦牛肉中GMP含量。

表5 基质效应和校准曲线
2.3.4 样品中IMP、GMP的定量分析
按照本试验建立的方法,分别取5块不同部位的牦牛肉进行定量分析。由表6可知,1号样品中IMP、GMP含量最高,5号样品中两物质含量最低。其IMP含量范围在10.21~32.61 mg/100 g,GMP含量范围在0.24~0.46 mg/100 g。结果表明,不同部位的牦牛肉的核苷酸含量差异显著。
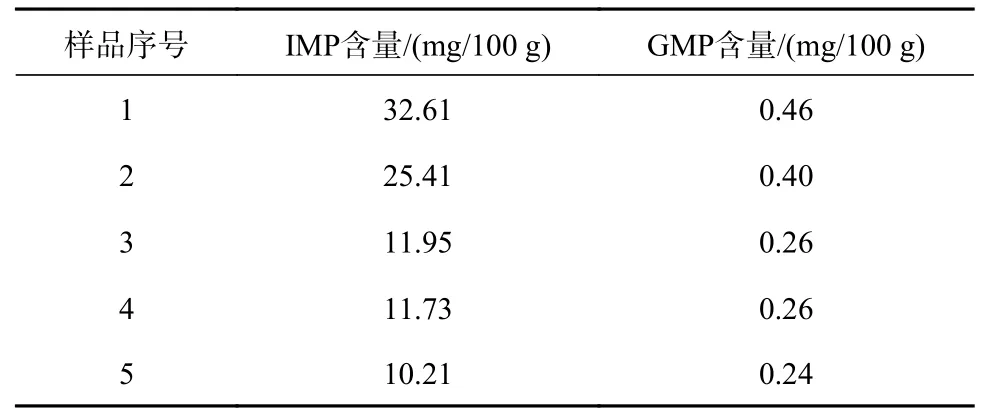
表6 牦牛肉中IMP、GMP定量分析结果
3 结论
本文首次建立了UHPLC-QTOF-MS快速测定牦牛肉中IMP和GMP的分析方法。采用正交试验对提取方法工艺条件进行了优化,并对IMP和GMP二级质谱的裂解行为进行了详细解析。方法学研究表明,本研究建立的方法具有较好的准确性和重复性,可为牛肉及其他生鲜品中呈味核苷酸的测定提供数据及方法支持。
