茶氨酸对酒精诱导人肝HL7702细胞损伤的保护作用及机理
2020-10-15李玉锋邓杨龙
李玉锋,袁 源,张 庆,邓杨龙
(西华大学食品与生物工程学院,四川 成都 610039)
酒作为一种人们日常消费的饮品在生活中扮演着重要角色,适当的饮酒对人的身体有益,但是长期、过量等不合理饮酒方式会对人体产生极大的伤害,酒精性肝病(Alcoholic liver disease,ALD)便是其中最突出的代表[1],它是由于长期无节制的饮酒导致的慢性中毒性肝损伤疾病。近几年该病发病率不仅在国内甚至是全世界范围内都呈逐渐上升趋势,目前在我国,酒精性肝病已经成为仅次于甲肝、乙肝等病毒性肝炎的第二大肝病[2]。一般患有严重酒精性肝病的患者往往会伴随有其他并发症,如高血压、高血脂、动脉硬化等,会严重危害人体健康,甚至导致死亡[3]。作为一种由长期饮酒而导致的慢性肝脏疾病,人们对其基本生化特征以及病理特征的了解己很清楚,但其致病机制尚未阐述明确。ALD的发病机制较为复杂,与多种因素有关,其中氧化应激和脂质过氧化已经得到许多学者的认同,被认为是酒精致肝损伤的主要原因[4-5]。除此之外,还包括炎症和免疫反应产生损伤以及局部缺氧、营养不良和病毒的叠加作用,这些都加重了肝脏病理性损伤的进程[6]。
目前关于L-茶氨酸对酒精诱导肝损伤保护与修复的论文不多。He等[7]采用D-氨基半乳糖制造大鼠肝损伤模型发现,L-茶氨酸可以显著抑制谷丙转氨酶和谷草转氨酶的升高,减轻D-氨基半乳糖造成的肝脏损伤。Sugiyama等[8]通过实验证实,L-茶氨酸在细胞内可以代谢为谷氨酸,有利于补充GSH含量,避免了阿霉素引起的GSH含量下降,从而防止脂质过氧化和氧化应激反应。在L-茶氨酸和酒精性肝损伤关系的探索方面,Sadzuka等[9]通过采用急性酒精性肝损伤模型证实,腹腔注射L-茶氨酸能够提升ADH和ALDH活性,抑制活性CYP2E1的升高,加速了酒精代谢的同时避免CYP2E1激活导致的呼吸链亢进和脂质过氧化。Sadzuka的这项研究从乙醇代谢有关的酶的角度证实了L-茶氨酸能够抑制酒精性肝损伤,但没有深入探讨抗氧化物质和酒精性肝损伤之间的关系。本文以不同浓度的茶氨酸提取物预保护模型浓度酒精处理过的细胞,测定细胞存活率,检测其过氧化氢(H2O2)、丙二醛(MDA)、超氧化物歧化酶活性(SOD)、谷胱甘肽过氧化物酶(GSH-PX)含量及总抗氧化能力(T-AOC)水平,系统地从细胞氧化损伤及氧化应激方面研究关键酶和代谢产物对人体肝细胞的影响及茶氨酸的保护作用与机理。
1 材料与仪器
1.1 药品与试剂
茶氨酸提取物(纯度>90%)来自西华大学食品与生物工程学院实验室;RPMI-1 640培养基、胎牛血清购自北京兰杰柯有限公司;青链霉素购自美国美伦公司;0.25%胰蛋白酶购自美国HyClone公司;MTT试剂购自美国西格玛公司;PBS缓冲溶液购自Biosharp公司;过氧化氢测试盒(H2O2)、谷胱甘肽一过氧化物酶测试盒(GSH-PX)、超氧化物歧化酶测试盒(SOD)、总抗氧化能力测定试剂盒(TAOC)、丙二醛检测试剂盒(MDA)购自南京建成生物工程研究所。
1.2 仪器与设备
Molecular Devices SpectraMaxi3X型多功能酶标仪(美谷分子仪器有限公司);3 543型CO2培养箱(美国赛默飞世尔科技公司);BCN-1360B生物洁净工作台(哈尔滨东联电子技术开发公司);IX-50倒置显微镜(日本奥林巴斯公司);LD5-10低速台式离心机(北京医用离心机厂);UV-2 600紫外可见分光光度计(上海尤尼柯仪器有限公司);HHS-数显恒温水浴锅(江苏省金坛市医疗仪器厂)。
1.3 实验细胞
HL7702人体正常肝细胞株购自上海华文生物科技有限公司。
2 实验方法
2.1 细胞的复苏及传代培养
细胞的复苏[10]。将装有细胞的冻存管在37 ℃恒温水浴中解冻,1 640完全培养基(含10%胎牛血清和1%青链霉素)37 ℃预热,吸取解冻的细胞悬浮液于装有5 mL 1 640完全培养基的培养皿中,轻微晃动混匀,放入37 ℃、5%CO2恒温培养箱中培养,每隔8 h观察及换液,供传代处理或细胞种板。
细胞传代培养。将从冰箱中拿出的培养基和胰酶放入37 ℃培养箱中进行预热处理。取出培养皿,在显微镜下观察细胞的状态及细胞密度等,当细胞融合90%以上时即显微镜下细胞布满整个培养皿底部时便可进行传代[11]。在酒精灯外焰附近进行如下操作:吸走原培养基,然后吸取PBS溶液润洗培养皿,随后加入l mL胰酶,在37 ℃环境中进行消化,1~3 min后拿出在显微镜下观察,观察到细胞形态变化即变圆并且开始贴壁松动后,吸去胰酶中止消化,反复多次吸取培养基,轻轻吹打培养皿底部,使细胞基本脱落。将消化并吹打后的细胞悬液用移液枪移至10 mL离心管内,1 600 r/min转速下离心4 min;去除上清液,用移液枪往其中加入2 mL 1 640完全培养基,之后用巴氏吸管吹打使离心管中的细胞充分分散在培养基内形成细胞悬液;将细胞悬液用移液枪移取适量至事先预热的含有5 mL培养基的培养皿中,在显微镜下观察细胞的密度以及状态后,置于培养箱(37 ℃,5%CO2)中培养。
2.2 酒精损伤模型的建立方法
1)MTT法原理及试剂的配制。依据Yang 等[12]所述,活细胞线粒体中的琥珀酸脱氢酶能与MTT反应,形成不溶于水的蓝紫色结晶甲臜,利用二甲基亚砜能够溶解甲臜,在酶标仪490 nm处测定溶液吸光值,根据公式(1)计算细胞生存率,该方法可间接反映活细胞的数量。

以PBS缓冲液为溶剂将MTT配成浓度为5 mg/ml的溶液。首先取20 mLPBS缓冲液于50 mL规格的无菌离心管中,从中吸取约1 mL缓冲液至装有MTT试剂的离心管内,反复吹打至混合均匀,倒入PBS缓冲液中混匀,重复操作几次避免MTT管内残留液体。完全混匀后,用0.22 μm滤膜过滤,分装避光在-20 ℃以下环境可长期保存。
2)模型的建立。选取生长处于对数周期且细胞融合为90%的HL7702细胞均匀接种于96孔板中,约5 000个/孔,培养24 h。设置只有培养基的空白对照组,培养基加细胞的正常对照组。实验组以500 mmol开始分别选取梯度为100 mol的6个酒精浓度处理细胞,每组设置4个平行复孔。24 h后,MTT法测定细胞存活率:每孔加入配制好的MTT溶液20 μL,继续孵育4 h后,用巴氏吸管轻轻吸取孔内培养液,随后每孔内加入150 μL的DMSO终止反应,电动震荡器上震荡10 min,使结晶物充分溶解,立即以自动酶标仪测定490 nm波长处各孔光吸收值。各组别实验结果以设置的4个平行数据的平均值表示计算细胞的存活率,最终筛选细胞生存率在50%左右的酒精浓度确定为造模浓度[13]。
2.3 考察茶氨酸适宜作用浓度范围的方法
选取生长处于对数周期且细胞融合为90%的HL7702细胞均匀接种于96孔板中,约5 000个/孔,培养24 h。设置不做茶氨酸处理的正常对照组,茶氨酸处理组分别以200、400、600、800、1 000、2 000 μg/mL浓度的茶氨酸培养,每组设置4个平行复孔。24 h后用MTT法测定细胞存活率,计算细胞存活率,筛选茶氨酸对HL7702细胞作用适宜的浓度范围。
2.4 考察茶氨酸对酒精损伤的HL7702细胞生存率影响的方法
选取生长处于对数周期且细胞融合为90%的HL7702细胞均匀接种于96孔板中,约5 000个/孔,培养24 h。正常对照组:不做处理。模型组:根据实验2.2确定的造模浓度对细胞进行处理。茶氨酸组:预先加入200、400、600、800 μg/mL浓度的茶氨酸处理24 h后,再加入造模浓度的酒精共同培养24 h,每组设置4个平行复孔。利用MTT法测定细胞存活率,计算各组细胞生存率,探究茶氨酸对酒精损伤HL7702细胞生存率的影响。
2.5 考察茶氨酸对HL7702细胞保护作用的方法
选取生长处于对数周期且细胞融合为90%的HL7702细胞均匀接种于96孔板中,约5 000个/孔,培养24 h。按照2.4中方法设置正常对照组、模型组和茶氨酸组培养后,参照李金莲[14]裂解细胞的方法,在低温冷冻离心机中离心10 min,得到可以用于检测的上清液。按照试剂盒说明书的操作步骤测定细胞的MDA、H2O2含量以及SOD、GSH-PX活性和T-AOC水平。
MDA的含量水平反映了肝细胞氧化损伤程度。SOD的主要功能是清除自由基,在一定程度上反映了氧化应激反应的程度[15]。H2O2是一种重要的ROS,氧化性较强,可以直接作用于一些酶的巯基,使酶失去活性。GSH-PX是一类广泛存在于机体内,能催化过氧化氢分解的重要酶,也是GSH对H2O2的还原反应的特异催化酶,能起到保护细胞膜结构和功能完整的作用[16]。人体抗氧化防御系统的强弱与其健康程度有密切关系,通过测定细胞总抗氧化能力可反映细胞抗氧化防御系统的强弱。
2.6 统计学处理
实验数据以平均数±标准差表示,采用统计软件SPSS 19.0进行统计分析处理,统计学方法应用单因素方差分析(ANOVA),组间多重比较采用邓肯(Duncan)检验。P<0.05为差异有统计学意义。
3 实验过程及实验结果
3.1 酒精损伤模型的建立
预实验用100~500 mmol浓度进行处理,与对照组相比,细胞在该酒精浓度范围的生存率无显著差异,因此选择500~1 000 mmol浓度酒精继续进行处理,倒置显微镜下观察酒精对HL7702细胞损伤形态学改变。由图1可以观察到,不同浓度酒精处理后的细胞形态与对照组比较,随着酒精浓度升高,细胞由原有的梭性形态慢慢变小,边缘逐渐模糊,失去原有形状,呈不规则形态。用MTT法检测细胞生存率,MTT检测结果显示,随着酒精浓度的升高,细胞的生存率下降(p<0.05)。根据数据显示的实验结果,选取800 mmol的酒精浓度作为损伤模型浓度。具体结果见表1。
3.2 茶氨酸对细胞毒性的浓度筛选
选取0、200、400、600、800 μg/mL浓度的茶氨酸对细胞进行处理。实验发现与对照组相比,在该浓度范围内细胞的生存率变化不大。持续加大茶氨酸浓度到1 000、2 000 μg/mL,由图2可知,各浓度的茶氨酸对HL7702细胞均无明显的毒性作用,相反有一定的增殖作用,当茶氨酸浓度达到200 μg/mL时,其对HL7702细胞的增殖效果最明显。因此,判断茶氨酸浓度在2 000 μg/mL以下对HL7702细胞无毒性。根据茶氨酸在实际情况中的含量,选择200~800 μg/mL浓度范围的茶氨酸进行后续实验。
3.3 茶氨酸对酒精损伤HL7702细胞生存率的影响

图1 不同浓度酒精处理细胞形态学的变化
表1 不同浓度酒精对细胞生存率的影响(n=4,)
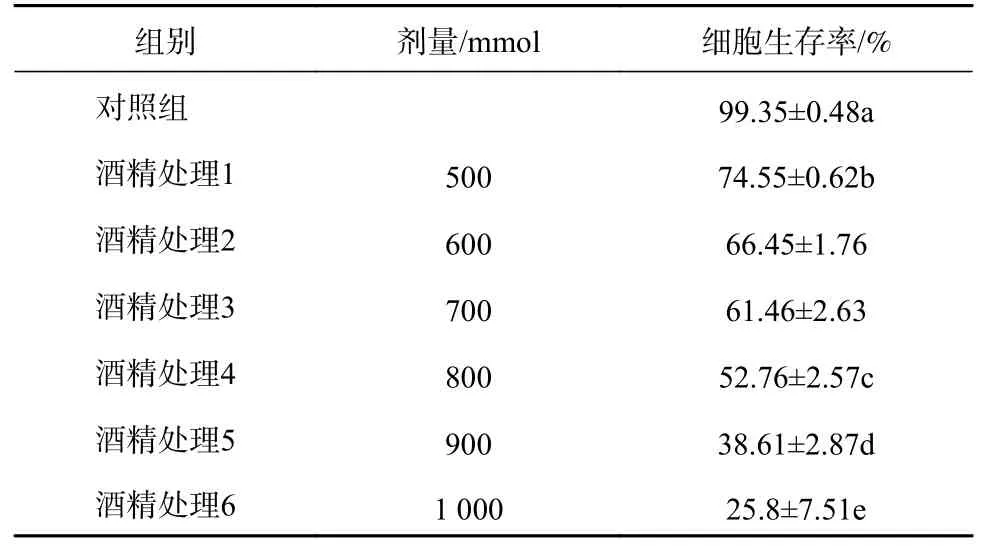
表1 不同浓度酒精对细胞生存率的影响(n=4,)
注:同列数据标记不同小写字母表示显著性差异(p<0.05)。
利用MTT比色法得到各组别细胞存活率,正常组(阴性对照组)细胞存活率为99.75%,模型组(阳性对照组)细胞存活率为53.43%。数据显示800 mmol酒精损伤的模型组存活率明显降低(p<0.01),具有统计学意义。茶氨酸处理组与模型组比较,经酒精损伤后的HL7702细胞在200、400、600、800 μg/mL的茶氨酸预保护24 h后细胞生存率分别提高到57.76%、64.76%、70.26%、78.66%(p<0.05),细胞生存率随着茶氨酸浓度的增加而升高。此实验证明茶氨酸对酒精损伤HL7702细胞具有一定的保护作用,结果见表2。
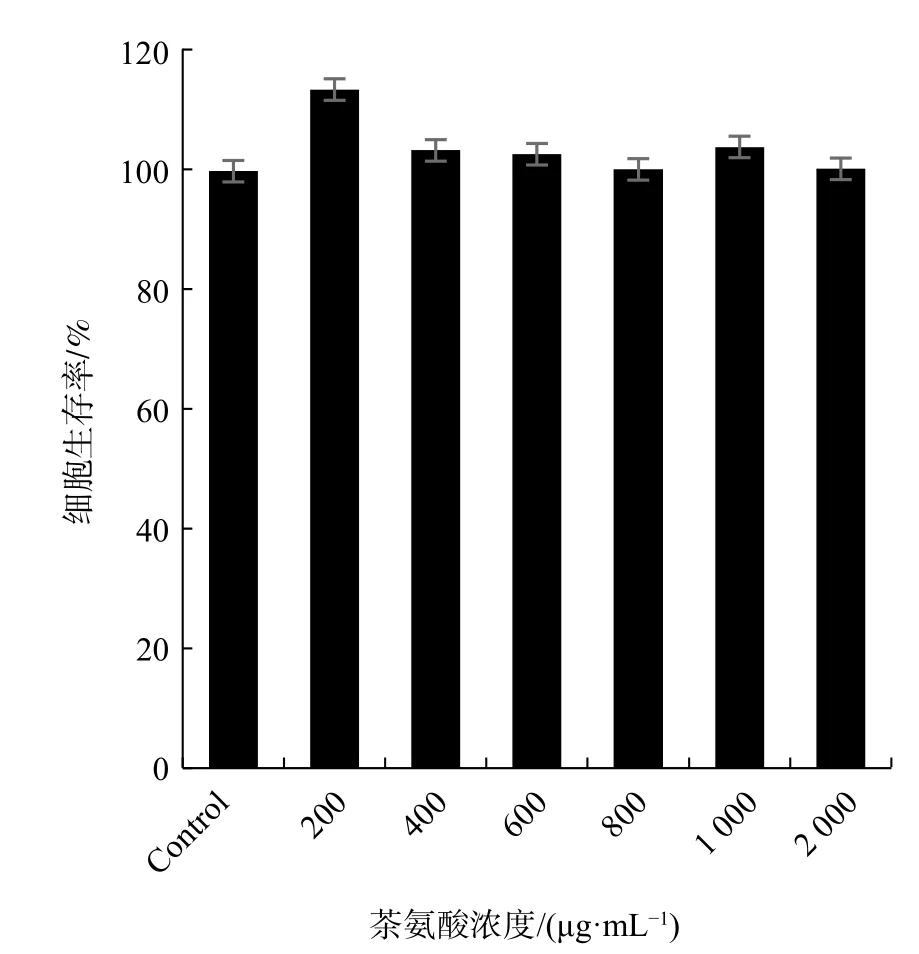
图2 不同浓度茶氨酸对细胞生存率的影响
3.4 茶氨酸对T-AOC、SOD、GSH-PX、MDA、H2O2含量的影响
茶氨酸对模型细胞H2O2、GSH-PX、SOD、MDA、T-AOC水平的影响见表3。根据表3的数据,模型组与正常组相比,T-AOC、SOD、GSH-PX含量减少,MDA、H2O2的含量增加,差异具有统计学意义(p<0.05)。茶氨酸组与模型组相比,T-AOC、SOD、GSH-PX含量增加,MDA、H2O2的含量降低,差异具有统计学意义(p<0.05)。
表2 不同浓度茶氨酸对酒精损伤细胞生存率的影响(n=4,)
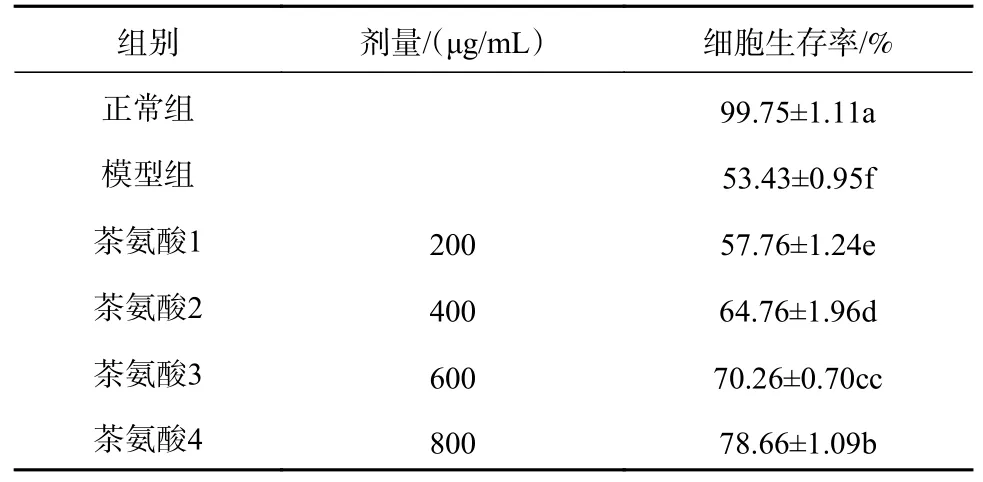
表2 不同浓度茶氨酸对酒精损伤细胞生存率的影响(n=4,)
注:同列数据标记不同小写字母表示显著性差异(p<0.05)。
4 茶氨酸的作用机理
H2O2是一种重要的活性氧成分,过量的H2O2会对细胞造成氧化损伤。GSH-PX是能催化分解H2O2,使GSH和H2O2发生还原反应的特异催化酶。通过测定酒精处理HL7702细胞中的H2O2含量及GSH-PX酶活性可知,酒精在肝细胞中氧化产生大量的H2O2,并抑制了GSH-PX的活性,使得大量的H2O2不能分解,肝细胞发生了较为严重的氧化损伤。茶氨酸预保护后,与模型组相比,GSH-PX活性显著升高,H2O2含量显著下降,提示细胞内的氧化损伤程度有所缓解,并与茶氨酸的浓度呈剂量依赖型。茶氨酸通过抑制酒精刺激下GSH-PX活性的降低,从而抑制了H2O2含量升高的作用机理,对酒精诱导发生氧化损伤的人正常肝细胞起到保护作用。
当氧化与抗氧化作用失衡,细胞内便会发生氧化应激反应,SOD在机体氧化和抗氧化平衡中具有重要作用,主要功能是清除自由基,在一定程度上反映了氧化应激反应的程度。配合测定MDA含量与SOD活性,SOD活力高低间接反应了机体清除氧自由基的能力,而MDA含量高低间接反应了细胞受到自由基攻击的程度。在酒精诱导损伤的人正常肝细胞中,实验显示MDA含量明显升高,表明在细胞中发生了较为严重的脂质过氧化反应,SOD活性显著降低,提示细胞内的氧化和抗氧化平衡被破坏,细胞内发生了一定程度的氧化应激反应。
茶氨酸预保护后,与模型组相比,MDA含量显著下降,提示机体细胞受到自由基攻击的程度减弱,而SOD活性升高,表明细胞清除氧自由基能力增强,氧化应激反应受到了一定程度的抑制。茶氨酸通过抑制酒精刺激下SOD活性的降低,从而抑制MDA含量升高的作用机理,对酒精诱导发生在人正常肝细胞内发生的氧化应激反应起到了抑制作用,从而对人正常肝细胞起到保护作用。
细胞总抗氧化能力与细胞的健康程度呈正相关。通过测定茶氨酸预保护后的人肝细胞抗氧化能力,与酒精损伤组相比,茶氨酸保护组的抗氧化能力得到了显著的提高,印证了细胞内氧化损伤程度显著降低,表明了茶氨酸通过提升细胞的抗氧化能力,从而对酒精损伤的人肝细胞起到保护作用。
综上所述,茶氨酸通过抑制酒精刺激下抗氧化关键酶活性的降低及氧化反应中间产物的产生,抑制酒精刺激下细胞总抗氧化能力的下降,维持细胞内抗氧化关键酶的活力,稳定细胞内代谢产物的含量,保持了细胞内氧化和抗氧化平衡,从而避免人正常肝细胞在酒精诱导下发生的氧化损伤及氧化应激反应。
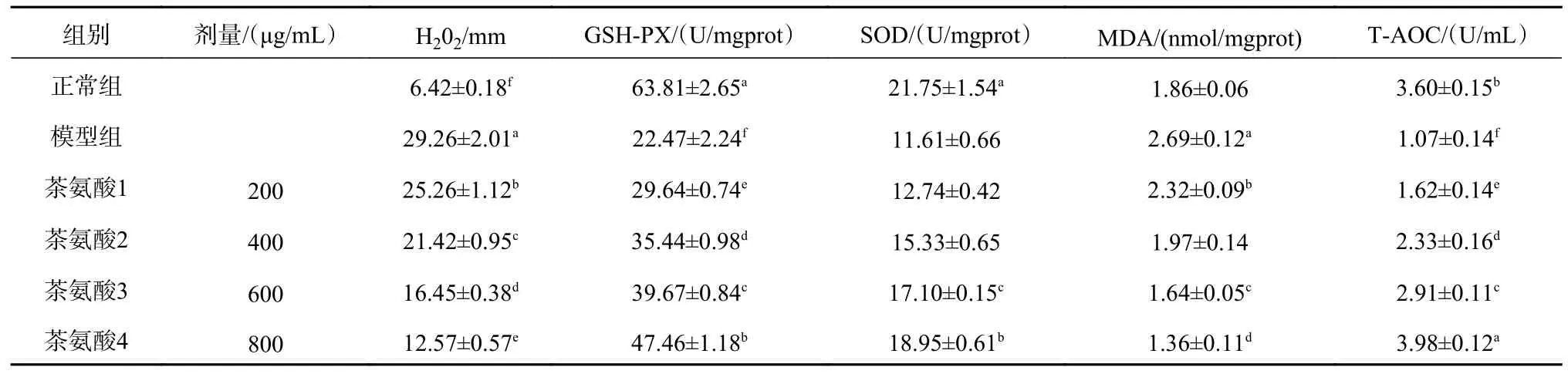
表3 茶氨酸对模型细胞H2O2、GSH-PX、SOD、MDA、T-AOC水平的影响(n=4,x¯ ±s)
5 结论
本文用不同浓度的茶氨酸预保护酒精损伤的HL7702肝细胞,测定其生存率,实验结果表明茶氨酸在细胞发生氧化损伤及氧化应激反应方面均被证明对酒精诱导人正常肝细胞氧化损伤具有一定的保护作用。茶氨酸作为茶叶中主要的生物活性成分之一,已经证实其安全无毒副作用,弥补了其他药物在防治酒精性肝损伤时可能存在毒副作用的不足[17],为防治酒精性肝损伤药物的研发提供了新的理论基础及思考方向。
